海洋寄生甲藻血卵渦鞭蟲生活史及溫度對其發展的影響*
呂曉陽 黃 騫 李 蒙 劉煒鑫 李才文,3,4①
(1. 中國科學院海洋研究所 海洋生態與環境科學重點實驗室 山東青島 266071; 2. 青島海洋科學與技術試點國家實驗室海洋生態與環境科學功能實驗室 山東青島 266237; 3. 中國科學院大學 北京 100049; 4. 中國科學院海洋大科學研究中心山東青島 266071)
血卵渦鞭蟲(Hematodiniumspp.)是一類感染海水甲殼類的致病性寄生甲藻(parasitic dinoflagellates),目前在世界范圍內感染40 多種蟹、蝦類, 包括多種重要野生(如美國蘭蟹、蛛雪蟹和挪威龍蝦)及養殖經濟物種(如三疣梭子蟹和擬穴青蟹)(Stentifordet al,2005; Liet al, 2021a)。該寄生甲藻主要寄生在甲殼動物宿主的血淋巴和血腔內, 在體內大量增殖, 引起宿主重要器官、組織(如心臟、肝胰腺和鰓等)發生功能紊亂甚至喪失, 最終導致宿主死亡(Stentifordet al,2005; Wheeleret al, 2007; 王金鳳等, 2015)。近年來,我國浙江舟山、廣東汕頭、山東半島、河北和天津等沿海主要經濟蟹類養殖區均報道發現了血卵渦鞭蟲的分布存在, 其感染宿主包括三疣梭子蟹(Portunus trituberculatus)、擬穴青蟹(Scylla paramamosain)、脊尾白對蝦(Exopalaemon carinicauda)和斑節對蝦(Penaeus monodon)(許文軍等, 2007a, 2007b, 2010; Liet al, 2008, 2021a; 李才文等, 2014; Wanget al, 2017;王印庚等, 2017)。自2013 年首次被報道發現以來, 山東沿海三疣梭子蟹養殖池塘中血卵渦鞭蟲流行病頻繁暴發, 給當地養殖戶造成了嚴重的經濟損失(Liet al, 2013; Wanget al, 2017)。最近研究發現, 山東沿海混合養殖池塘周邊的野生天津厚蟹(Helice tientsinensis)是血卵渦鞭蟲的重要輪轉宿主和潛在病原來源, 在混合養殖系統中的血卵渦鞭蟲傳播擴散過程中發揮重要作用(Huanget al, 2019, 2021; Liet al, 2021b)。
血卵渦鞭蟲的生活史比較復雜。基于體外連續培養體系, 目前僅對分離自挪威龍蝦(Nephrops norvegicus)和美國蘭蟹(Callinectes sapidus)的兩個血卵渦鞭蟲株系開展了較為完整的生活史研究(Appletonet al, 1998;Liet al, 2011)。結果表明, 這兩個株系具有大致相似的生活史, 均經歷了絲狀滋養體、蛛網狀滋養體、蛛網狀孢子體、團塊狀聚合體、孢子母細胞、孢子前細胞和孢子等生活史階段。感染我國近海三疣梭子蟹、天津厚蟹的血卵渦鞭蟲與感染美國蘭蟹及歐洲港口蟹(Liocarcinus depurator)的血卵渦鞭蟲株系遺傳進化關系相近, 屬于典型種Hematodinium perezi的不同基因型(肖潔等, 2015; Huanget al, 2019)。團隊研究人員通過建立體外培養, 前期也發現了分離自三疣梭子蟹的血卵渦鞭蟲株系的多個典型生活史階段(Wanget al, 2017), 但是仍缺乏對于我國近海血卵渦鞭蟲株系完整生活史的系統研究。開展對分離于不同宿主的血卵渦鞭蟲株系的生活史研究, 有助于了解該寄生甲藻的復雜生活史, 明確其傳播擴散過程中的關鍵生活史階段, 并進一步揭示血卵渦鞭蟲的流行病學特征。
血卵渦鞭蟲在野生和養殖甲殼類宿主群體中的流行感染具有季節性特征, 在挪威龍蝦中的感染高峰期為冬春季(Fieldet al, 1992, 1998; Stentifordet al,2001), 在美國蘭蟹中的感染高峰期為秋季和次年春季(Messicket al, 2000; Sheppardet al, 2003), 在白氏雪蟹(Chionoecetes bairdi)和三疣梭子蟹中的感染高峰期為夏季(Meyerset al, 1990; Eatonet al, 1991;Loveet al, 1993; Wanget al, 2017)。Huang 等(2021)發現環境水體溫度與血卵渦鞭蟲宿主感染率呈顯著正相關關系, 當水溫高于25 °C 時宿主感染率明顯較高。體外培養實驗結果表明, 溫度可顯著影響血卵渦鞭蟲的細胞生長發育, 感染挪威龍蝦的血卵渦鞭蟲株系在8~15 °C 的體外培養條件下能夠進行正常生長發育(Appletonet al, 1998), 而感染美國蘭蟹的血卵渦鞭蟲株系在低于15 °C 的體外培養條件下生長、增殖緩慢甚至停滯, 無法完成生活史(Liet al, 2011)。此外, 美國蘭蟹體內血卵渦鞭蟲形成、釋放孢子的最適溫度為25 °C (Huchin-Mianet al, 2018)。以上研究結果表明, 溫度與血卵渦鞭蟲的生活史密切相關, 可能是影響血卵渦鞭蟲流行病發生的重要環境因子。
本文通過血涂片法、H&E 染色法(hematoxylineosin staining, 蘇木精-伊紅染色法)和體外培養方法系統研究了從我國沿海天津厚蟹中分離的血卵渦鞭蟲株系的生活史, 詳細描述了血卵渦鞭蟲在感染宿主體內(血淋巴、組織)和體外培養體系中的各生活史階段的細胞形態, 并進一步探究了溫度對血卵渦鞭蟲生活史發展的影響, 以進一步豐富和完善我們對于海洋寄生甲藻血卵渦鞭蟲的科學認知, 為經濟甲殼動物漁業生產中血卵渦鞭蟲流行病的有效防控提供理論依據。
1 材料與方法
1.1 實驗天津厚蟹及病原采集
1.2 血卵渦鞭蟲感染檢測
血淋巴檢測: 參照Stentiford 等(2005)的血涂片法對天津厚蟹中血卵渦鞭蟲的感染程度和生活史階段進行檢測。具體步驟如下: 75%酒精對天津厚蟹第五腹肢基部擦拭消毒, 采用1 mL 無菌注射器于其關節膜處抽取約200 μL 血淋巴, 將1~2 滴血淋巴(剩余血淋巴置于100%乙醇中保存, 用于血卵渦鞭蟲感染的后續PCR 確認分析)滴于載玻片上并與等體積的中性紅溶液(重量體積比0.04%, 過濾海水)混合, 在顯微鏡(Olympus BX53)下進行觀察并拍照。根據200×顯微鏡視野下觀察到的血卵渦鞭蟲數量(分別為<10,10~100, >100), 將每個個體的血卵渦鞭蟲感染程度分為輕度、中度和重度感染(Wanget al, 2017)。無明顯感染(血涂片中未觀察到血卵渦鞭蟲)的血淋巴樣本歸為未感染; 對多次鏡檢無明顯感染的個體進行PCR 檢測確認(Huanget al, 2021), 僅通過PCR 檢測呈陽性的感染歸為輕度感染, PCR 檢測呈陰性的感染歸為未感染。
組織病理檢測: 采集經過血淋巴檢測確定感染的天津厚蟹肝胰腺、心臟、鰓和步足肌等組織樣品,在波恩氏液中固定48 h 后轉移到70%酒精中長期保存或進行下一步處理; 參照Wheeler 等(2007)的方法,通過石蠟切片技術處理固定組織樣品, 并用蘇木精、伊紅(H&E)染色, 切片經脫水封片后于顯微鏡(Olympus BX53)下觀察天津厚蟹組織內的血卵渦鞭蟲形態并拍照記錄。
1.3 宿主體內血卵渦鞭蟲生活史
選取重度感染的天津厚蟹作為病原供體, 75%酒精擦拭其第五附肢基部關節膜處, 采用1 mL 無菌注射器抽取血淋巴液, 使用血球計數板對血淋巴中血卵渦鞭蟲進行計數。隨后選取30 只規格一致(甲寬23~28 mm)、活性好的健康天津厚蟹, 每只個體從第五附肢基部關節膜處注射20 μL 前述感染天津厚蟹的血淋巴液(約2×105個蟲體細胞)。將注射后的天津厚蟹個體單獨裝入帶孔透明塑料盒(10.5 cm×10.5 cm×4.0 cm)中, 飼養于裝有30 L 過濾海水的充氧塑料水箱中[溫度(20±2) °C, 鹽度30±1], 每周投喂蛤蜊肉2 次。自注射感染開始, 每隔5~6 天對30 只感染天津厚蟹進行隨機抽樣檢測(初始樣本量為5), 進行血淋巴檢測以確定宿主感染程度及宿主體內血卵渦鞭蟲的生活史階段, 并進行組織病理樣品采集和處理(見1.2)。
1.4 體外培養條件下血卵渦鞭蟲生活史
參照分離自三疣梭子蟹中血卵渦鞭蟲株系的體外培養方法(Wanget al, 2017), 分離純化天津厚蟹中的血卵渦鞭蟲進行體外培養。培養液組分包括三疣梭子蟹血清、胎牛血清和Nephropssaline 緩沖液(Appletonet al, 1998)(體積比為1∶2∶17), 且每100 mL 培養液中加入1 mL 青鏈霉素混合液(規格: 100 μg/mL), 采用0.2 μm 針頭濾器除菌備用。從重度感染的天津厚蟹第五附肢基部的關節膜處抽取適量血淋巴液(約0.5~1.0 mL), 加入到含有10 mL 培養液、底面積為25 cm2的無菌細胞培養瓶中, 室溫黑暗條件下靜置20 min, 然后將懸浮液小心地轉移到一個新無菌培養瓶中, 室溫黑暗條件再靜置20 min (可重復懸浮液轉移、靜置操作數次, 直至去除宿主血細胞及其他雜質),分離純化血卵渦鞭蟲細胞。將分離純化獲得的血卵渦鞭蟲懸浮液2 mL 加入10 mL 培養液中, 形成終體積為12 mL 的體外培養體系, 放置在培養箱中于25 °C黑暗條件下進行培養。定期(每隔5~7 天)更換50%體積的培養液, 定期(每隔 1~2 天)采用倒置顯微鏡(Olympus IX71)觀察血卵渦鞭蟲的生活史階段, 并拍照記錄。
1.5 溫度對宿主體內血卵渦鞭蟲生活史的影響
通過前述血淋巴注射感染方法(見1.3)人工注射感染90 只健康天津厚蟹, 分配到10、15、20、25、30 °C 實驗組, 其中10 °C 實驗組10 只天津厚蟹、其余實驗組各20 只天津厚蟹, 分別飼養于裝有30 L 過濾海水的充氧塑料水箱(鹽度30±1)。為避免實驗動物對溫度突變的應激反應, 各水箱自室溫20 °C 開始每隔3 h 緩慢調升或調降2 °C 至相應實驗設定溫度, 實驗期間每周投喂兩次蛤蜊肉、去除殘餌并及時換水保持水質清潔。在注射感染第10、第15、第20 天分別對5 個實驗組注射感染天津厚蟹進行隨機抽樣檢測(n=5), 進行血淋巴檢測評估宿主感染程度并確定血卵渦鞭蟲生活史階段(見1.2), 記錄各實驗組天津厚蟹存活個數, 并根據各實驗組存活個體數確定實驗過程中后續取樣檢測的時間點及樣本量。
1.6 溫度對體外培養條件下血卵渦鞭蟲生活史的影響
從重度感染的天津厚蟹中分離純化獲得血卵渦鞭蟲, 參考前述血卵渦鞭蟲體外培養方法(見1.4)建立體外培養。分別在5 個溫度梯度下(10、15、20、25 和30 °C, 每個溫度梯度設置3 個實驗重復)進行體外培養實驗, 實驗培養體系均為12 mL、起始濃度均為104cells/mL。培養瓶置于不同設定溫度的培養箱中黑暗條件下培養, 定期更換培養液、觀察生活史階段并拍照記錄。
2 結果
2.1 血卵渦鞭蟲在宿主體內的生活史及其形態學特征
在不同時間點對注射感染天津厚蟹的血淋巴進行了血卵渦鞭蟲感染程度及生活史階段的取樣檢測(表1)。在注射感染天津厚蟹的血淋巴中發現了血卵渦鞭蟲的多種生活史階段, 包括絲狀滋養體、類變形蟲滋養體、團塊狀聚合體、孢子母細胞、孢子前細胞和孢子等。特別是絲狀滋養體(圖1a), 又稱蠕蟲狀滋養體,存在于輕度感染的宿主血淋巴中, 在常規顯微鏡觀察中往往不易被發現。絲狀滋養體一般呈蠕蟲狀, 個體大小差異大[(41.6±11.5) μm,n=25], 能夠在宿主血淋巴中進行蠕動、彎曲和伸展運動。血卵渦鞭蟲大多數生活史階段細胞內的溶酶體能夠主動吸收中性紅而被染成亮紅色, 便于顯微觀察和鑒定。
治療前,2組患者的FMA-UE、ARAT、FTHUE-HK、MAL-AOU、 MAL-QOM、MBI評分差異無統計學意義。治療后,2組患者FMA-UE、ARAT、FTHUE-HK、MAL-AOU、MAL-QOM、MBI評分與治療前比均有顯著提高(均P<0.05),治療后2組間比較,gmCIMT組患者的FMA-UE、ARAT、FTHUE-HK、MAL-AOU及MAL-QOM評分的改變比常規組更加顯著(均P<0.05),MBI評分2組間差異無統計學意義。見表1,2。

表1 血卵渦鞭蟲感染在天津厚蟹血淋巴中的發展過程Tab.1 The development of H. perezi infection in haemolymph of H. tientsinensis
在感染前期(5~10 天), 宿主血淋巴中存在少量的血卵渦鞭蟲絲狀滋養體與類變形蟲滋養體(圖1b), 仍存在大量血細胞。在感染中期(10~25 天), 宿主血淋巴中血卵渦鞭蟲細胞數量顯著增加, 主要形態包括類變形蟲滋養體和團塊狀聚合體(圖1c), 以及少量絲狀滋養體。在感染后期(≥26 天), 宿主血淋巴中充斥大量血卵渦鞭蟲細胞, 僅存在少量的血細胞; 部分宿主血淋巴中血卵渦鞭蟲以類變形蟲滋養體形式大量存在, 而部分宿主血淋巴中血卵渦鞭蟲以大量孢子母細胞(圖1d)、孢子前細胞(圖1e, 1f)及游動孢子(圖1g, 1h)形式存在; 且宿主陸續死亡。感染后期, 部分瀕死宿主釋放孢子(局部密度可達109cells/mL)。
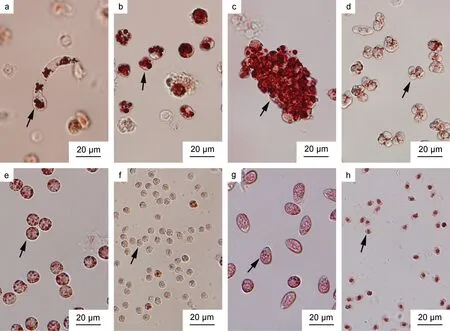
圖1 天津厚蟹血淋巴中血卵渦鞭蟲各生活史階段Fig.1 Life stages of H. perezi found in haemolymph of mudflat crabs H. tientsinensis
組織病理學檢測結果顯示, 宿主的心臟、肝胰腺和鰓等組織中均存在血卵渦鞭蟲感染, 并且發現了血卵渦鞭蟲的多個生活史階段, 包括絲狀滋養體、類變形蟲滋養體、蛛網狀滋養體、團塊狀聚合體、孢子母細胞、孢子前細胞和孢子等。絲狀滋養體(圖2a)零星發現于輕度感染宿主的組織中, 類變形蟲滋養體(圖2b)、蛛網狀滋養體(圖2c)和團塊狀聚合體(圖2d)常見于中度、重度感染宿主的組織中, 而孢子母細胞(圖2e)、孢子前細胞(圖2f, 2g)和孢子(圖2h, 2i)出現在重度感染宿主的組織中。
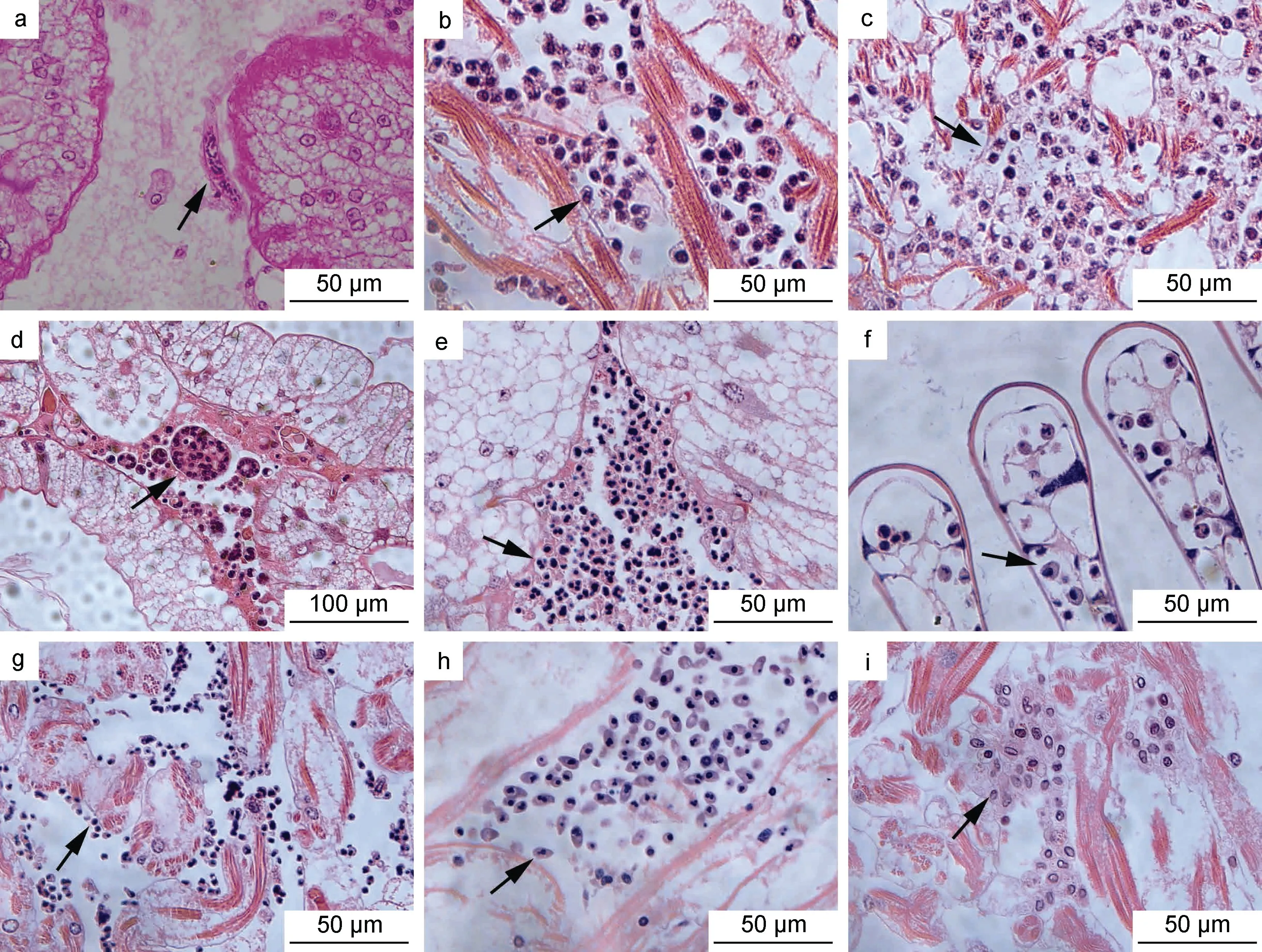
圖2 天津厚蟹組織中血卵渦鞭蟲各生活史階段Fig.2 Life stages of H. perezi found in tissues of mudflat crabs H. tientsinensis
2.2 血卵渦鞭蟲在體外培養條件下的生活史及其形態學特征
從我國沿海野生天津厚蟹體內分離獲得不同生活史階段的血卵渦鞭蟲細胞, 成功建立了由類變形蟲滋養體開始的體外連續培養體系。在以類變形蟲滋養體為培養起點的體外培養過程中, 血卵渦鞭蟲先后經歷了類變形蟲滋養體、蛛網狀滋養體、團塊狀聚合體、孢子母細胞、孢子前細胞、孢子等生活史階段。
類變形蟲滋養體(圖3a)呈不規則的球形, 大小不等, 直徑約為8~16 μm [(12.2±1.5) μm,n=25]; 類變形蟲滋養體在宿主血淋巴或體外培養中幾乎沒有運動,常規顯微觀察時其形態大小與血細胞相近, 但是類變形蟲滋養體內部的溶酶體結構能夠主動吸收中性紅變成亮紅色, 而宿主血細胞幾乎不能吸收中性紅,因此可根據是否含有染成亮紅色的溶酶體結構來區分這兩種細胞。培養初期, 類變形蟲滋養體會逐漸貼壁, 黏附在培養瓶底部, 隨后形成偽足分支, 蟲體之間通過偽足相互連接, 形成合胞體網絡即早期的蛛網狀滋養體(圖3b)。隨著偽足不斷生長發育, 相互接觸的蛛網狀滋養體彼此結合, 形成成熟龐大的蛛網狀滋養體。
蛛網狀滋養體后期階段, 蛛網狀滋養體逐漸從培養瓶底部脫落, 偽足結構逐漸消失, 蟲體細胞間互相黏附形成大小不等的團塊狀聚合體(圖3c)(團塊狀聚合體的大小由聚合的細胞數量決定), 之后團塊狀聚合體中的蟲體細胞逐漸分散, 形成分散的、單獨的類變形蟲滋養體細胞。實驗發現將團塊狀聚合體或團塊狀聚合體分散后的類變形蟲滋養體轉移到新鮮培養液中, 能夠重新開始形成蛛網狀滋養體。
在蛛網狀滋養體后期還有一條發展路徑, 蛛網狀滋養體從培養瓶底部脫落, 形成孢子母細胞(圖3d)。孢子母細胞呈不規則球形, 其直徑約為11~15 μm[(13.2±1.1) μm,n=25], 對于中性紅染液的吸收能力較弱, 不易被染色。孢子母細胞或形成聚集體, 或以單個細胞的形式在培養液中分布, 隨后進一步發展形成孢子前細胞。大孢子前細胞(圖3e)呈球形, 直徑約為10~13 μm [(11.9±0.5) μm,n=25], 其大小形態與類變形蟲狀滋養體相似, 但是類變形蟲狀滋養的溶酶體結構能夠迅速吸收中性紅染液而被染成亮紅色,而孢子前細胞對于中性紅染液吸收能力不強, 染色較弱。小孢子前細胞(圖3f)形狀呈球形, 直徑約為6~8 μm [(6.5±0.5) μm,n=25]。
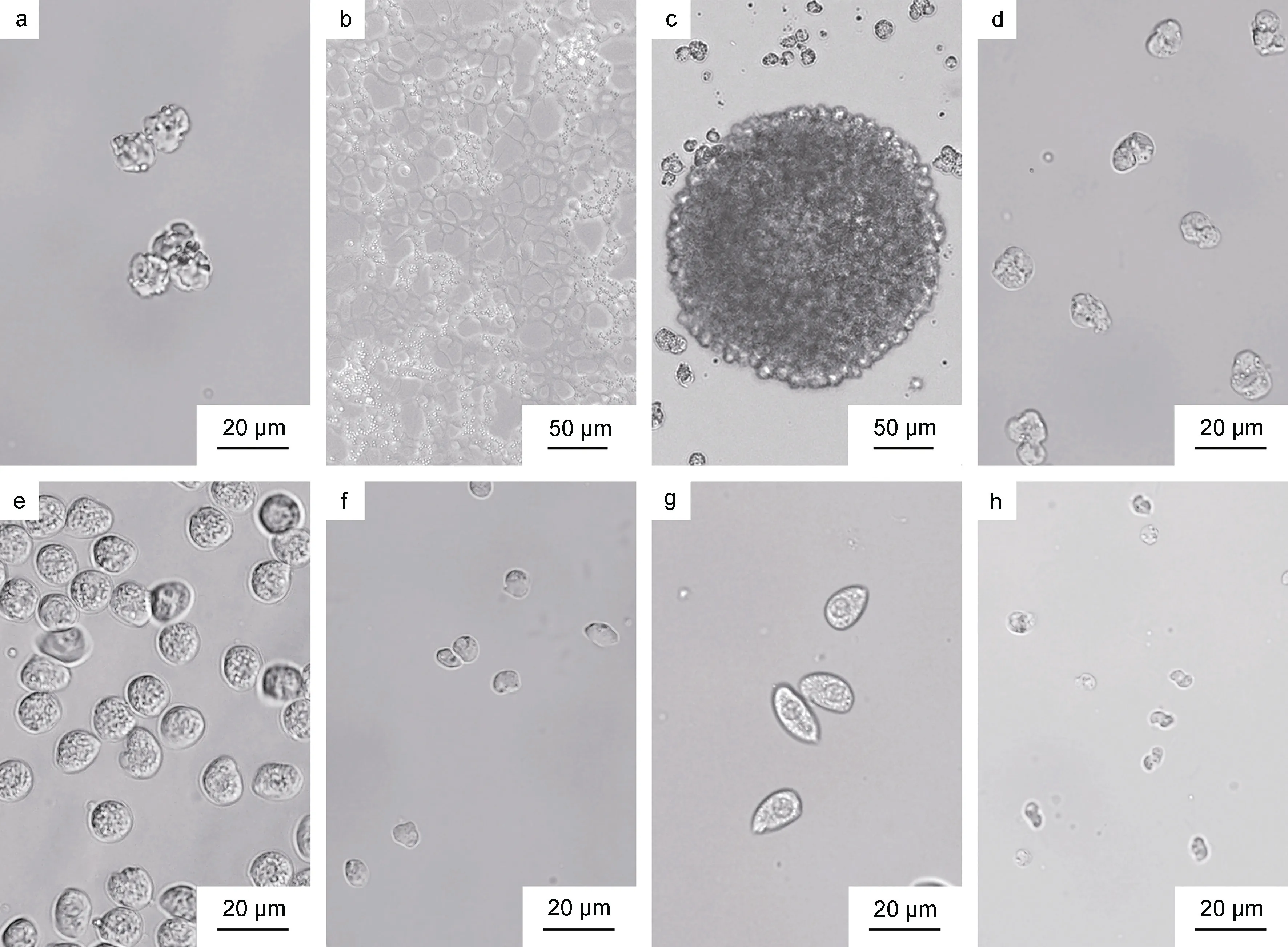
圖3 分離自天津厚蟹的血卵渦鞭蟲株系的體外培養各生活史階段Fig.3 In vitro life stages of H. perezi isolated from mudflat crabs H. tientsinensis
孢子前細胞進一步發展形成具有游動能力的孢子。在體外培養實驗中觀察到大孢子(圖3g)和小孢子(圖3h)兩種類型, 來源于單個宿主的血卵渦鞭蟲在體外培養中只能發展成為一種類型的孢子。大孢子的大小約為15~19 μm [(16.6±1.1) μm,n=25], 呈橢球形;小孢子的大小約為6~9 μm [(7.5±0.5) μm,n=25], 呈螺旋形。鞭毛發育后, 兩種類型的孢子都能夠在培養液中游動, 大孢子游動緩慢、活動范圍較小, 小孢子游動能力強、能夠在培養液中快速移動。孢子形成后一段時間后逐漸停止運動, 部分孢子的形態由橢球形或螺旋形變為球形, 之后孢子增殖發育停滯并逐漸死亡。
2.3 溫度對宿主體內血卵渦鞭蟲生活史的影響
溫度能夠影響血卵渦鞭蟲在宿主內的增殖。在注射感染后第10、第15 和第20 天(圖4)對各組注射感染天津厚蟹進行隨機抽樣鏡檢(n=5), 在10 °C 下未發現感染; 在15、20 和25 °C 下, 溫度越高, 宿主感染程度越重; 在30 °C 下未發現感染。在15、20 和25 °C下, 溫度越高, 宿主死亡越快, 20、25 °C 下注射感染天津厚蟹分別在第31 和第28 天全部死亡, 而在15 °C 下注射感染天津厚蟹在第33 天開始死亡, 至第91 天才全部死亡, 在15 °C 下注射感染天津厚蟹平均存活時間明顯長于20 以及25 °C 組(圖5)。在注射感染后第30 天分別對10 和30 °C 實驗組剩余存活及實驗期間死亡的天津厚蟹進行血涂片鏡檢和PCR 檢測,均未發現血卵渦鞭蟲感染。
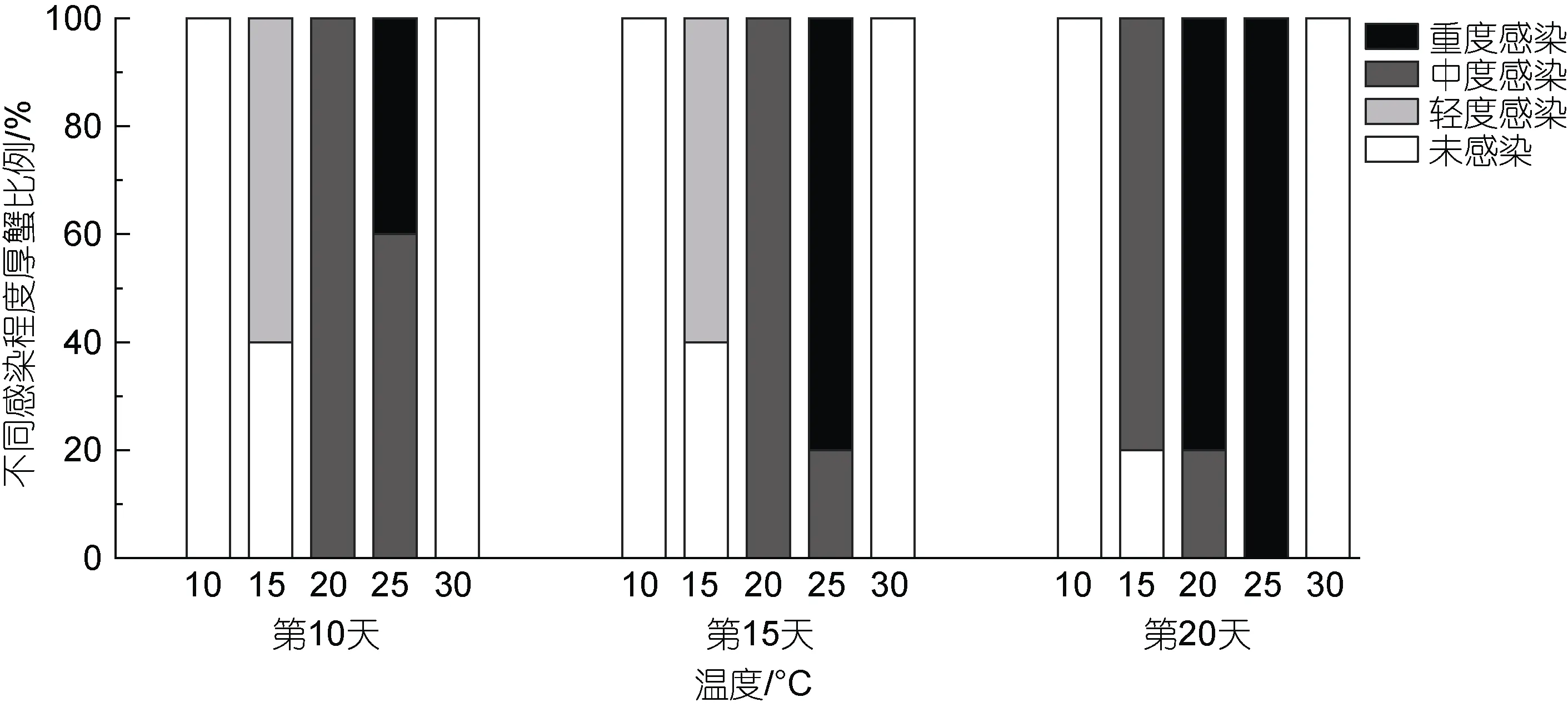
圖4 不同溫度下注射感染天津厚蟹體內的血卵渦鞭蟲感染程度變化Fig.4 Intensity of H. perezi in experimentally infected mudflat crabs H. tientsinensis at different temperatures
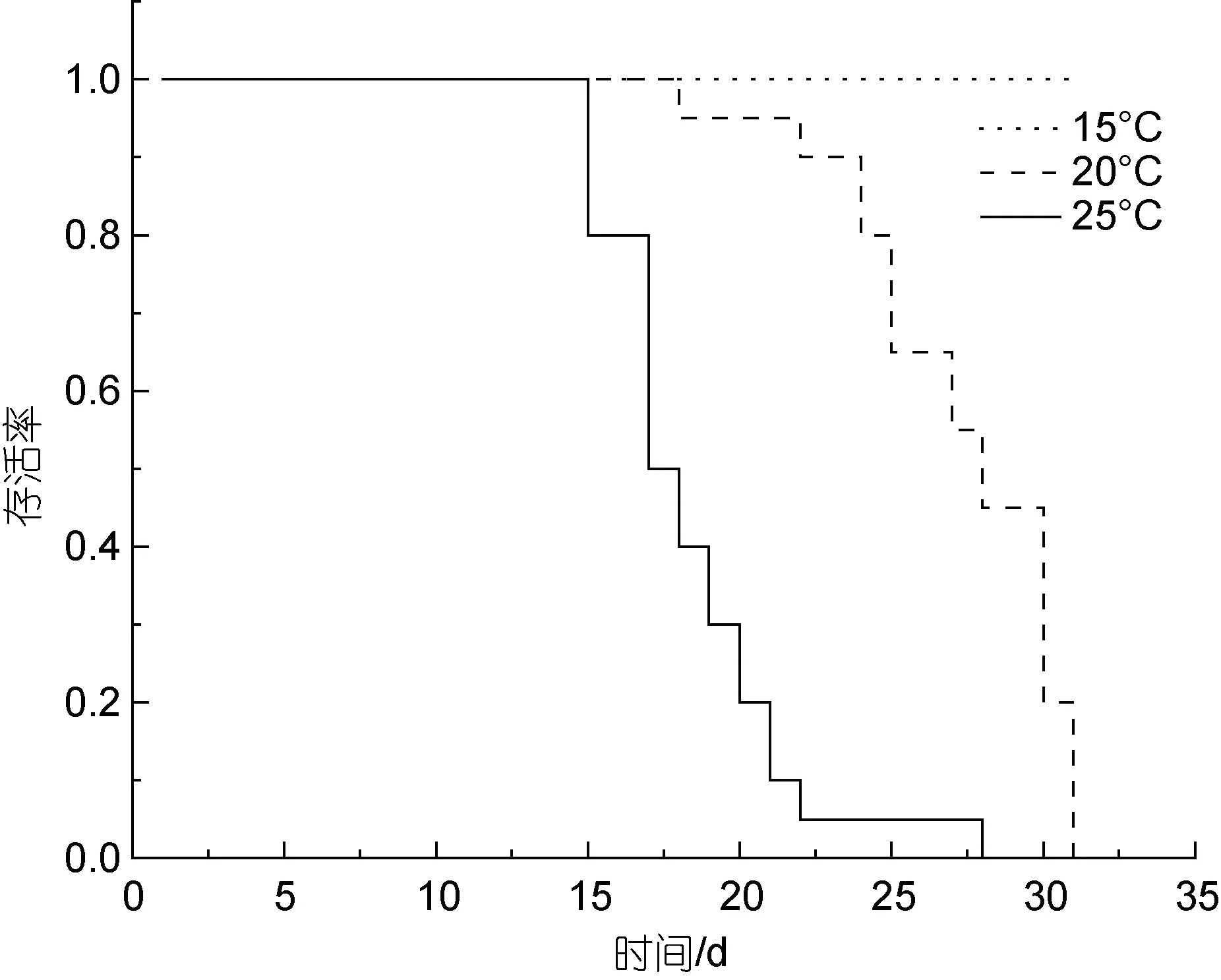
圖5 不同溫度下注射感染天津厚蟹的存活情況Fig.5 Survival curves for mudflat crabs H. tientsinensis experimentally infected with H. perezi at different temperatures
溫度也顯著影響了血卵渦鞭蟲在宿主體內的生活史發展。絲狀滋養體是宿主感染血卵渦鞭蟲早期的常見生活史階段, 類變形蟲滋養體是宿主感染血卵渦鞭蟲中、后期的常見生活史階段; 實驗第10 天,15 °C 實驗組中40%的天津厚蟹血淋巴中發現絲狀滋養體, 40%的天津厚蟹血淋巴中未發現感染, 20%的天津厚蟹血淋巴中發現類變形蟲滋養體, 20 °C 實驗組中20%的天津厚蟹血淋巴中發現絲狀滋養體, 80%的天津厚蟹血淋巴中發現類變形蟲滋養體, 而25 °C 實驗組中所有抽檢天津厚蟹均發現了類變形蟲滋養體,而未檢測出絲狀滋養體(圖6)。孢子母細胞是宿主感染血卵渦鞭蟲后期的常見生活史階段; 在15 °C 實驗組中, 在第37 天第一次在天津厚蟹血淋巴中檢測到孢子母細胞, 而在20 和25 °C 實驗組中天津厚蟹血淋巴中孢子母細胞的第一次檢出時間分別為第20 天和第15 天(圖6)。此外, 在15 °C 實驗組中, 有55%(11/20)的天津厚蟹釋放孢子到環境水體中, 完成產孢過程, 平均周期大約59.7 天(n=11); 在20 °C 實驗組中, 有30% (6/20)的天津厚蟹釋放孢子, 完成產孢過程, 平均周期大約27.2 天(n=6); 在25 °C 實驗組中,始終沒有發現注射感染的天津厚蟹釋放孢子。
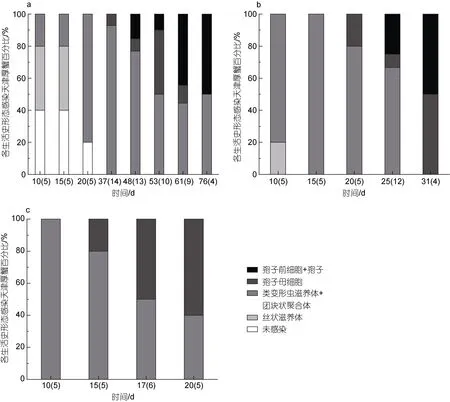
圖6 不同溫度下注射感染天津厚蟹體內血卵渦鞭蟲的主要生活史階段變化Fig.6 Life stages of H. perezi in experimentally infected mudflat crabs H. tientsinensis at 15, 20 and 25 °C
2.4 溫度對體外培養條件下血卵渦鞭蟲生活史的影響
溫度影響體外培養血卵渦鞭蟲的生活史發展。在以類變形蟲滋養體為起點的體外培養中, 在10 °C 下培養3 天后, 大量類變形蟲滋養體細胞死亡。在15、20 和25 °C 培養條件下, 類變形蟲滋養體均能發展為蛛網狀滋養體、團塊狀聚合體, 并重新分散成單獨的類變形蟲滋養體; 血卵渦鞭蟲細胞在15 °C 培養條件下生長發展明顯慢于20、25 °C 培養, 在20、25 °C培養條件下第1 天時已經開始形成蛛網狀滋養體, 而15 °C 培養到第3 天時才開始形成蛛網狀滋養體。30 °C 培養條件下, 類變形蟲滋養體細胞沒有發展變化, 在第10 天細胞死亡。
以大孢子前細胞為起點的體外培養與以類變形蟲滋養體為起點的體外培養類似, 10 °C 下培養的大量大孢子前細胞到第5 天時死亡, 30 °C 下培養的細胞到第7 天細胞開始死亡。在20、25 °C 培養條件下, 第6天發現形成大孢子, 15 °C 培養中第8 天出現大孢子。
3 討論
本研究首次建立了分離自我國野生天津厚蟹的寄生甲藻血卵渦鞭蟲株系的體外連續培養, 確定了該寄生甲藻體外培養經歷的主要生活史階段, 包括類變形蟲滋養體、蛛網狀滋養體、團塊狀聚合體、孢子母細胞、孢子前細胞、孢子等階段。本研究所觀察的血卵渦鞭蟲體外培養生活史與分離自挪威龍蝦(Appletonet al, 1998)、美國蘭蟹(Liet al, 2011)的血卵渦鞭蟲體外培養生活史基本一致, 但在體外培養過程中未觀察到絲狀滋養體、絲狀滋養體集合體、蛛網狀孢子體和裂殖體等生活史階段。本研究中孢子經過一段時間后便停止發育, 這一實驗結果與分離自蛛雪蟹(Chionoecetes opilio)的血卵渦鞭蟲體外培養觀察結果一致, 其電鏡分析結果表明體外培養的孢子已經衰老, 不具備進一步發育的能力(Gaudetet al,2015)。上述血卵渦鞭蟲株系體外培養的溫度范圍不同(Appletonet al, 1998; Liet al, 2011; Gaudetet al,2015), 且在分類和系統發育分析中屬于血卵渦鞭蟲屬的不同種, 或屬于同一種的不同基因型(Small,2012; 肖潔等, 2015; Huanget al, 2019), 可能是造成生活史差異的原因。此外, 體外培養后期蛛網狀滋養體能夠發育成團塊狀聚合體或孢子母細胞, 但是其決定機制尚有待進一步研究。
本研究通過注射感染實驗和連續取樣檢測, 研究了宿主血淋巴及主要組織器官內血卵渦鞭蟲各生活史階段的細胞形態, 刻畫了血卵渦鞭蟲在宿主體內發展和增殖的完整過程。血卵渦鞭蟲在宿主感染前期以絲狀滋養體和類變形蟲滋養體形式存在, 在感染中期增殖形成大量類變形蟲滋養體, 并在宿主主要組織器官內形成蛛網狀滋養體, 蟲體聚合形成團塊狀聚合體, 蟲體數量逐漸增多, 感染程度逐漸加重。在感染后期, 滋養體逐漸發展成孢子母細胞、孢子前細胞, 并進一步轉化出孢子, 最終大量孢子從宿主體內釋放到水體中。這一結果與感染美國蘭蟹(Liet al, 2011)和三疣梭子蟹(王金鳳等, 2015)的血卵渦鞭蟲在宿主體內的生活史一致。蛛網狀滋養體被認為是血卵渦鞭蟲在體外培養過程中無性繁殖的主要階段(Liet al, 2011), 蛛網狀滋養體后期形成的團塊狀聚合體能夠重新形成類變形蟲滋養體, 加入新的培養中能夠重新形成蛛網狀滋養體, 這一過程解釋了血卵渦鞭蟲在宿主體內的快速增殖。
由于宿主棲息溫度范圍不同, 不同株系的血卵渦鞭蟲對溫度表現出不同的適應性。在體外培養中分離自挪威龍蝦的血卵渦鞭蟲生長發育的適宜溫度范圍為8~15 °C (Appletonet al, 1998), 分離自美國蘭蟹的血卵渦鞭蟲在低于15 °C 條件下生長緩慢甚至停滯,并且在23 °C 下的生長狀況優于15 °C (Liet al, 2011),分離自蛛雪蟹的血卵渦鞭蟲在體外培養中能夠在0 °C 條件下正常生長增殖(Gaudetet al, 2015)。而在本研究中, 分離自天津厚蟹的血卵渦鞭蟲在體外培養中15~25 °C 條件下能夠正常生長, 但是在15 °C 條件下生長緩慢, 而且在10 和30 °C 下血卵渦鞭蟲不能正常生長發育。此外, 溫度也會影響血卵渦鞭蟲在宿主體內的細胞生長發育和增殖, 在15~25 °C 范圍內, 溫度越高, 其細胞生長發育及細胞增殖速度越快;在10 °C 和30 °C 條件下, 血卵渦鞭蟲不能在宿主體內正常寄生增殖。在15 °C 和20 °C 條件下, 天津厚蟹在感染第10 天和15 天時, 其感染程度無顯著性差異, 該結果反映了在以上溫度條件下, 血卵渦鞭蟲在感染早期的宿主體內處于緩慢增殖和細胞累積時期;而在第15 天和20 天時, 宿主體內的血卵渦鞭蟲增殖積累到一定數量, 增殖速度加快, 宿主感染程度產生顯著性差異, 該結果表明實驗感染第15~20 天是血卵渦鞭蟲在以上溫度條件下在宿主體內的關鍵快速增殖時期。盡管在25 °C 下血卵渦鞭蟲能夠在宿主體內迅速增殖發育, 但由于死亡過快, 實驗中沒有宿主完成孢子的形成與釋放。與此類似, Shields 等(2000)推斷急性感染的美國蘭蟹死亡迅速, 血卵渦鞭蟲生活史不能完成, 不會產生和釋放孢子。
本研究觀察到大孢子和小孢子兩種孢子類型;與以往研究結果相同, 來源于同一個宿主的血卵渦鞭蟲, 以及分離自同一個宿主的血卵渦鞭蟲建立的體外培養中只產生一種類型的孢子(Appletonet al,1998; Liet al, 2011; Gaudetet al, 2015)。此外, 來源于同一個宿主的血卵渦鞭蟲在宿主體內以及體外培養中能夠大致同步發育成孢子。但決定大、小孢子的形成機制(即產生大孢子或者小孢子)及大、小孢子的生物學功能尚不明確。通過孢子進行水體傳播被認為是血卵渦鞭蟲進行宿主間傳播擴散的有效途徑(Shields,1994; Stentifordet al, 2005), 且近年來多項研究通過哨兵實驗和宿主共居實驗驗證了水體傳播的有效性(Huchin-Mianet al, 2017; Shieldset al, 2017; Huanget al, 2021)。此外, 一些研究者認為孢子可能是在宿主蛻皮或者受到物理損傷期間侵入宿主體內(Meyerset al, 1990; Eatonet al, 1991; Stentifordet al, 2001;Shieldset al, 2007), 但Huchin-Mian 等(2017)研究認為血卵渦鞭蟲感染與宿主蛻皮無關。然而, 迄今尚沒有孢子直接通過水體浸浴成功感染蟹類宿主的相關報道, 孢子在易感宿主間傳播過程中的作用以及血卵渦鞭蟲侵入宿主的途徑等都有待展開進一步的調查研究。
4 結論
本研究系統研究了分離自我國沿海天津厚蟹的血卵渦鞭蟲株系的生活史, 詳細描述了血卵渦鞭蟲在宿主體內及體外培養體系中的各生活史階段的細胞形態; 并進一步發現溫度可顯著影響血卵渦鞭蟲的細胞生長發育及增殖過程, 在一定溫度范圍內(15~25 °C), 隨著溫度升高會促進血卵渦鞭蟲的細胞生長發育和增殖速度, 而在低溫(10 °C)和高溫(30 °C)條件下不利于血卵渦鞭蟲對宿主的寄生感染, 且發現15 和20 °C 條件下可形成、釋放游動孢子。以上研究成果進一步豐富和完善了寄生甲藻血卵渦鞭蟲的生活史研究, 并為今后有效防控血卵渦鞭蟲流行病提供重要理論依據。

