GEO芯片聯(lián)合網(wǎng)絡藥理學探究六味地黃丸治療系統(tǒng)性紅斑狼瘡作用機制及核心靶點分析
孟祥文,賈曉益,陸志遠,程芷洛,譚亞楠,張敏
1.安徽中醫(yī)藥大學藥學院,安徽 合肥 230012;2.中國科學技術大學附屬第一醫(yī)院,安徽 合肥 230001
系統(tǒng)性紅斑狼瘡(systemic lupus erythematosus,SLE)是一種免疫系統(tǒng)攻擊全身健康細胞和組織的疾病,免疫系統(tǒng)激活的特點是B細胞和T細胞反應過度,對自身抗原的免疫耐受性喪失。抗體產(chǎn)生和缺陷清除、免疫復合物循環(huán)和組織沉積、補體和細胞因子激活,都會導致從輕度疲勞和關節(jié)疼痛到危及腎臟、中樞神經(jīng)、血液、心臟、角膜等多個器官組織的多種臨床表現(xiàn)[1-2],診斷難度較大[3]。目前西醫(yī)治療主要采用非甾體抗炎藥、抗瘧藥、糖皮質(zhì)激素和免疫抑制劑,往往帶來較嚴重的不良反應[4-5]。
根據(jù)臨床表現(xiàn),SLE可歸屬中醫(yī)學“陰陽毒”“紅蝴蝶斑”“溫毒發(fā)斑”等范疇,五臟六腑均可發(fā)生病變,終末期肝腎損害尤為明顯。近年來,中醫(yī)藥在SLE治療中發(fā)揮著重要作用。目前大多認為其發(fā)病基礎是先天稟賦不足,故治療以補其不足為主。六味地黃丸由熟地黃、山藥、山萸肉、牡丹皮、茯苓、澤瀉組成,臨床用于治療多種疾病,研究表明其在抗氧化、抗衰老、增強免疫、降血壓、降血脂、降血糖等方面療效顯著[6-7]。六味地黃丸臨床用于輔助治療SLE可提高療效,降低毒性反應[8-11],但其具體作用機制尚不明確。本研究采用網(wǎng)絡藥理學和分子對接技術探究六味地黃丸治療SLE的作用機制,并對其核心靶點進行深入分析,為相關研究提供參考。
1 資料與方法
1.1 六味地黃丸活性成分及靶點篩選
通過TCMSP數(shù)據(jù)庫(https://old.tcmsp-e.com/index.php),分別以熟地黃、山茱萸、山藥、澤瀉、牡丹皮、茯苓為檢索詞,獲取六味地黃丸組方藥物活性成分,以口服利用度(OB)≥30%且類藥性(DL)≥0.18為條件進行篩選。通過SwissTargetPrediction(http://www.swisstargetprediction.ch/)、 本 草 組 鑒(HERB,http://herb.ac.cn/)數(shù)據(jù)庫預測活性成分靶點,SwissTargetPrediction數(shù)據(jù)庫選擇分數(shù)>0.1者,結果取并集,作為六味地黃丸作用靶點。
1.2 基因芯片及其差異分析
從GEO數(shù)據(jù)庫(https://www.ncbi.nlm.nih.gov/geo/)獲得基因芯片GSE49454,利用R軟件limma包進行差異分析,以校正后P<0.05且|logFC|≥0.4為條件篩選差異表達基因,利用R軟件VennDiagram包繪制六味地黃丸靶點基因與SLE差異表達基因的韋恩圖。
1.3 GO和KEGG通路富集分析
1.4 成分-靶點-通路網(wǎng)絡構建與分析
將藥物活性成分、交集靶點及相關通路導入Cytoscape3.8.2軟件,構建成分-靶點-通路可視化網(wǎng)絡。圖中節(jié)點(node)分別為成分、靶點、通路,邊(edge)表示各節(jié)點間的相互關系。利用插件CytoNCA分析該網(wǎng)絡,以獲取六味地黃丸治療SLE的核心成分。
1.5 靶點蛋白相互作用網(wǎng)絡構建
將交集靶點基因輸入STRING數(shù)據(jù)庫(https://cn.string-db.org/),物種限定為“Homo sapiens”,設置置信度>0.4,同時隱藏離散靶點,得到蛋白相互作用(PPI)網(wǎng)絡。利用Cytoscape3.8.2軟件對PPI網(wǎng)絡進行可視化,并用插件cytoHubba篩選核心靶點基因。
1.6 核心靶點基因表達量分析
利用R軟件提取數(shù)據(jù)集中SLE疾病活動度(DAI)評分數(shù)據(jù),參考SLE診療指南[12],按照SLEDAI評分將SLE分為輕度活動(SLEDAI≤6,Light active)和中重度活動(SLEDAI>6,Moderate to severe activity),提取出核心靶點基因在正常和SLE不同分期中的表達數(shù)據(jù),并繪制小提琴圖。
1.7 分子對接驗證
將藥物活性成分與核心靶點基因進行分子對接。利用ChemBio3D Ultra 14.0將所得活性成分的mol2格式文件轉(zhuǎn)化為3D結構。利用PDB數(shù)據(jù)庫(https://www.rcsb.org/)獲取核心靶點基因的PDB格式文件,利用PyMOL2.4.1軟件對蛋白質(zhì)進行去水、加氫操作,再通過AutoDock Vina 1.1.2軟件對藥物活性成分與核心靶點基因進行分子對接。
1.8 轉(zhuǎn)錄因子分析
利用TRRUST(https://www.grnpedia.org/trrust/)數(shù)據(jù)庫分析核心靶點基因調(diào)控的相關轉(zhuǎn)錄因子,通過Cytoscape3.8.2軟件構建基因-轉(zhuǎn)錄因子網(wǎng)絡。
1.9 免疫浸潤分析
利用R軟件提取數(shù)據(jù)集中免疫細胞相關數(shù)據(jù),進行核心基因與免疫細胞的相關分析。
2 結果
2.1 六味地黃丸活性成分及靶點
通過TCMSP共篩選得到六味地黃丸活性成分69個,其中熟地黃2個、山茱萸20個、山藥16個、澤瀉10個、牡丹皮11個、茯苓15個,其中谷甾醇和豆甾醇為重復成分。利用SwissTargetPrediction和HERB數(shù)據(jù)庫得到活性成分作用靶點813個。
2.2 差異基因與交集基因
利用R軟件的limma包進行數(shù)據(jù)集GSE49454的差異分析,共得到703個差異基因,其中上調(diào)基因442個、下調(diào)基因261個(見圖1A)。藥物靶點與差異基因的共同靶點基因共41個,作為六味地黃丸治療SLE的潛在作用靶點(見圖1B)。41個靶點基因中,上調(diào)靶點基因31個、下調(diào)靶點基因10個(見圖1C)。靶點基因在各樣本中的表達情況見圖1D。
其中,ΔN(k,h)為與4個空氣彈簧狀態(tài)有關的偏差載荷,可通過調(diào)節(jié)空氣彈簧高度調(diào)整閥進行調(diào)節(jié),當調(diào)整至零時即為載荷最平均分配狀態(tài)。
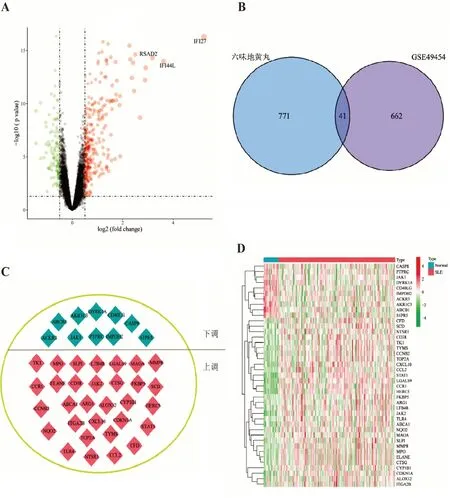
圖1 六味地黃丸治療SLE靶點基因分析
2.3 GO功能和KEGG通路
41個交集靶點基因GO和KEGG通路富集分析,以P<0.05為條件得到BP條目955個、CC條目30個和MF條目106個,各取前10個條目,見圖2A。BP主要富集在脂多糖反應、細菌來源分子反應、活性氧代謝過程、細胞因子產(chǎn)生正調(diào)控、活性氧代謝過程正調(diào)控等;CC主要富集在分泌顆粒腔、細胞質(zhì)囊泡腔、囊泡腔、質(zhì)膜外側(cè)、特定顆粒管腔;MF主要富集在細胞因子受體結合、肝素結合、腫瘤壞死因子受體結合、非跨膜蛋白酪氨酸激酶活性、糖胺聚糖結合。根據(jù)P<0.05篩選出53條KEGG通路,前10條通路見圖2B。KEGG通路主要富集在甲型流感、弓形體病、乙型肝炎、卡波氏肉瘤相關皰疹病毒感染、NOD樣受體信號通路、中性粒細胞胞外陷阱形成等。
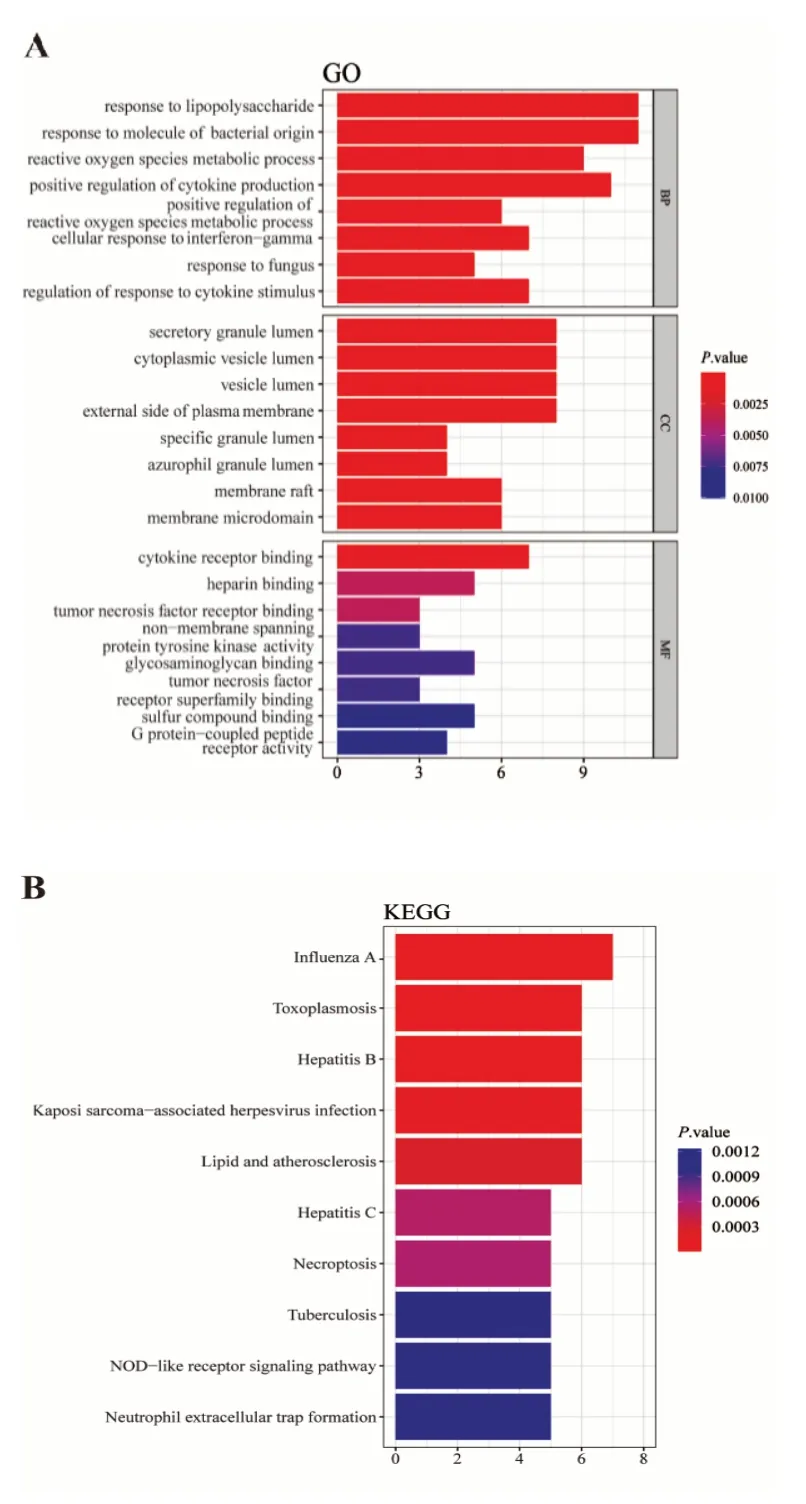
圖2 六味地黃丸治療SLE靶點基因GO和KEGG通路富集分析
2.4 成分-靶點-通路網(wǎng)絡
利用Cytoscape3.8.2軟件對六味地黃丸治療SLE的活性成分、交集靶點及相關通路構建可視化網(wǎng)絡,活性成分-靶點-通路網(wǎng)絡見圖3(圖中編號對應的活性成分見本文OSID碼)。利用CytoNCA插件對該網(wǎng)絡中的節(jié)點進行度值分析,結果度值>9的活性成分分別為槲皮素、山柰酚、海風藤酮、玉蘭脂素B和羥基芫花素,其度值分別為18、12、10、10、10。這些成分可能在六味地黃丸治療SLE中發(fā)揮重要作用,故作為核心成分。
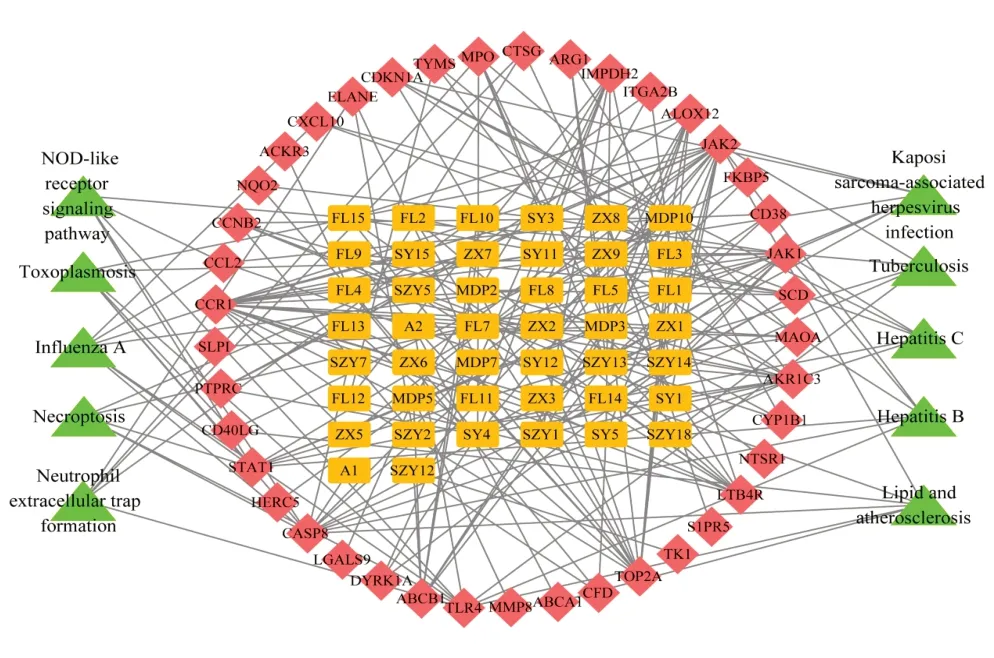
圖3 六味地黃丸治療SLE活性成分-靶點-通路網(wǎng)絡
2.5 蛋白相互作用網(wǎng)絡
將41個交集靶點導入STRING平臺,構建PPI網(wǎng)絡,見圖4。網(wǎng)絡中包含38個節(jié)點、116條邊。利用cytoHubba插件進行分析,按度值降序排列,將前5位靶點基因作為核心靶點基因,分別為TLR4、CCL2、PTPRC、CXCL10、MPO。
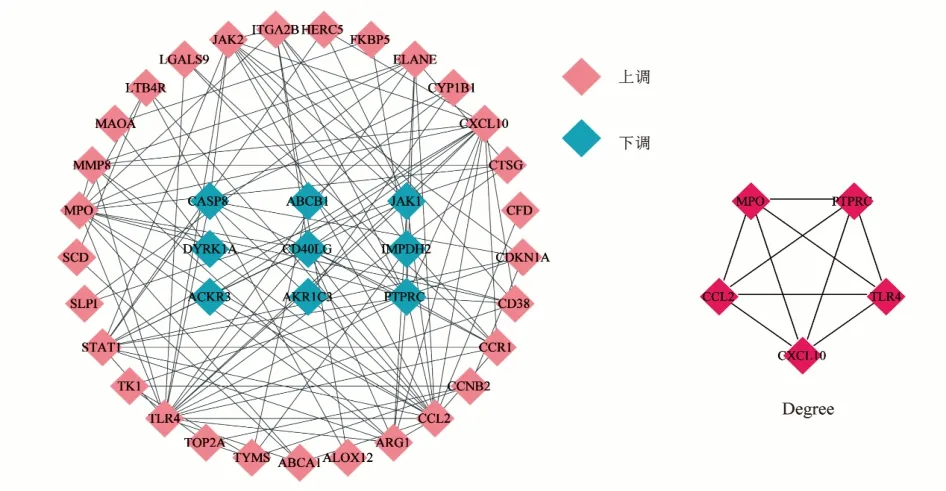
圖4 六味地黃丸治療SLE靶點PPI網(wǎng)絡及核心靶點基因
2.6 核心靶點基因表達量
提取數(shù)據(jù)集中的SLEDAI評分數(shù)據(jù),按SLEDAI評分對SLE樣本進行劃分,核心靶點基因在正常、非活動期、活動期的表達情況見圖5。正常與SLE患者比較,TLR4、CCL2、PTPRC、CXCL10和MPO表達均有顯著差異;非活動期與活動期比較,PTPRC表達存在顯著差異。
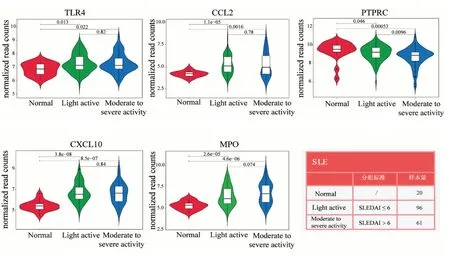
圖5 六味地黃丸治療SLE核心靶點基因在不同時期表達的小提琴圖
2.7 分子對接結果
通過分子對接分析核心靶點與核心成分的對接能力,結合能<-1.2 kcal/mol認為具有對接能力。5個核心成分(槲皮素、山柰酚、海風藤酮、玉蘭脂素B、羥基芫花素)與5個核心靶點(TLR4、CCL2、PTPRC、CXCL10、MPO)分子對接結果見表1,各成分與靶點均有較好的親和力。槲皮素與靶點對接模式見圖6。
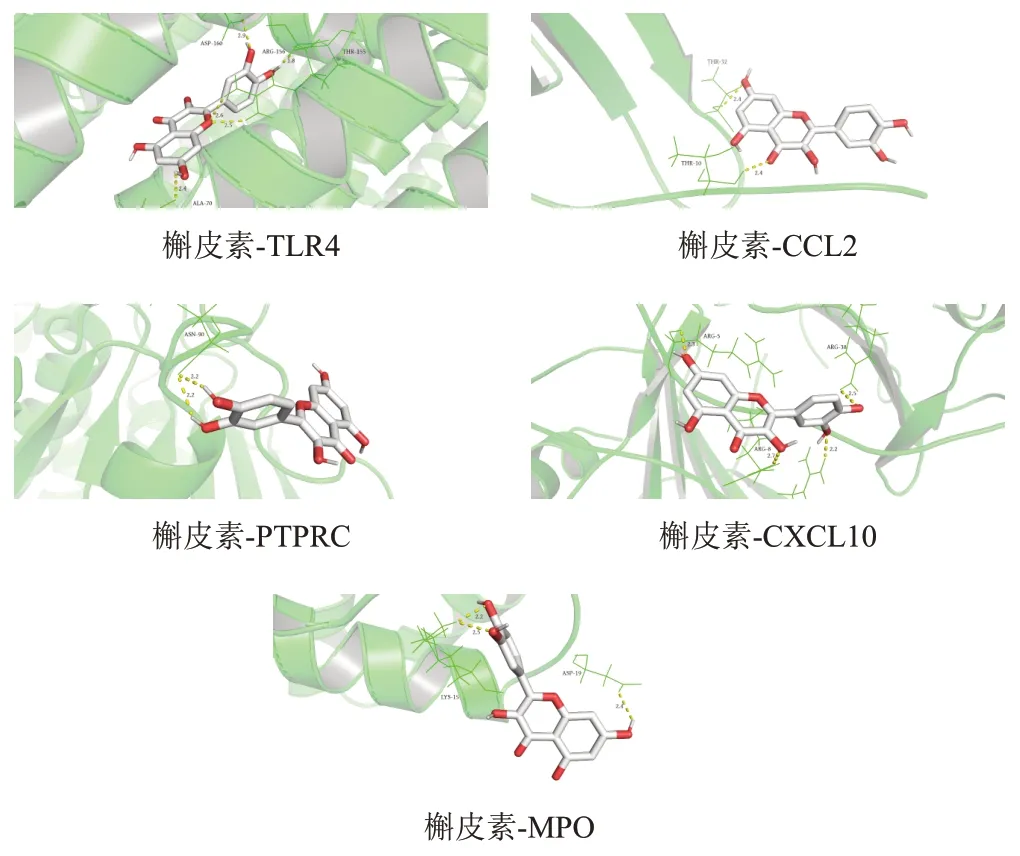
圖6 六味地黃丸治療SLE主要核心成分與核心靶點分子對接模式
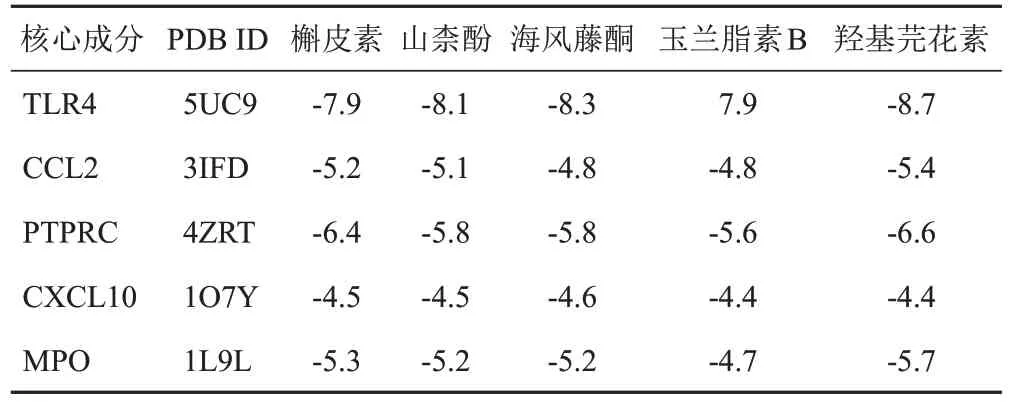
表1 六味地黃丸核心成分與核心靶點分子對接結合能(kcal/mol)
2.8 轉(zhuǎn)錄因子分析
為探究核心靶點基因的下游調(diào)節(jié)機制,對靶點基因的轉(zhuǎn)錄因子進行分析,結果有4個核心靶點基因與6個轉(zhuǎn)錄因子有相關作用(見圖7A),其中轉(zhuǎn)錄因子SPI1、STAT1和NFKB1表達量有顯著差異(見圖7B)。
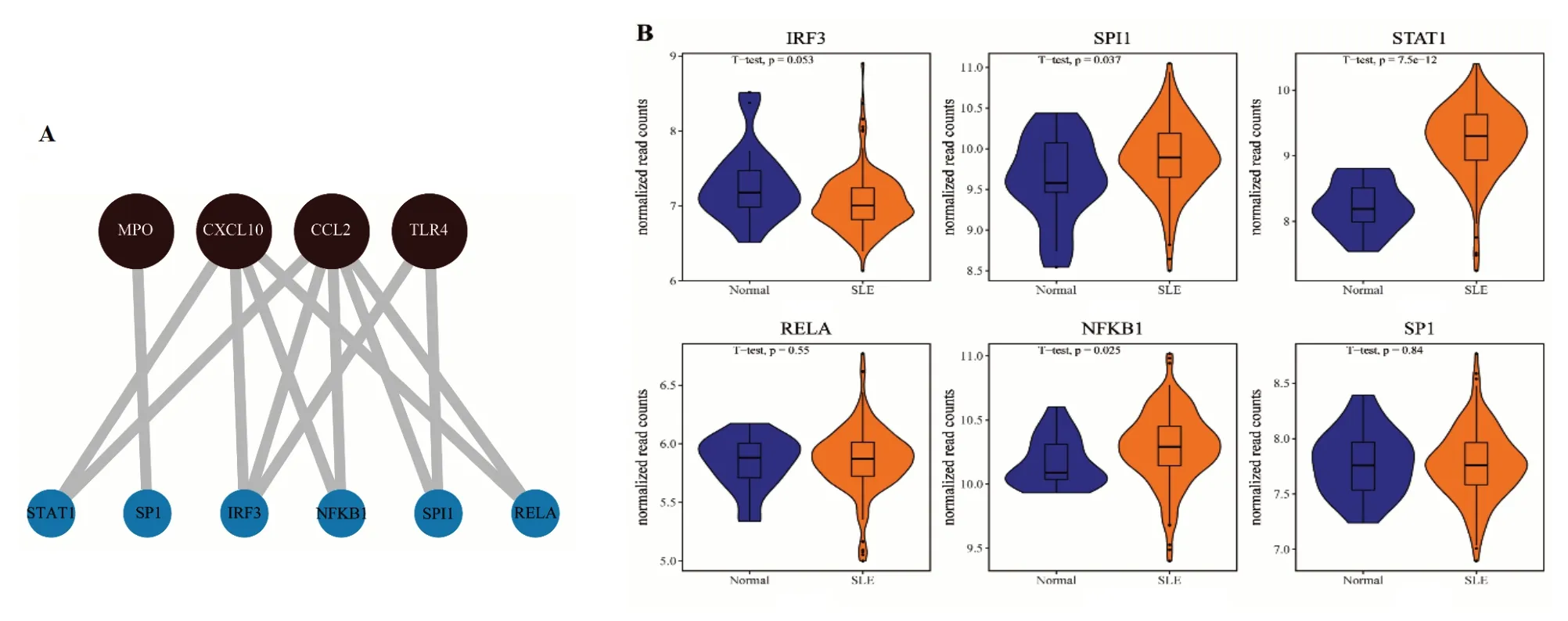
圖7 六味地黃丸治療SLE核心靶點基因-轉(zhuǎn)錄因子網(wǎng)絡與轉(zhuǎn)錄因子表達
2.9 免疫浸潤分析
提取SLE患者免疫細胞相關數(shù)據(jù),將SLE患者按核心基因分為高表達組和低表達組,分析不同組間的免疫細胞數(shù)量差異。結果顯示,TLR4表達與CD4+T細胞、中性粒細胞、CD8+T細胞、嗜酸性粒細胞和B細胞數(shù)量變化相關,CCL2表達與中性粒細胞數(shù)量變化相關,CXCL10表達與中性粒細胞、血小板和NK細胞數(shù)量變化相關,MPO表達與中性粒細胞和NK細胞數(shù)量變化相關,見圖8。
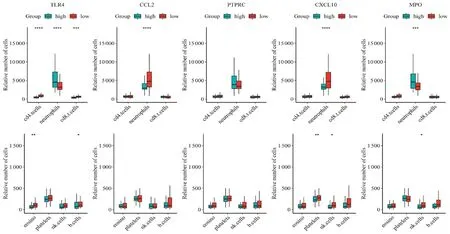
圖8 六味地黃丸治療SLE核心靶點基因免疫浸潤分析
3 討論
本研究采用生物信息學與網(wǎng)絡藥理學方法探討具有作用多靶點、多通路的復雜中藥復方六味地黃丸與SLE之間的關系。基于成分-靶點-通路網(wǎng)絡,發(fā)現(xiàn)六味地黃丸抗SLE的主要活性成分為槲皮素和山柰酚。槲皮素是有效的抗氧化劑和抗炎分子[13],可有效保護SLE小鼠腎臟功能,改善其免疫功能,其可能機制是下調(diào)轉(zhuǎn)化生長因子-β1、單核細胞趨化蛋白-1表達[14]。Li等[15]研究表明,槲皮素可以防止SLE模型小鼠狼瘡腎炎的發(fā)生,并降低免疫細胞活化。山柰酚對炎性疾病如SLE和類風濕關節(jié)炎均有明確的治療效果[16]。這表明六味地黃丸治療SLE的過程中發(fā)揮重要作用的可能是其中的黃酮類化合物。
KEGG通路富集分析結果發(fā)現(xiàn),NOD樣受體信號通路與核心靶點密切相關。NOD樣受體即NLRs家族,有研究發(fā)現(xiàn),SLE患者PBMC中NLRP3/NLRP1炎性小體的表達顯著下調(diào)[17]。油橄欖苦苷及其酰基衍生物可通過NLRP3途徑改善SLE小鼠腹腔巨噬細胞的炎癥反應[18]。褪黑激素通過抑制NLRP3炎癥信號通路的激活,可恢復氧化應激和炎癥的形態(tài)學和衰減,從而減弱由前列腺素誘導的狼瘡腎炎[19]。Yu等[20]發(fā)現(xiàn)細菌暴露增加了單核細胞中NOD2表達,從而導致外周血單個核細胞產(chǎn)生促炎細胞因子,加重SLE病情。
通過構建PPI網(wǎng)絡,運用cytoHubba插件篩選出六味地黃丸治療SLE的核心靶點基因TLR4、CCL2、CXCL10、MPO和PTPRC,這些靶點基因與SLE關系密切。MicroRNA16可與DEC2直接結合,抑制TLR4信號通路,抑制狼瘡性腎炎腎組織增生和系膜細胞增殖。CCL2是治療SLE的重要靶點[21]。維生素D可通過降低CXCL10在SLE中的表達,改善內(nèi)皮功能障礙,恢復髓系血管生成細胞功能[22]。泛素化MPO對SLE患者CD4+T淋巴細胞再激活有不同程度的誘導作用[23]。有研究表明,SLE患者中PTPRC含量明顯低于健康對照[24]。本研究通過對核心靶點基因的免疫分析發(fā)現(xiàn),這些基因與諸多免疫細胞相關聯(lián)。TLR4在先天免疫中起著基本作用并介導產(chǎn)生有效免疫所必需的細胞因子。CCL2和CCL7的抗體中和可顯著降低脂多糖誘導的總白細胞和中性粒細胞積累[25]。EZH2通過抑制CXCL10表達抑制NK細胞介導的抗腫瘤免疫[26]。MPO與中性粒細胞關系密切。PTPRC編碼的PTP蛋白是T細胞和B細胞抗原受體信號轉(zhuǎn)導的重要調(diào)節(jié)因子。提示上述核心靶點基因與免疫系統(tǒng)密切相關。核心靶點基因和轉(zhuǎn)錄因子關聯(lián)分析中SPI1、STAT1和NFKB1表達差異有統(tǒng)計學意義,表明六味地黃丸可能通過作用于核心靶點引起下游轉(zhuǎn)錄因子的變化,進而調(diào)控免疫細胞的功能,發(fā)揮治療SLE的作用。
綜上,本研究表明六味地黃丸通過多成分、多靶點、多通路治療SLE,可為相關研究提供思路與理論基礎,后續(xù)仍需進一步進行實驗驗證。

