大麥種質資源抗葉斑病評價
孫逸凡,黃志磊,李葆春,姚立蓉,汪軍成,司二靜,楊軻,孟亞雄,馬小樂,王化俊*
(1.甘肅農(nóng)業(yè)大學省部共建干旱生境作物學國家重點實驗室,甘肅省作物遺傳改良與種質創(chuàng)新重點實驗室,蘭州 730070;2.甘肅農(nóng)業(yè)大學農(nóng)學院,蘭州 730070;3.甘肅農(nóng)業(yè)大學生命科學技術學院,蘭州 730070)
大麥是一種重要的糧食作物,廣泛用于釀酒工業(yè)和飼料生產(chǎn)之中。在大麥生長發(fā)育過程中,常受各種病菌侵害,從而造成產(chǎn)量損失或品質降低,影響農(nóng)民收入[1-2]。大麥葉斑病是由禾旋孢腔菌(有性世代Cochilobolus sativus,無性世代Bipolaris sorokiniana)引起的葉部病害,在全世界90多個國家和地區(qū)都曾經(jīng)有流行或暴發(fā),如加拿大、美國、南非等[3]。大麥葉斑病在中國江蘇、內(nèi)蒙古等大麥主產(chǎn)區(qū)發(fā)病嚴重,發(fā)病田塊減產(chǎn)幅度一般為15%~30%[4]。2012—2013年間,內(nèi)蒙古呼倫貝爾市爆發(fā)葉斑病,導致大麥大幅減產(chǎn),葉斑病已成為制約該地區(qū)大麥生產(chǎn)的主要病害之一[5]。該病是土傳和種傳病害,致病孢子以厚垣孢子的形式寄存于土壤和大麥、小麥的殘株中,其生存年限可達8~10年,新生孢子會存留在受侵染的植株殘片上。植株被病原菌侵染后,發(fā)生根冠褐變、葉片莖稈萎蔫、壞死、黑胚等癥狀,目前該病害尚無有效防治方法[6-7],培育抗病品種是有效的途徑之一。種質資源是大麥新品種選育的物質基礎,核心種質代表了大多數(shù)種質的變異。因此,對大麥核心種質進行葉斑病抗性鑒定可以為選育抗性品種奠定基礎,也可為挖掘抗性基因及探究作物、菌株互作機制提供參考。
國內(nèi)外在大麥抗葉斑病鑒定及抗病遺傳資源利用等方面研究較深入并取得重要進展。Gyawali等[8]利用來自于摩洛哥的19種葉斑病菌對336個基因型的大麥苗期和成熟期進行了抗性鑒定,并檢測出了只在苗期出現(xiàn)的9個QTL位點。Zhan等[9]通過QTL分析發(fā)現(xiàn),大麥抗葉斑病基因分布不均,多集中在1H、3H、6H、7H染色體短臂和3H染色體長臂上。Bovill等[10]對4個抗葉斑病大麥品種成熟期和苗期的抗性位點進行了比對,發(fā)現(xiàn)同一品種在幼苗期和成熟期抗性位點差異明顯,不同品種的抗性基因位點也并不一致。呂二鎖等[11]對96份大麥材料進行了抗性鑒定,姚全杰等[12]對國內(nèi)223份大麥材料的抗性鑒定,闡釋了品種Azare是大麥葉斑病抗性重要種質資源。目前國內(nèi)對于大麥葉斑病的研究仍然主要集中在病害防治和菌株毒性的鑒別方面,而關于大麥葉斑病抗病性遺傳及抗性基因發(fā)掘的研究鮮有報道。
本研究運用SNP標記技術對200份大麥種質進行遺傳多樣性分析,并通過分子標記與抗大麥葉斑病的全基因組關聯(lián)分析(genome-wide association study,GWAS),以期為大麥抗葉斑病基因挖掘和抗病品種選育提供理論依據(jù)。
1 材料與方法
1.1 供試材料
根據(jù)本課題組前期研究基礎[12],選取具有代表性的200份不同來源的大麥品種(系)材料,由甘肅農(nóng)業(yè)大學省部共建干旱生境作物學重點實驗室麥類種質創(chuàng)新課題組提供。
1.2 SNP分子標記檢測
基于Illumina SNP Genotyping技術測試平臺,采用微陣列芯片(BeadArrey)技術對Illumina 9K SNP標記(包含9 000個標記)檢測,由北京博奧晶典生物技術有限公司完成。試驗步驟如下:用NaOH對基因組DNA分子進行變性;將基因組DNA在28℃恒溫靜置12 h,全部進行PCR擴增;利用隨機內(nèi)切酶切斷擴增DNA分子,使其片段化;采用異丙醇使DNA片段沉淀,再次懸浮;芯片的微珠與50 mer長度的捕獲探針相結合,而gDNA酶切后的片段不與探針DNA互補序列相連,靜置12 h左右;芯片清洗,清除雜交失敗或雜交錯誤的DNA片段;單個堿基變化以及染色,染色后,A和T、C和G將分開標記不同的熒光染料類型;芯片掃描,利用軟件基于2種不同的熒光識別分析數(shù)據(jù)并計算出其分型結果。通過軟件Ntsys-pc 2.02計算大麥參試材料間的遺傳學相似系數(shù)。
1.3 大麥葉斑病抗性鑒定
大麥葉斑菌選用Z14484強侵染力菌株(采自甘南)。試驗于2017年9月—2018年11月在甘肅農(nóng)業(yè)大學人工氣候室內(nèi)進行,將土、沙、蛭石按體積比3∶1∶1混合均勻,經(jīng)高壓滅菌(121℃、30 min)后裝填于直徑為18 cm的花盆中。在無菌條件下用70%乙醇處理大麥種子30 s,5%次氯酸鈉處理5 min,然后用無菌水沖洗3次,再用無菌濾紙將種子表面水分吸干,晾干后在培養(yǎng)皿中發(fā)芽,待發(fā)芽后移栽到花盆中。每份材料設置3個重復,每個重復種10株幼苗,在22℃的溫室中培養(yǎng)。待幼苗長到三葉期時,用蒸餾水清洗葉片表面的蠟質層,最后將配置好的孢子懸浮液(0.25%Tween,99.45μL水,1×104cell·mL-1孢子含量)噴灑到葉片上,每天噴灑2次,接種3 d,在接種期間溫室處于黑暗狀態(tài),接種溫度22℃,濕度100%。接種9 d后調(diào)查各供試品種的發(fā)病病級[13],并計算病情指數(shù)(disease index,DI),病害和抗病等級劃分如表1和表2所示。

表1 病害等級劃分[13]Table 1 Level division of disease[13]

表2 抗病類型劃分Table 2 Classificatrion of resistant types

式中,DI為病情指數(shù);si為發(fā)病級數(shù);ni為相應病級級別的株數(shù);i為病情分級的各個級別,N為調(diào)查總株數(shù)。
1.4 數(shù)據(jù)處理
本研究通過Excel和SPSS 19.0進行數(shù)據(jù)統(tǒng)計和分析,運用Powermarker計算堿基對比例、基因多樣性和多態(tài)性信息量(polymorphism information content,PIC)。利用軟件Structure 2.3.1進 行群體遺傳結構分析,預估最佳群體數(shù)K值。1~10為K值取值范圍,將參數(shù)iterations調(diào)整為10 000,burnin period調(diào)整為100 000,每個K值疊加 運行10次,根據(jù)最大似然值原則確定最標準的K值為群體數(shù)目,計算Q值用作協(xié)變量,并選用PLINK1.09軟件進行全基因組關聯(lián)分析(GWAS),設 置maf≤0.05,顯 著 性 水 平 閾 值P<10-4,使 用R3.5.2制作曼哈頓圖。
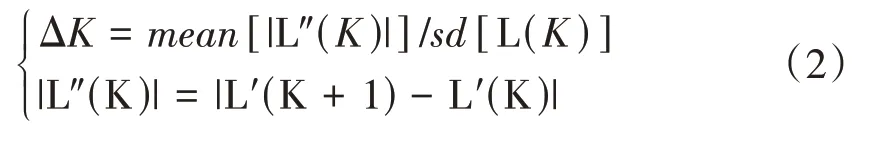
式中,K為亞群數(shù);L(K)為K的最大似然數(shù),|L″(K)|為連續(xù)值之間差值的絕對值。
2 結果與分析
2.1大麥葉斑病的抗性鑒定
對200份大麥種質材料人工接種大麥葉斑病病原菌Z14484,接種9 d后進行抗性評價,結果(圖1和表3)表明:參試材料的抗病性差異較大,病情指數(shù)分布在5.45%~95.16%之間。其中,蒙啤麥3號等17份材料屬于抗性,占所有參試材料的8.5%;ZYM00695等34份材料屬于抗-中抗,占所有參試材料的17%;中抗品種和中抗-中感材料各有40和43份,分別占20%和21.5%;中感材料37份,占18.5%;中感-高感材料28份,占14%;高感材料僅有1份(蒙啤麥1號),本研究中未篩選出免疫和高抗材料。
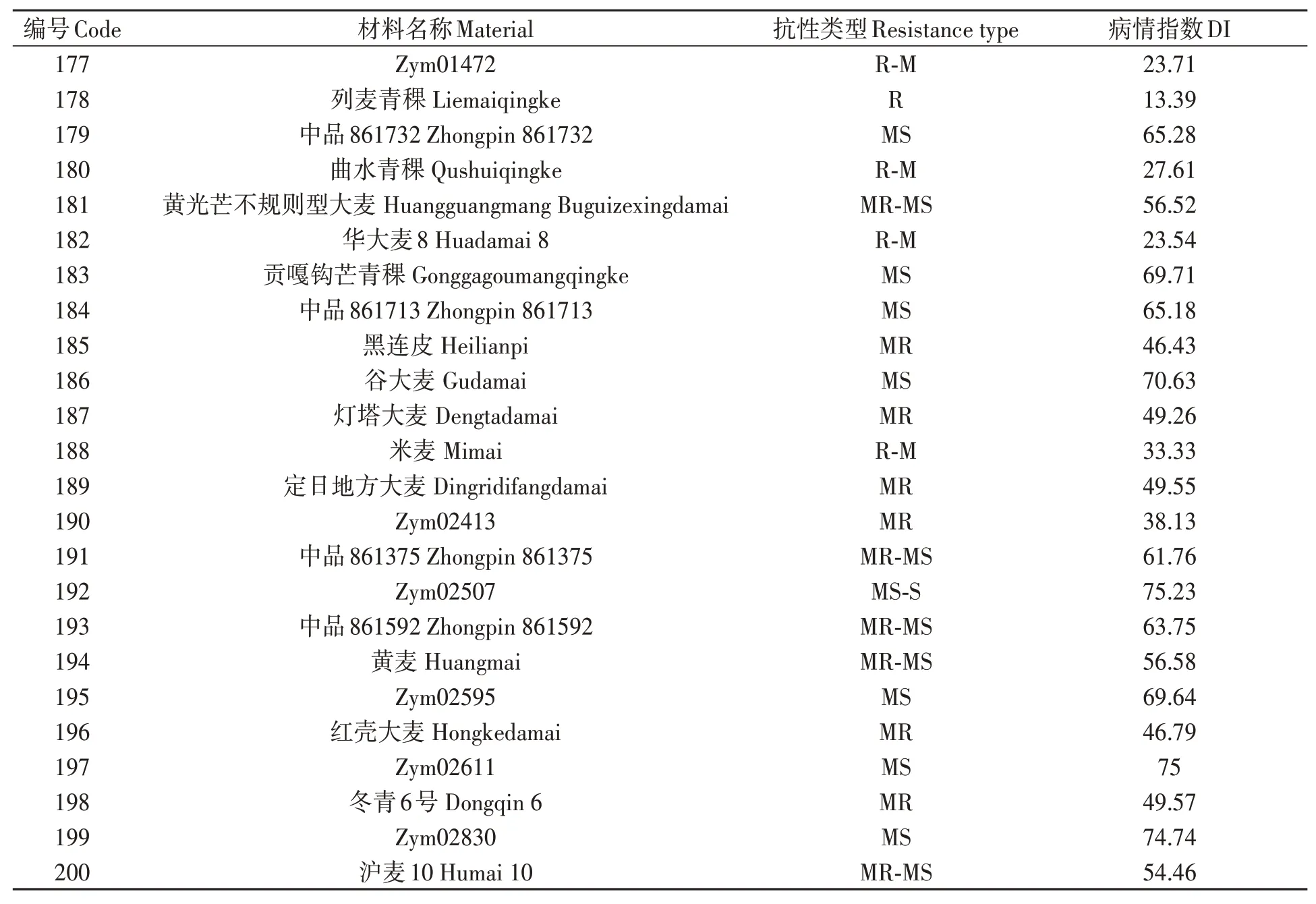
表3 大麥葉斑病抗性Table 3 Resistance to Bipolaris teres spot blotch of barley varieties 續(xù)表Continued
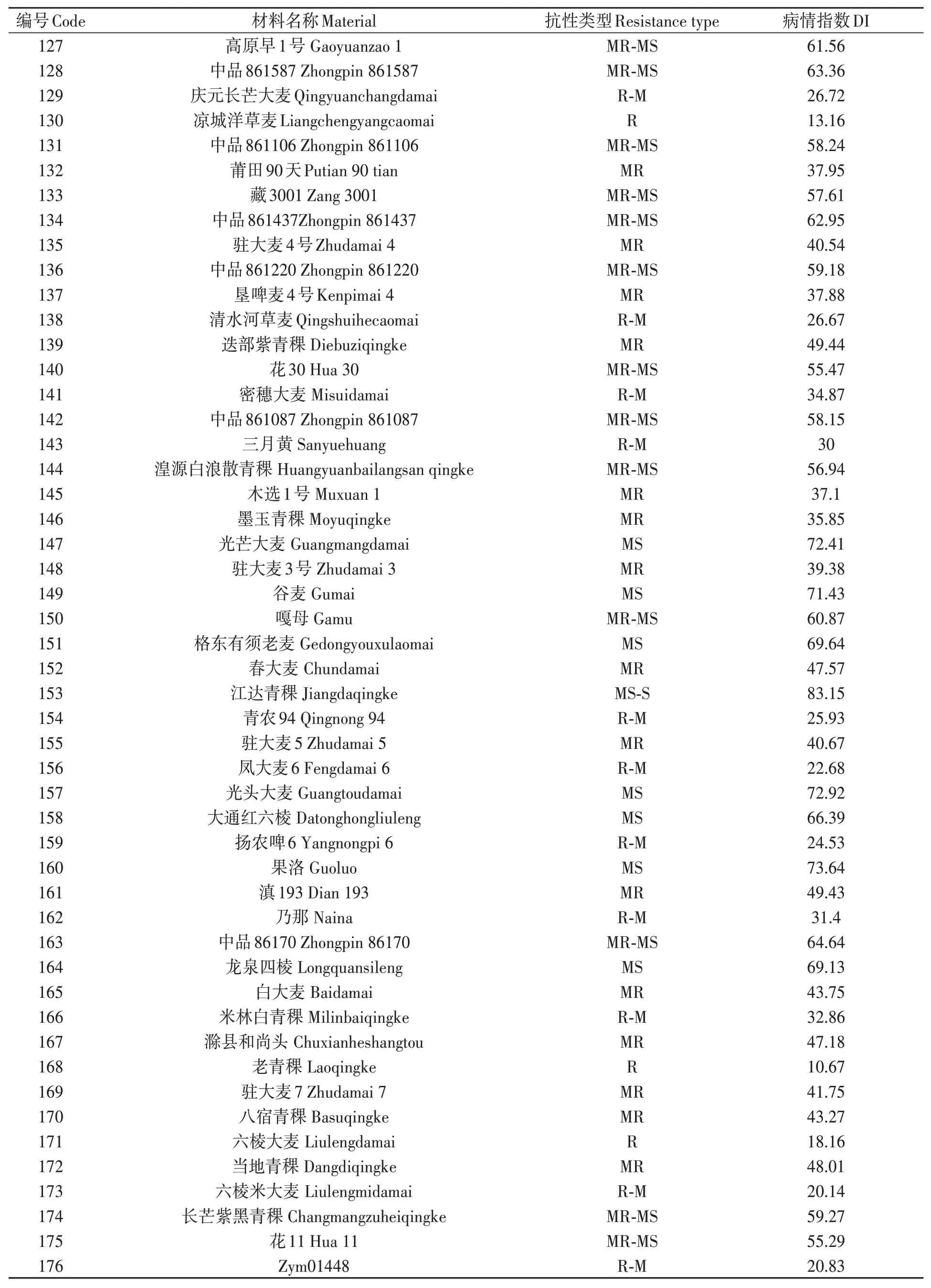
表3 大麥葉斑病抗性Table 3 Resistance to Bipolaris teres spot blotch of barley varieties 續(xù)表Continued
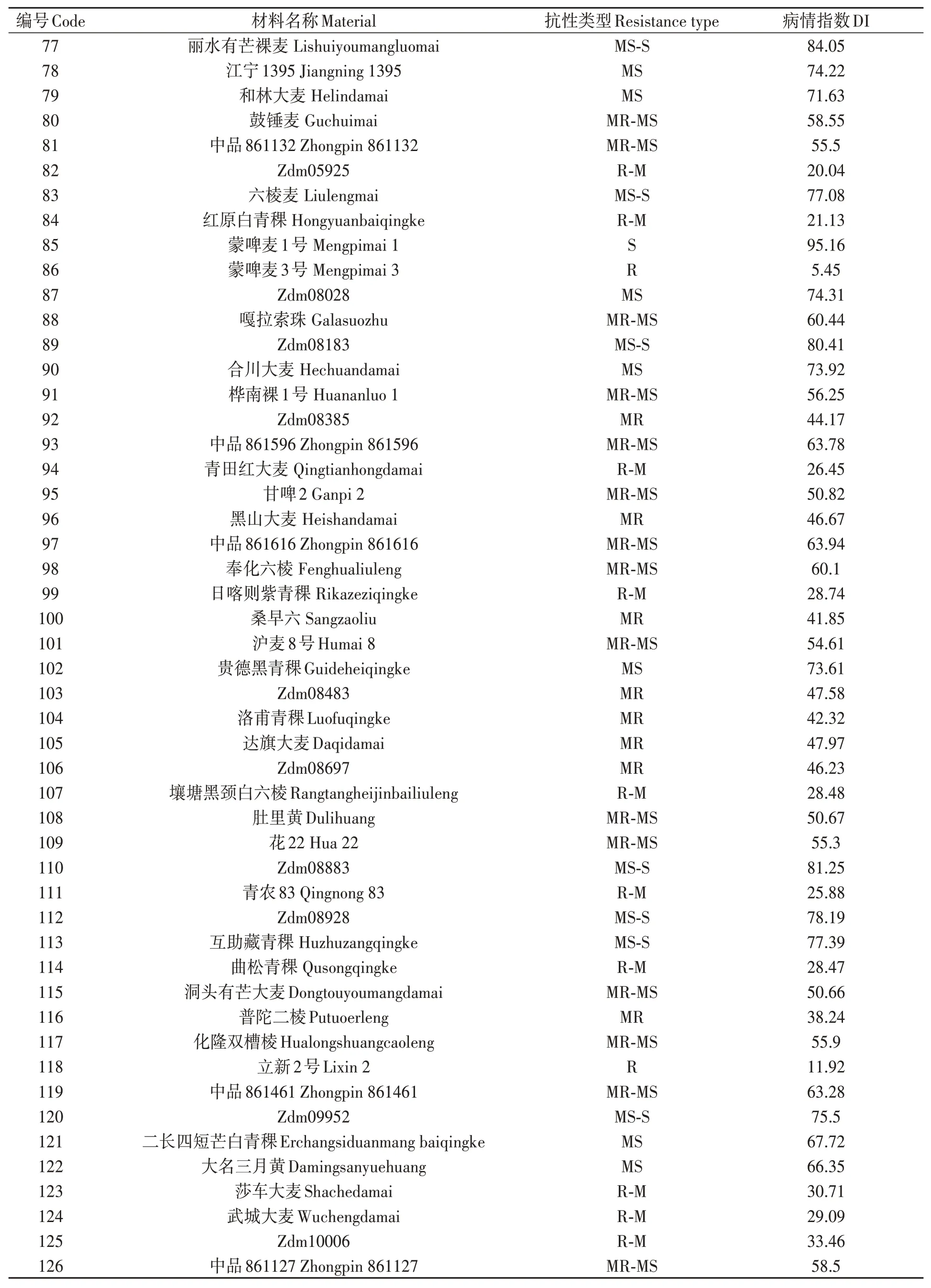
表3 大麥葉斑病抗性Table 3 Resistance to Bipolaris teres spot blotch of barley varieties 續(xù)表Continued
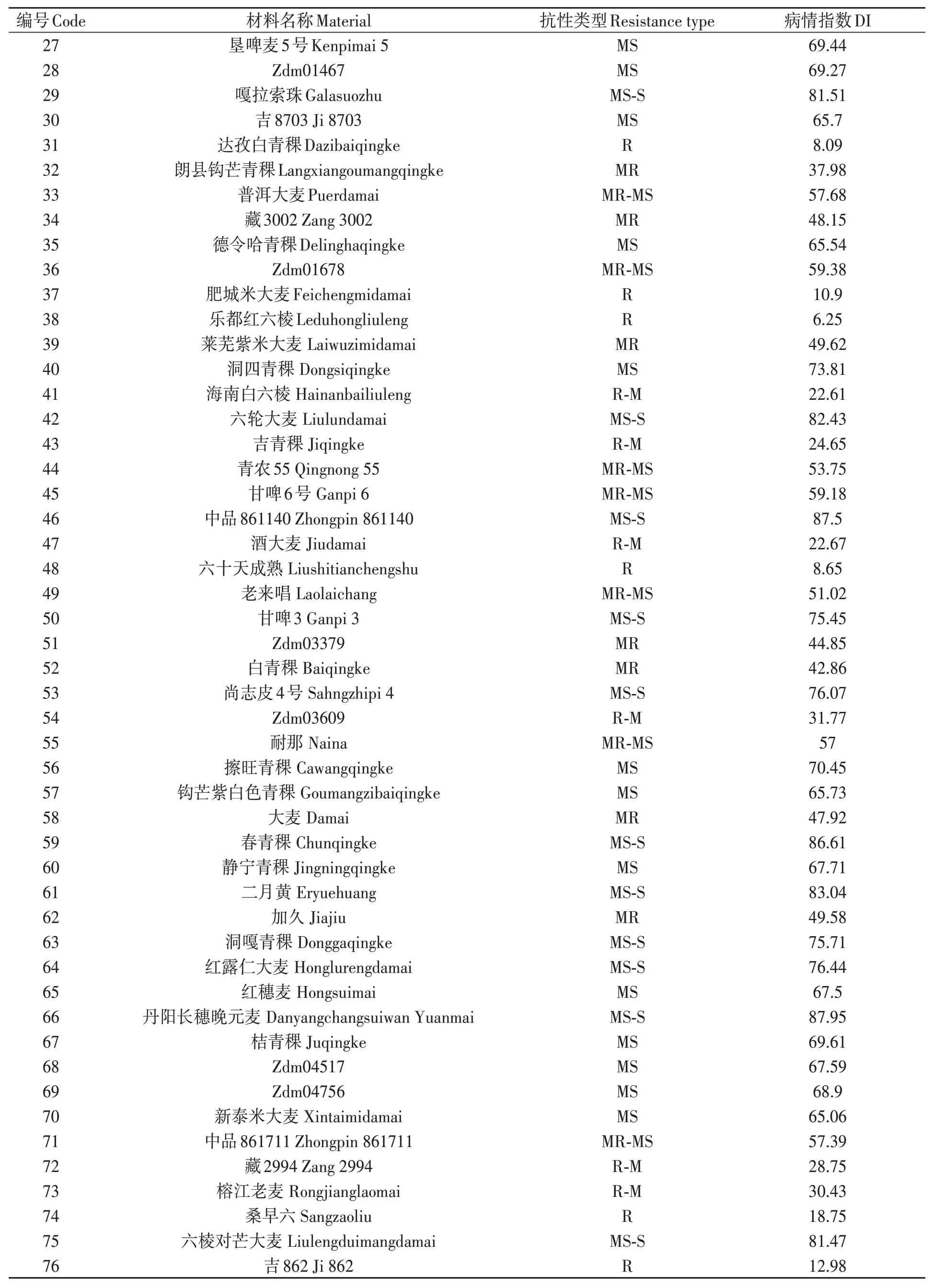
表3 大麥葉斑病抗性Table 3 Resistance to Bipolaris teres spot blotch of barley varieties 續(xù)表Continued
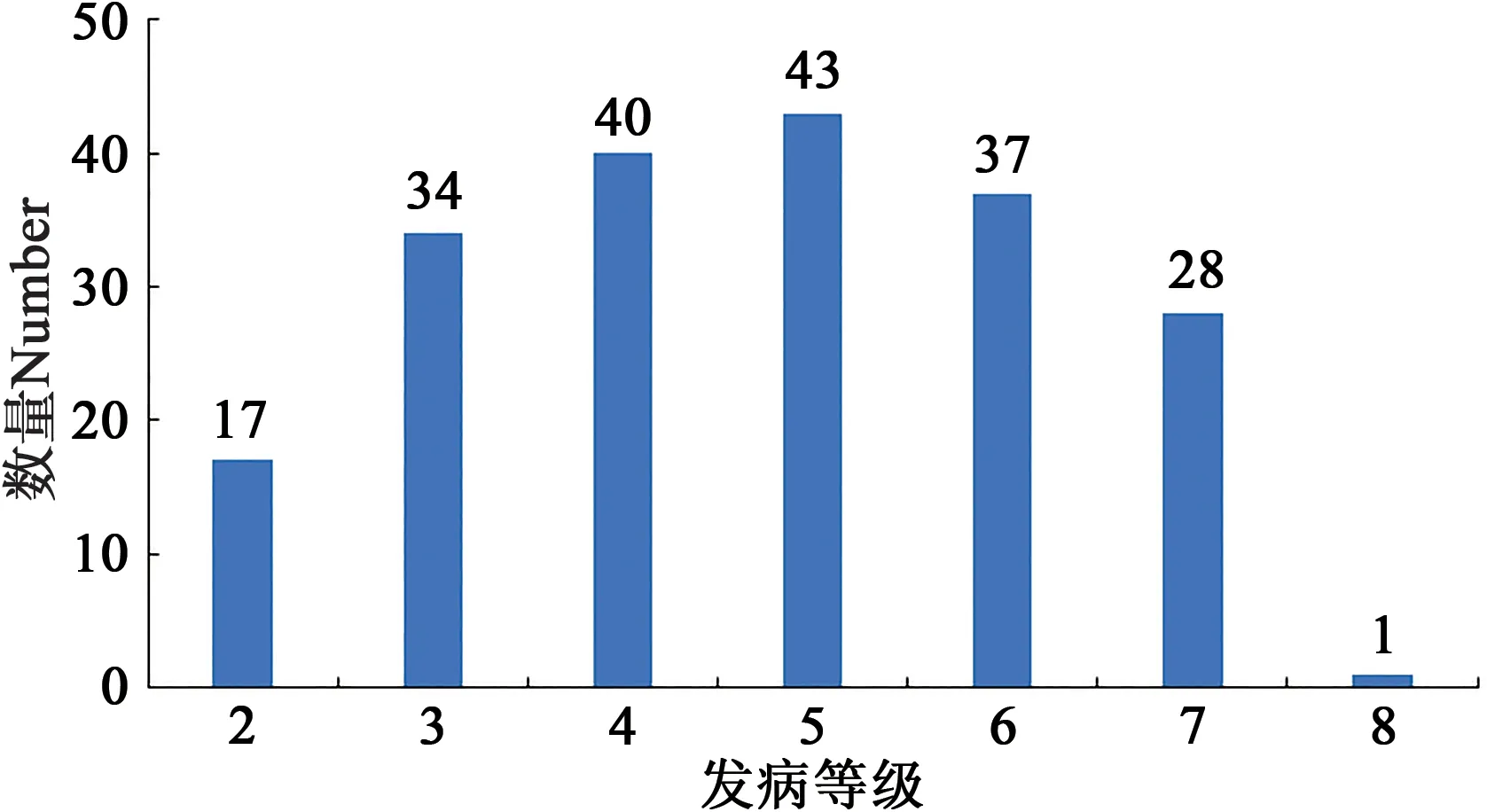
圖1 群體發(fā)病級別評價Fig.1 Evaluation of incidence level of strains
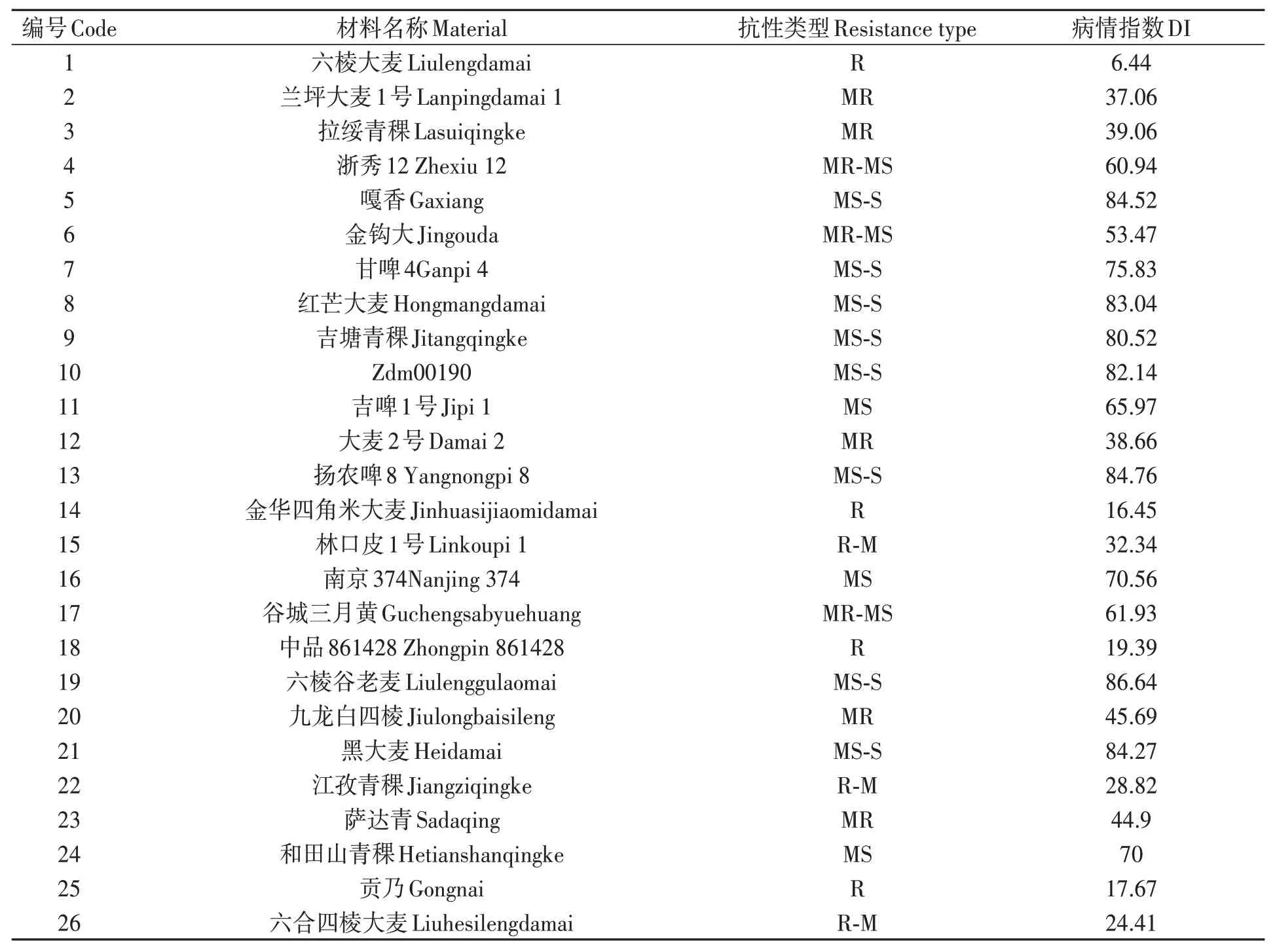
表3 大麥葉斑病抗性Table 3 Resistance to Bipolaris teres spot blotch of barley varieties
2.2 大麥SNP基因型分析
本研究使用基于Illumina SNP Genotyping技術的9K基因芯片,篩選出6 454個具有特異性的SNP標記,分布在7條染色體上,平均每條染色體922個。其中,4H染色體最多,達1 288個;1H染色體最少,為642個。位點之間的距離平均為158 kb,1 H上的SNP標記最密,平均距離為207 kb;2H上的SNP標記最稀少,平均距離為131 kb。6 454個SNP標記包括8種類型的堿基替換,其中A/G類型有2 386個,在所有堿基替換類型中最多;T/A類型的最少,有104個(表4)。
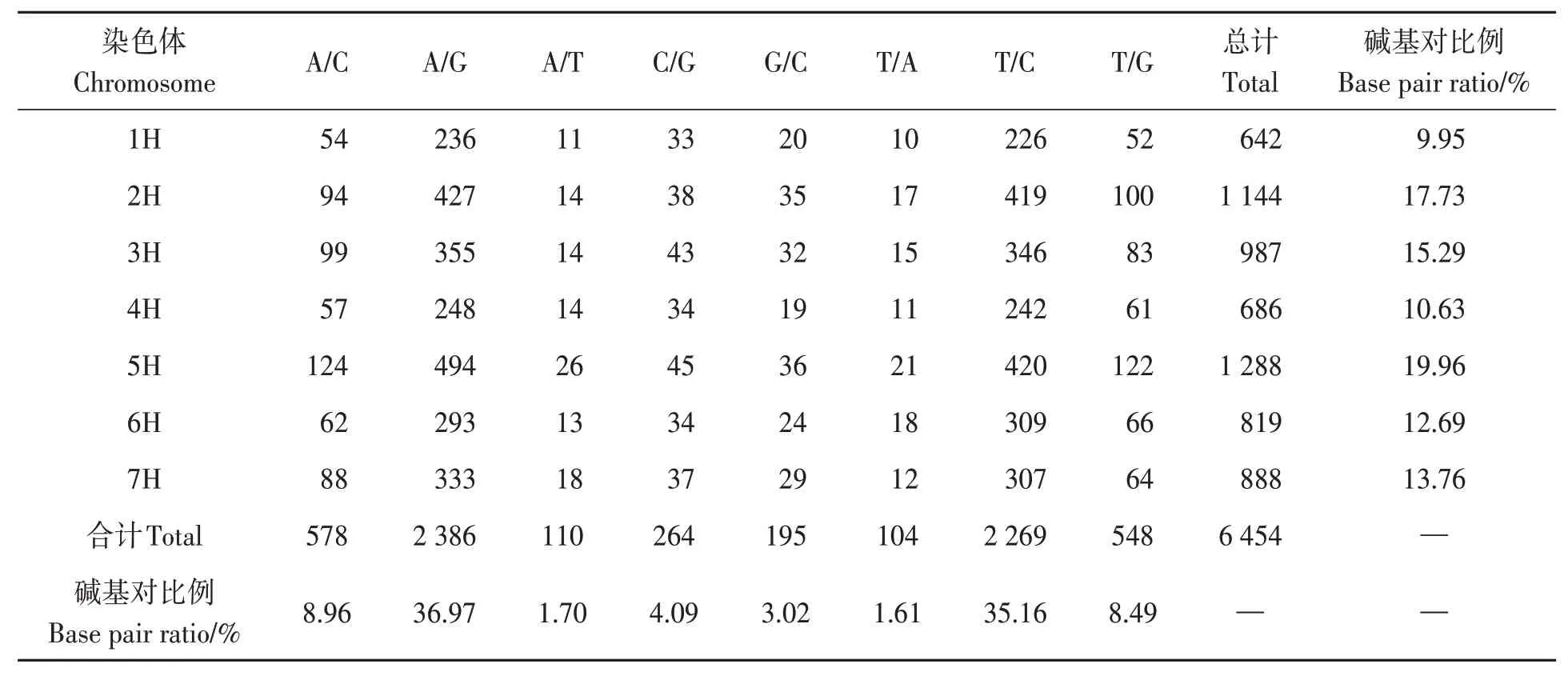
表4 堿基變異比較Table 4 Comparison of base variation
2.3 群體遺傳結構分析
通過SNP位點,利用Structure 2.3.1分析200份大麥材料的群體遺傳結構,結果(圖2和3)表明:不同亞群內(nèi)大麥參試種質的相似程度最為接近,當K=3時ΔK最大,因此可以判定200份大麥被分為3個亞群,分別有100、67和33份材料。其中第I亞群主要為青海、甘肅、新疆、西藏和四川部分材料,如青海共和的海南白六棱,西藏昌都等八宿青稞、吉塘青稞,四川壤塘的壤塘黑頸白六棱等;第Ⅱ亞群主要為江蘇、浙江、福建等地材料;第Ⅲ亞群主要來自于四川、山西、上海等地,如四川和林大麥等。
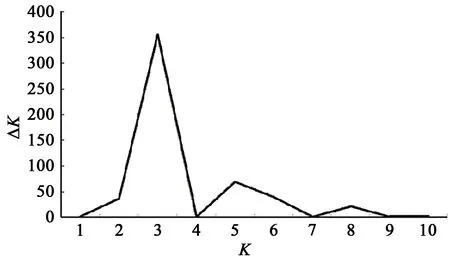
圖2 ΔK值隨K值的變化Fig.2 Change ofΔK value with K value
2.4 大麥抗葉斑病全基因組關聯(lián)分析
結合SNP位點分析與抗性評價結果對全基因組進行關聯(lián)分析,以每個信號區(qū)域內(nèi)-logP值最高的SNP物理位置代表位點區(qū)段。檢測到的GWAS信號位點如圖4所示,共檢測到12個位點,分別位于3號和6號染色體上。
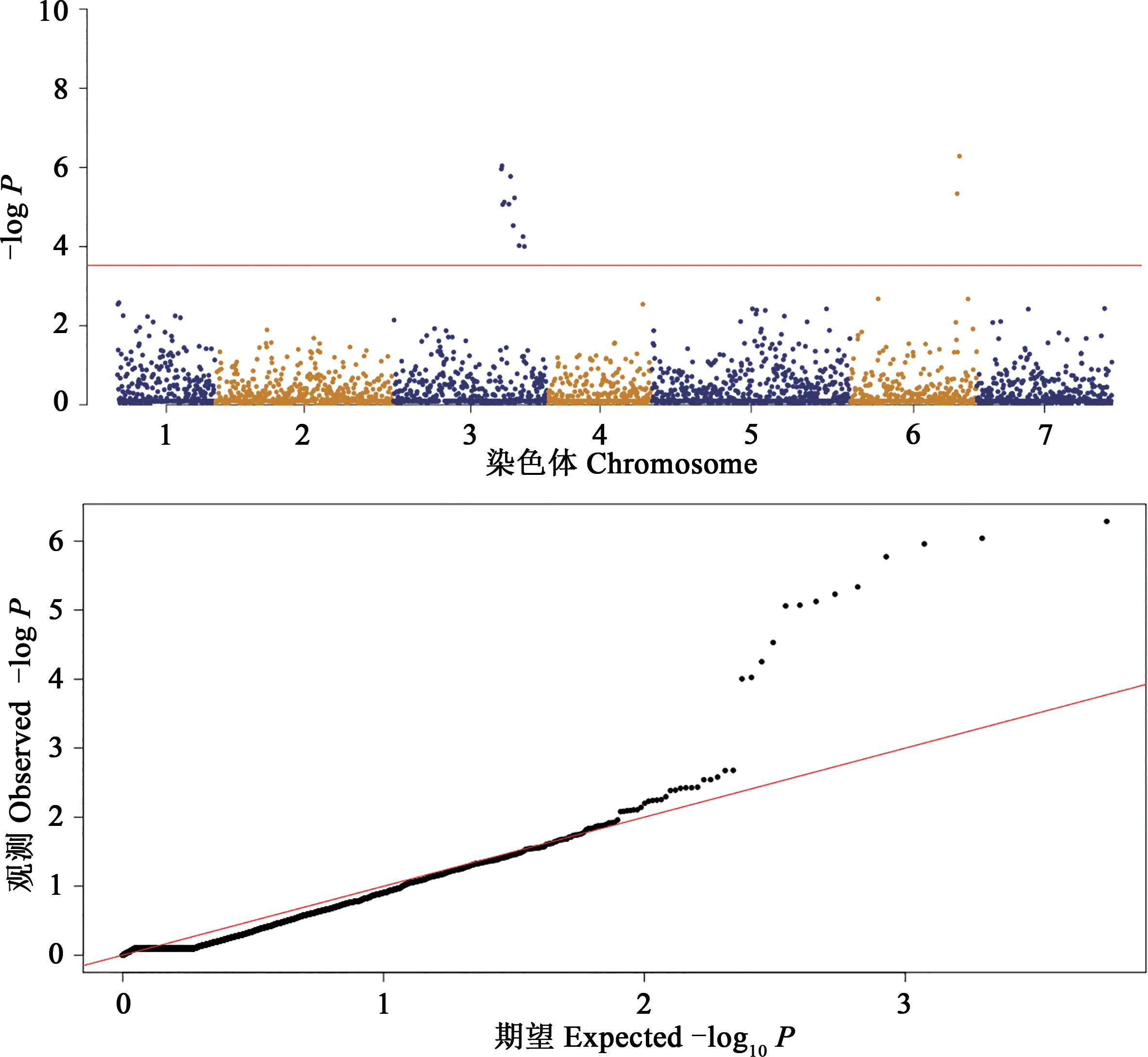
圖4 大麥材料抗葉斑病曼哈頓圖與Q-Q圖Fig.4 Manhattan and Q-Q map of core germplasm resistance to spot blotch
2.5 大麥抗葉斑病全基因組關聯(lián)位點候選基因分析
在全基因組上有12個與大麥葉斑病抗性關聯(lián)的SNP位點,分別位于3H和6H染色體上,其中4個顯著關聯(lián)(表5)。在NCBI(https://www.ncbi.nlm.nih.gov/)上 對 這4個SNP位 點 進 行 查詢,位點SCRI_RS_168529為核小體組裝蛋白1∶2基 因(nucleosome assembly protein 1∶2,HORVU1Hr1G-021800.1);位點BOABC_7462109為FYVE鋅指修飾的RCCI基因(RCC1 with FYVE zinc finger,HORVU3Hr1G107820.4);位點SCRI_RS_168096為鐵-3超氧化歧化酶基因(Fe superoxide dismutase 3,HORVU6Hr3G020590.16);位點SCRI_RS_171415為麥類高爾基蛋白基因5(A.tauschiigolgin candidate 5,LOC109755746)。同時,位于3H上的BOPA1_11_11436和SCRI_RS_201075的POS值(與本染色體初始位點相對距離)分別為145.69和145.65,距離為42 323 kb。
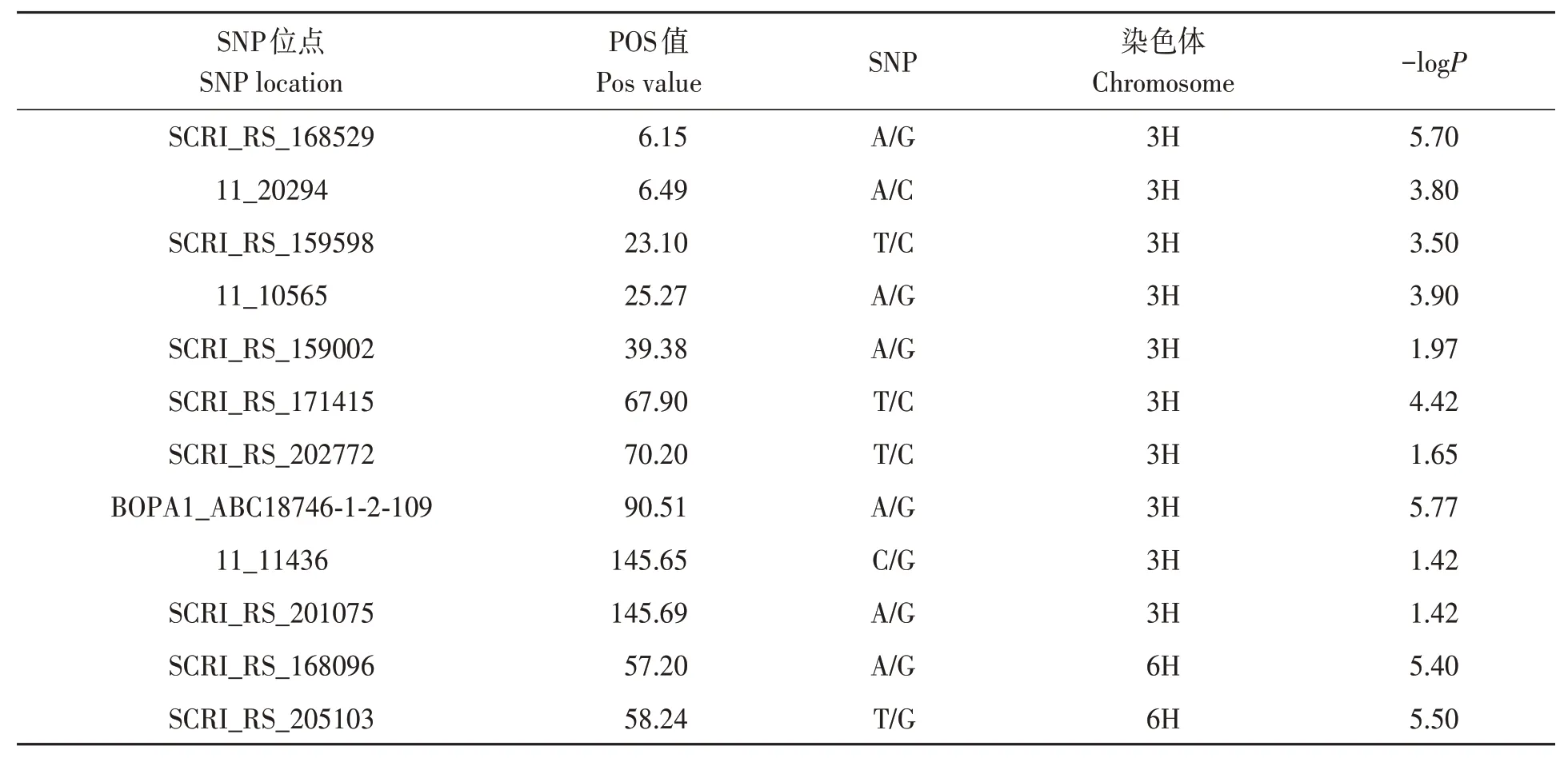
表5 GWAS檢測到的信號位點與SNP標記信息Table 5 Information of signal sites and corresponding SNP markers by GWAS
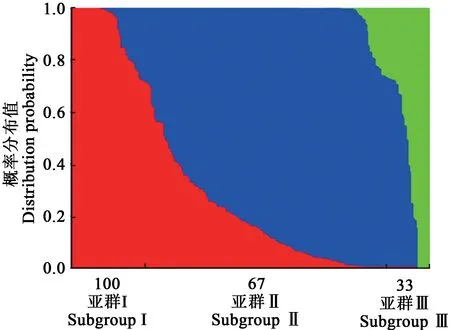
圖3 200份大麥種質材料的群體遺傳結構Fig.3 Population structure of 200 barley accessions
3 討論
大麥葉斑病抗性材料的篩選方法主要包括田間病圃自然感病和室內(nèi)人工接種鑒定。在自然環(huán)境中,由于控制發(fā)病所需條件較為困難,而室內(nèi)人工接種在控制發(fā)病溫度、濕度等條件下,能夠顯著提高接種的成功率和試驗的可靠度。Gyawali等[8]通過使用來自于摩洛哥的19種葉斑病原體對336個基因型的大麥在苗期和成熟期進行了抗性鑒定,發(fā)現(xiàn)抗病材料僅有43份;Singh等[14]對來自于印度奧瓦拉納西的124個大麥品種進行為期3年的抗性評估,并對發(fā)現(xiàn)的高抗品種BCU422、BCU1204和BCU5092進行了相關性分析;Ghazvini等[15]使用了112個不同的大麥株系對127種病原菌進行抗性鑒定,發(fā)現(xiàn)致病性類型多達10余種,并且不同種質對于不同菌株抗性并不相同;姚全杰等[16]通過多種葉斑病菌株對不同生長時期大麥材料進行抗性鑒定,發(fā)現(xiàn)233種大麥材料中只有10份材料在不同時期對不同菌株均表現(xiàn)出抗性;呂二鎖等[17]通過2次鑒定,僅發(fā)現(xiàn)15種抗性材料。
本研究中不同大麥品種對大麥葉斑病抗性有明顯差異,參試材料的病情指數(shù)在5.45~95.16之間。蒙啤麥1號病情指數(shù)為95.16,對Z14484表現(xiàn)高感;蒙啤麥3號病情指數(shù)為5.45,對菌株Z14484表現(xiàn)為抗性,這與郭煥強等[18]和姚全杰等[16]的研究結果基本一致。但是墾啤麥4號對于Z14484的病情指數(shù)達37.88,與姚全杰等[16]發(fā)現(xiàn)的墾啤麥4號抗性結果中感-高感存在較為明顯差異,說明大麥對于葉斑病抗性是相對的,相同大麥材料受接種菌株侵染力和毒性強弱等條件的影響,致使大麥對于葉斑病抗性也不相同。在自然環(huán)境下大麥葉斑病致病菌株類型較多,不同菌株對于大麥葉斑病致病特性又有所區(qū)別,故在選育大麥葉斑病抗性品種時,為篩選出綜合抗性較強的品種,應使用多個菌株進行篩選。
全基因組關聯(lián)分析(GWAS)是對基因組中數(shù)量巨大的SNP作為遺傳標記進行分型,結合表型之間的聯(lián)系進行全基因組水平的關聯(lián)分析,通過比較SNP與性狀之間的關系,可以快速篩選出具有抗性基因的區(qū)域甚至位點。目前全基因組關聯(lián)分析廣泛應用到各種植物的基因挖掘之中[19-20]。魏爽等[21]在黃瓜耐熱性的研究中進行了GWAS分析,檢測到6個SNP位點,并篩選出相應的候選基因;任義英等[22]在甘藍型油菜籽粒著生密度等性狀的研究中進行了GWAS分析,檢測到10個相關SNP位點并作出分析;王育才等[12]結合SNP位點對384種大麥材料和株高、穗長進行了分析[12,21-22]。本研究對于大麥葉斑病抗性基因進行了挖掘,發(fā)現(xiàn)了12個位點,其中位于3號染色體上的11_11436和SCRI_RS_201075較為接近,是較為可靠區(qū)域,另外對于SCRI_RS_201075附近的200 kb區(qū)段候選基因進行了分析,發(fā)現(xiàn)其中4個基因參與了大麥葉斑病抗性過程,有2個基因與大麥葉斑病抗性直接相關,即過氧化物酶-1(peroxidase-1)和鐵-2超氧化歧化酶(Fe superoxide-2)基因。大麥葉斑病抗性是較為復雜的數(shù)量性狀,其中牽涉到2個物種之間的互作關系,相較前人的研究結果[23-24],本研究在全基因組范圍內(nèi)檢測到12個苗期抗葉斑病相關的SNP位點,且位于3H染色體的位點較為可信,可在今后的工作中結合QTL定位結果,繼續(xù)挖掘候選基因。與此同時,本研究的試驗結果也證明了GWAS是挖掘病害關聯(lián)基因位點的有效手段,后續(xù)工作也應該繼續(xù)就挖掘出來的位點進行更深入的研究。
本研究使用大麥葉斑病病原菌Z14484,對來源不同的200份大麥種質材料進行鑒定,結果供試材料抗性差異較大,病情指數(shù)分布在5.45%~95.16%之間。通過對供試材料進行GWAS分析,發(fā)現(xiàn)12個標記與大麥抗葉斑病相關聯(lián),并且篩選出4個可能存在相關性的基因。本研究為大麥葉斑病抗病育種提供了一定的理論依據(jù)。

