應用生物信息學分析結(jié)核分枝桿菌表位串聯(lián)蛋白W541的結(jié)構(gòu)和功能
李鵬川 梁艷 張林西 吳雪瓊
迄今為止,卡介苗是世界上唯一獲得許可的結(jié)核病疫苗,但它對結(jié)核分枝桿菌潛伏感染(latent tuberculosis infection,LTBI)人群不能產(chǎn)生有效的預防和保護作用[1]。因此,研究針對LTBI人群的疫苗對于結(jié)核病的控制十分重要。目前國內(nèi)外新型結(jié)核病疫苗的種類主要有滅活疫苗、活疫苗和亞單位疫苗。亞單位疫苗只用結(jié)核分枝桿菌(Mycombacteriumtuberculosis, MTB)的一部分成份引起機體產(chǎn)生免疫保護反應,主要包括DNA疫苗、重組蛋白疫苗或多肽疫苗(加佐劑)、多肽以外的其他純化的主要成份(如枝菌酸、糖脂,等),可作為卡介苗的加強疫苗。
W541是由MTB增殖期抗原Ag85A和Ag85B及潛伏相關抗原Rv3407和Rv1733c四種抗原串聯(lián)起來的新型多抗原表位融合DNA疫苗編碼的蛋白。Ag85復合物是MTB和卡介苗的主要分泌性蛋白,在H37Rv標準株中占分泌蛋白總量的30%,是一組重要的分枝桿菌分泌蛋白。Ag85復合物是由Ag85A、Ag85B和Ag85C 3個蛋白組成。有研究表明,Ag85A和Ag85B可誘導較強的輔助性T淋巴細胞1型(Th1型)免疫反應,誘導γ干擾素(IFN-γ)、白細胞介素2(IL-2)和腫瘤壞死因子α(TNF-α)升高,而Ag85C卻無此效應。有研究發(fā)現(xiàn),Rv3407是存在于H37Rv菌株全細胞裂解液中的1個LTBI激活相關的蛋白;對Rv3407蛋白抗原表位進行預測,發(fā)現(xiàn)它是1個T細胞和B細胞抗原表位都較豐富的蛋白抗原[2];Rv3407 DNA疫苗可明顯誘導小鼠體液和Th1型細胞免疫應答,對小鼠結(jié)核模型具有明顯的免疫治療作用[3]。Rv1733c是MTB在休眠期表達量比較高的一種保守的跨膜蛋白。Black等[4]在南非、岡比亞和烏干達等3個結(jié)核病高負擔國家中研究了7個經(jīng)典的MTB重組蛋白抗原和51個休眠調(diào)節(jié)子編碼的MTB重組蛋白抗原刺激人機體產(chǎn)生的免疫應答情況,發(fā)現(xiàn)Rv1733c抗原是被識別頻率最高的一個潛伏相關蛋白抗原,并且應用酶聯(lián)免疫吸附試驗檢測全血中分泌的IFN-γ量也較高;Rv1733c DNA疫苗對小鼠結(jié)核模型有一定的治療作用[5]。因此,筆者選擇這4種蛋白的抗原表位串聯(lián)構(gòu)建重組蛋白和DNA疫苗,應用生物信息學方法對MTB W541蛋白的結(jié)構(gòu)及功能進行預測分析,為研究新型結(jié)核病疫苗提供理論依據(jù)。
材料和方法
一、W541蛋白的氨基酸序列
本實驗室構(gòu)建的多表位串聯(lián)DNA疫苗編碼蛋白W541的氨基酸序列為:FSRPGLPVEYLQVP
SPSMGRDIKVQFQSGGANSPALYLLDGLRAQD
DFSGWDINTPAFEWYDQSGLSVVMPVGGQSSF
YSDWYQPACGKAGCQTYKWETFLTSELPGWL
QANRHVKPTGSAVVGLSMAASSALTLAIYHP
QQFVYAGAMSGLLDPSQAMGPTLIGLAMGDA
GGYKASDMWGPKEDPAWQRNDPLLNVGKLIA
NNTRVWVYCGNGKPSDLGGNNLPAKFLEGFV
RTSNIKFQDAYNAGGGHNGVFDFPDSGTHSW
EYWGAQLNAMKPDLQRALGATPNTGPAPQG
AGSGGGSGGRRLMIGTAAAVVLPGLVGLAGG
AATAGAFSRPGLPVEYLQVPSPSMGRDIKVQF
QSGGNNSPAVYLLDGLRAQDDYNGWDINTPA
FEWYYQSGLSIVMPVGGQSSFYSDWYSPACGK
AGCQTYKWETFLTSELPQWLSANRAVKPTGS
AAIGLSMAGSSAMILAAYHPQQFIYAGSLSAL
LDPSQGMGPSLIGLAMGDAGGYKAADMWGPS
SDPAWERNDPTQQIPKLVANNTRLWVYCGNG
TPNELGGANIPAEFLENFVRSSNLKFQDAYNA
AGGHNAVFNFPPNGTHSWEYWGAQLNAMKG
DLQGPGPGLRQHASRYLARVEAGGPGPGSGV
LIPARRPQNLLDVTAEPARGRKRTLSDVLNEM
RGPGPGIPFAAAAGTAVQDSRSHVYAHQAQT
RHP。
二、W541蛋白的序列分析
分別應用在線軟件ProtParam(https://web.expasy.org/Protparam)預測分析蛋白的理化性質(zhì);應用Protscale(https://web.expasy.org/protscale)預測分析蛋白的親(疏)水性;應用TMHMM(TMHMM Server v.2.0)(https://services.healthtech.dtu.dk/service.php?TMHMM-2.0)預測分析蛋白的跨膜區(qū)域。
三、W541蛋白的二級和三級結(jié)構(gòu)預測
應用在線軟件SOPMA(http://npsa-pbil.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html)對該蛋白的二級結(jié)構(gòu)進行預測分析;應用SWISS-MODEL(http://swissmodel.expasy.org)分析其三級結(jié)構(gòu),并進行同源建模。
四、W541蛋白質(zhì)亞細胞定位預測
應用PSORT Prediction (https://psort.hgc.jp/)和SingnalP 5.0 Server(https://services.healthtech.dtu.dk/service.php?SignalP-5.0)預測分析W541蛋白的亞細胞定位及信號肽。
五、W541蛋白質(zhì)翻譯后的修飾預測
應用NetNGlyc 1.0 Server(https://services.healthtech.dtu.dk/service.php?NetNGlyc-1.0)和NetOGlyc 4.0 Server(https://services.healthtech.dtu.dk/service.php?NetOGlyc-4.0)預測蛋白的糖基化修飾位點;應用NetPhos 3.1 Server(https://services.healthtech.dtu.dk/service.php?NetPhos-3.1)預測蛋白的磷酸化位點。
六、W541蛋白抗原表位的預測
1.B細胞表位的預測:應用在線軟件IEDB(http://tools.iedb.org/bcell/)對該蛋白的B細胞抗原表位進行預測。輸入氨基酸序列,通過KarpIus&Schulz分析柔韌性、Kolaskar和Tongaonkar預測抗原性、Emini預測抗原表面可及性、Parker預測親水性,Chou和Fasman法預測氨基酸編碼蛋白質(zhì)的β轉(zhuǎn)角,對B細胞表位進行聯(lián)合預測分析;最后選取親水性與表面可及性良好、柔韌性強、抗原性好、最好為卷曲和轉(zhuǎn)角這種可能性大的區(qū)域作為候選B細胞表位,盡量避開a螺旋、β折疊結(jié)構(gòu)。
2.Th表位的預測:(1)應用SYFPEITHI超基序法預測Th表位,登陸網(wǎng)址(http://www.syfpeithi.de/),點擊EPITOPEPREDICTION進入表位預測界面,輸入W541蛋白氨基酸序列,對MHC類型為HLA-DRB1*0101、HLA-DRB1*0301(DR17)、HLA-DRB1*0401(DR4Dw4)、HLA-DRB1*0701、HLA-DRB1*1101、HLA-DRB1*1501(DR2b)進行遠程預測,選多肽長度為15aa,取分值≥18分的序列為候選Th表位。(2)應用RANKPEP軟件預測Th表位,登陸網(wǎng)址(http://imed.med.ucm.es/Tools/rankpep.html),輸入W541蛋白氨基酸序列,在MHCII中選擇亞型為HLA-DR1(DRB1*0101)、HLA-DR17(DRB1*0301)、HLA-DR4(DRB1*0401)、HLA-DR7(DRB1*0701)、HLA-DR8(DRB1*0801)、HLA-DR11(DRB1*1101)及HLA-DR15(DRB1*1501)的限制性Th細胞表位進行預測,記錄有紅色標記的為候選表位序列。綜合分析上述兩種軟件的預測結(jié)果,將得分均較高的序列選為候選Th表位。
3.CTL表位的預測:(1)應用SYFPEITHI超基序法預測CTL表位,登陸網(wǎng)址(http://www.syfpeithi.de/),點擊EPITOPEPREDICTION進入表位預測界面,輸入W541蛋白氨基酸序列,選擇HLA-A*02:01、HLA-A*03、HLA-B*07:02三類進行遠程預測,選多肽長度為9aa,取分值≥18分的序列。(2)應用RANKPEP軟件預測CTL表位,登陸網(wǎng)址(http://imed.med.ucm.es/Tools/rankpep.html),輸入W541蛋白氨基酸序列,在MHCI中選擇HLA-A*02:01(A2)、HLA-A*03:01(A3)、HLA-B*07:02 (B7)三類限制表型進行遠程預測,記錄有紅色標記的為候選表位序列。(3)應用NetMHC軟件預測CTL表位,登陸網(wǎng)址(http://www.cbs.dtu.dk/services/NetMHC/),輸入W541蛋白氨基酸序列,選多肽長度為9aa,對MHC Ⅰ類型為HLA-A*02:01(A2)、HLA-A*03:01(A3)、HLA-B*07:02(B7)三類進行遠程預測,記錄有紅色標記的為候選表位序列。(4)應用NetCTL軟件預測CTL表位,登陸網(wǎng)址(http://www.cbs.dtu.dk/services/NetCTL/),輸入W541 DNA疫苗氨基酸序列,選擇A2、A3、B7三類表型,記錄綜合預測值(COMB)≥0.75的9肽為候選CTL表位。(5)應用IEDB軟件預測CTL表位,登陸網(wǎng)址(http://www.iedb.org/),輸入W541蛋白氨基酸序列,選多肽長度為9aa,對MHC Ⅰ類型為HLA-A*02:01(A2)、HLA-A*03:01(A3)、HLA-B*07:02(B7)三類進行遠程預測,記錄得分>0.5分的為候選表位序列。綜合分析上述5種軟件的預測結(jié)果,將得分均較高的序列選為候選CTL表位。
七、W541蛋白相互作用網(wǎng)絡分析
應用STRING在線軟件(https://www.string-db.org/)預測蛋白相互作用網(wǎng)絡。
八、W541蛋白與人類蛋白的同源性分析
采用EXPASY在線軟件(https://web.expasy.org/blast/)BLAST分析蛋白氨基酸序列與人類蛋白的同源性。
結(jié) 果
一、W541的序列分析
1. W541蛋白的理化性質(zhì)分析:分子式為C3329H5035N923O993S24,原子總數(shù)為10 304個,由C、H、N、O、S 5種元素組成,相對分子質(zhì)量為74.64463,理論等電點為6.29。共由704個氨基酸構(gòu)成(圖1),該蛋白中帶正電荷的氨基酸殘基(Arg+Lys)總數(shù)為48,帶負電荷的氨基酸殘基(Asp+Glu)總數(shù)為52。計算出不穩(wěn)定指數(shù)為45.37,而將該蛋白質(zhì)歸類為不穩(wěn)定蛋白質(zhì)。脂溶性指數(shù)為68.85,消光系數(shù)為152 095或151 720。親水性總平均值(GRAVY)為-0.294,屬于親水性蛋白質(zhì)(圖2)。
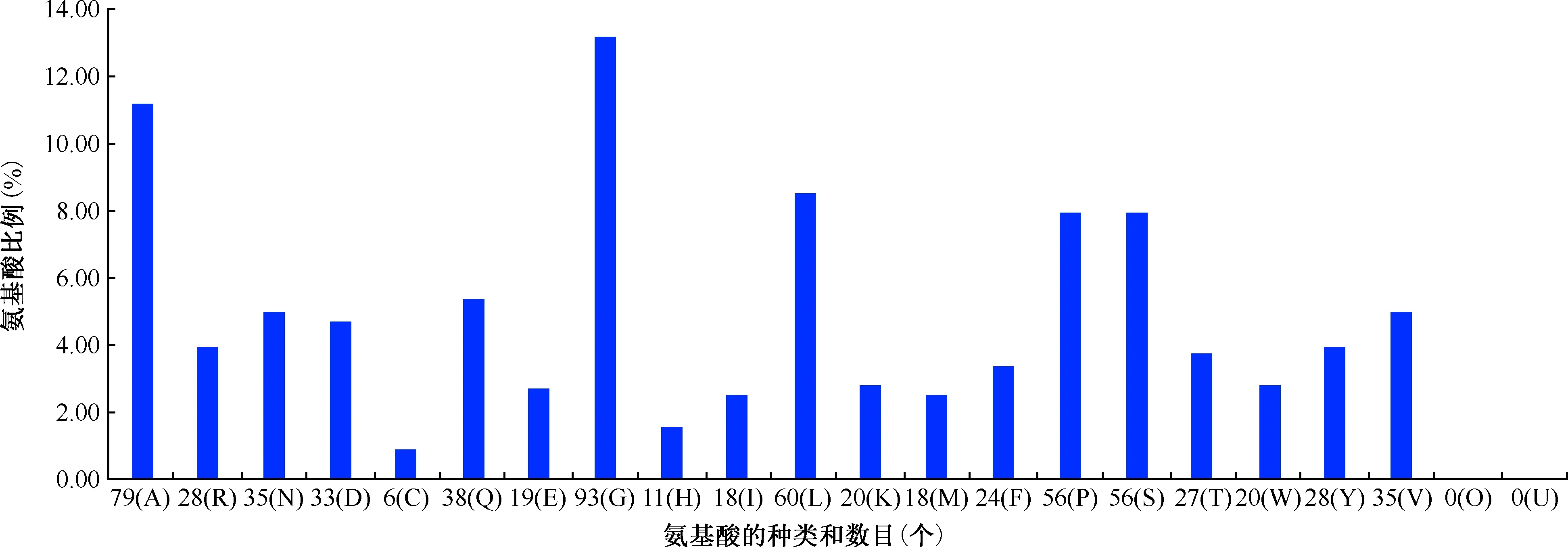
圖1 MTB W541氨基酸的種類、數(shù)目及比例
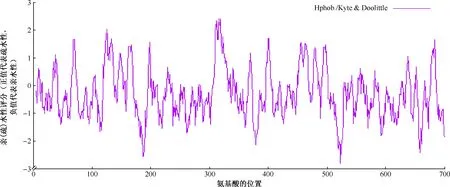
圖2 MTB W541蛋白的親(疏)水性
2.應用TMHMM軟件預測跨膜結(jié)構(gòu):結(jié)果顯示該蛋白跨膜螺旋氨基酸數(shù)為7.8724(該指標>18提示很有可能為跨膜蛋白),N端前60個氨基酸中跨膜氨基酸數(shù)為0.0007,N端位于膜胞質(zhì)側(cè)的總概率為0.05535。綜合分析表明W541蛋白位于膜外,沒有跨膜結(jié)構(gòu)(圖3)。
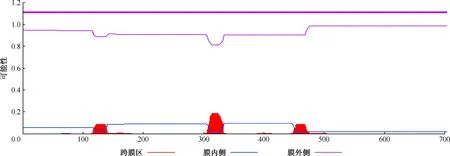
注 橫坐標代表蛋白氨基酸殘基序號,縱坐標的數(shù)值代表每個氨基酸位于膜內(nèi)側(cè)、膜外側(cè)或跨膜螺旋區(qū)的概率值
二、W541的二級和三級結(jié)構(gòu)分析
應用SOPMA軟件預測W541蛋白的二級結(jié)構(gòu)結(jié)果見圖4。該蛋白二級結(jié)構(gòu)中含α-螺旋(Hh)190個(占26.99%),β-折疊(Ee)134個(占19.03%),β-轉(zhuǎn)角(Tt)81個(占11.51%),無規(guī)則卷曲(Cc)299個(占42.47%)。W541蛋白中α-螺旋、β-折疊和β-轉(zhuǎn)角的總含量為 57.53%,提示該蛋白的二級結(jié)構(gòu)可能較穩(wěn)定。
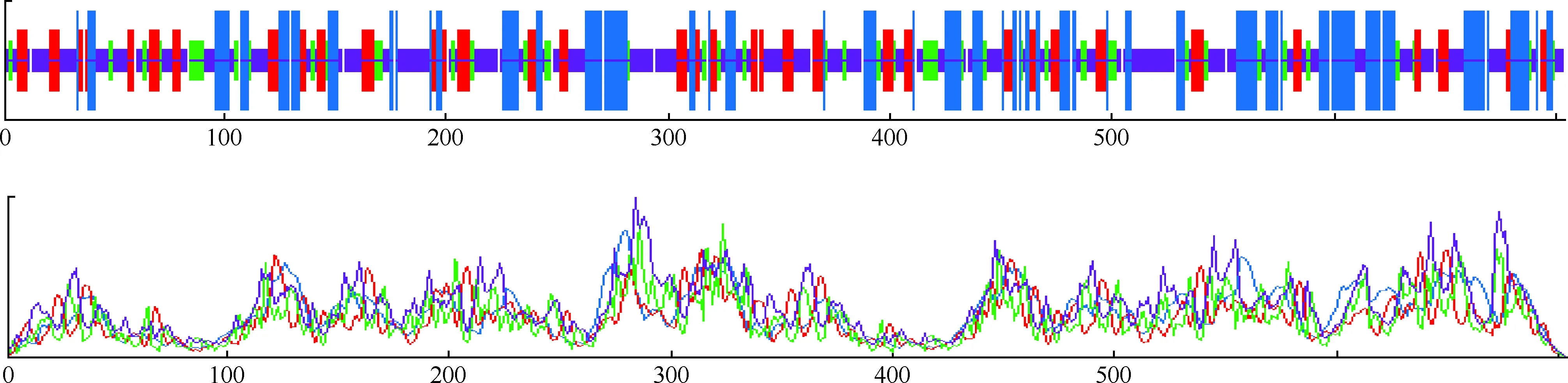
圖4 MTB W541蛋白的二級結(jié)構(gòu)預測
應用SWISS-MODEL服務器總共構(gòu)建出3個W541蛋白三級結(jié)構(gòu)模型圖,本文選擇模型1(圖5A),其序列與MTB Ag85C蛋白的一致性為67.01%,可信度范圍為0.32,待測蛋白與膜蛋白的匹配度區(qū)間為-0.82。應用MolProbity(MolProbity version 4.4)對該三級結(jié)構(gòu)模型進行評估(圖5B),結(jié)果顯示90%以上的氨基酸殘基位于可信區(qū)域內(nèi),Ramachandran異常值為0.72%,只有一個氨基酸殘基SER33A出現(xiàn)C-β偏差而位于白色區(qū)域,證明該模型結(jié)構(gòu)較可靠。
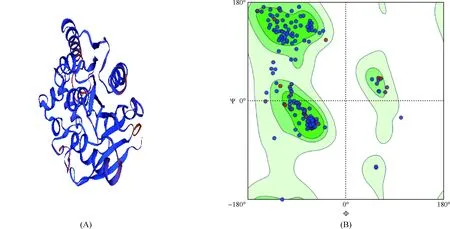
注 深綠色代表氨基酸殘基在最大允許區(qū)域,中綠色代表氨基酸殘基在允許區(qū)域,淺綠色代表氨基酸殘基在一般允許區(qū)域,白色為不允許區(qū)域。深綠色與中、淺綠色區(qū)域一致。(A)MTB W541蛋白同源建模的三級結(jié)構(gòu)圖;(B)建模評價拉曼(Ramachandran)圖
三、 W541蛋白質(zhì)亞細胞定位注釋
應用SignalP和PSORT軟件分析均顯示該蛋白無信號肽(圖6)。應用PSORT軟件對蛋白質(zhì)進行亞細胞定位分析,顯示該氨基酸為細菌膜蛋白質(zhì)。

圖6 MTB W541蛋白的信號肽預測
四、W541蛋白質(zhì)翻譯后的修飾
1.蛋白磷酸化位點的預測:應用NetPhos 3.1服務器預測出W541蛋白磷酸化位點62個,其中絲氨酸磷酸化位點35個,蘇氨酸磷酸化位點15個,酪氨酸磷酸化位點12個(圖7)。
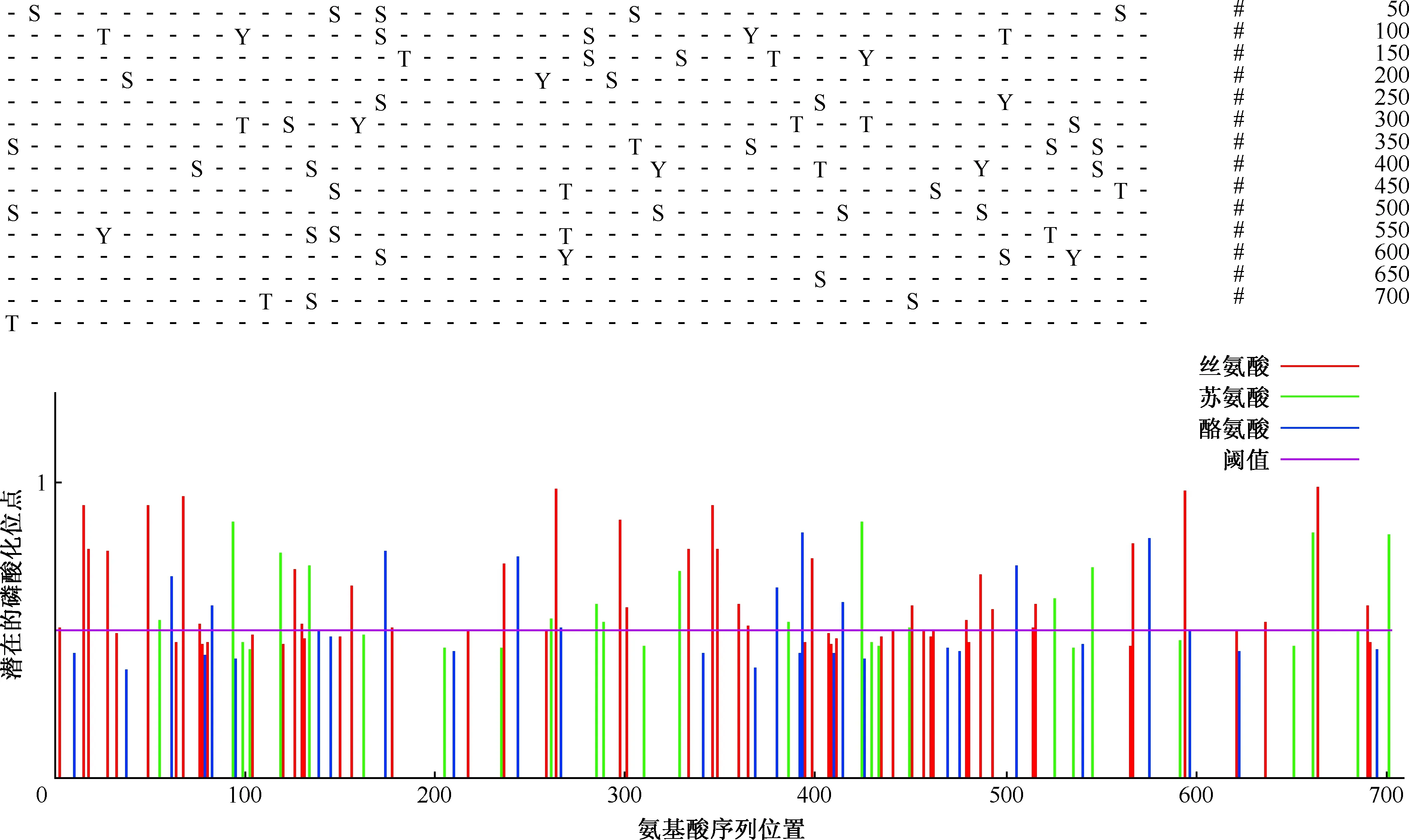
圖7 MTB W541蛋白的磷酸化位點預測
2.蛋白糖基化位點的預測:應用NetNGlyc 1.0 服務器預測出W541蛋白可能存在2個N型糖基化修飾位點,分別位于203和590(圖8);應用NetOGlyc 4.0 服務器預測出W541蛋白可能存在4個 O型糖基化修飾位點,分別位于285、288、297和652位點。
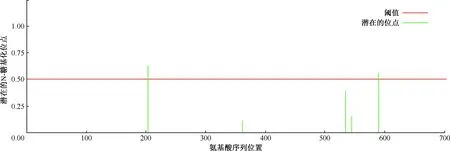
圖8 MTB W541糖基化位點預測
五、 W541蛋白的表位預測
1.W541抗原蛋白的B細胞表位預測:通過IEDB軟件對W541蛋白的B細胞表位進行預測,柔韌性越強越有利于抗原與抗體結(jié)合,柔韌性參數(shù)以基線1.0為參照,高于1.0的氨基酸區(qū)段柔韌性強,是易形成抗原表位的區(qū)域,可及性高于基線1.0的區(qū)段易形成B細胞表位,再通過結(jié)合線性表位、β轉(zhuǎn)角、抗原性這3個方面篩選,篩選得出B細胞表位有4~16、34~42、64~72等23個(表1)。
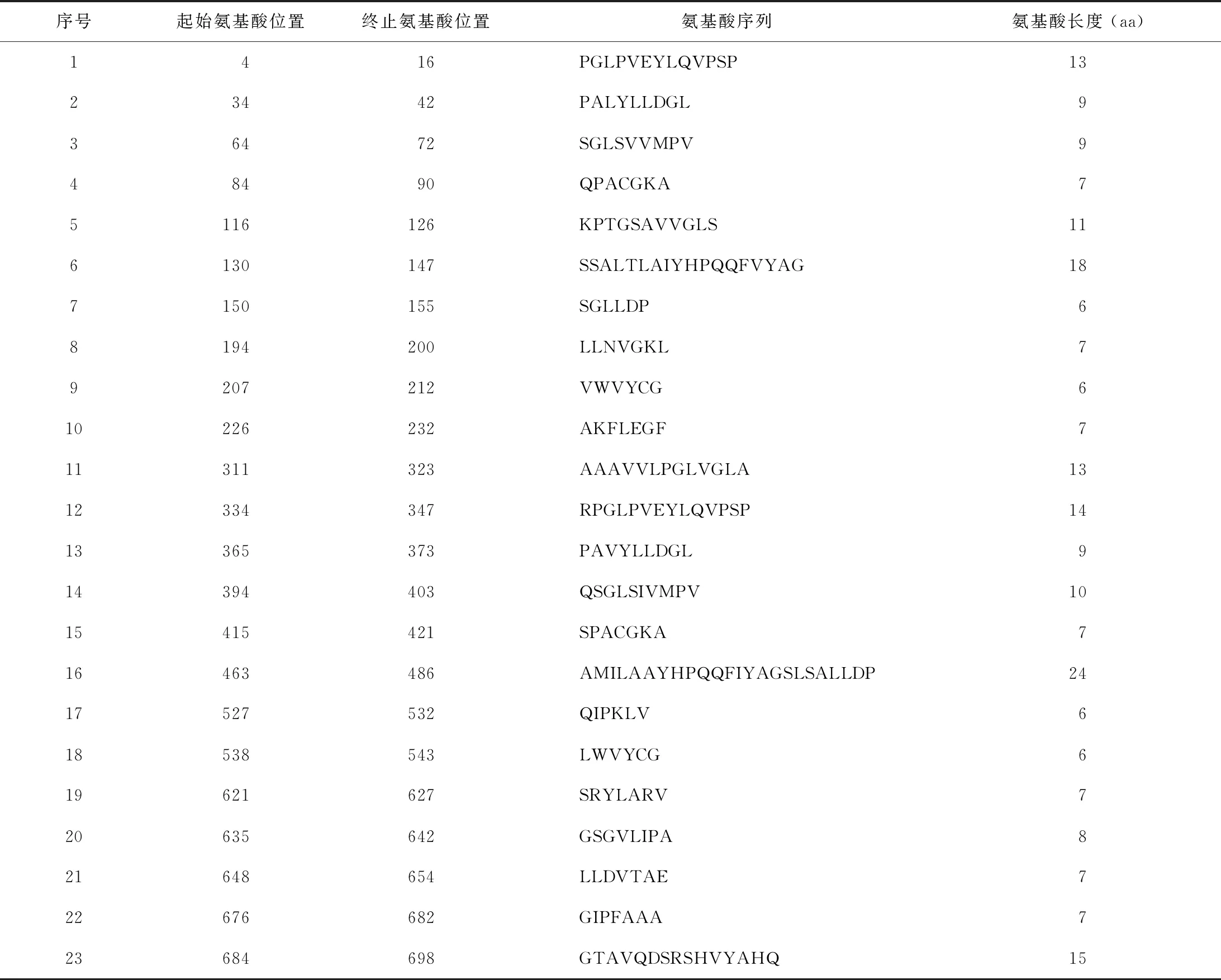
表1 IEDB軟件預測MTB W541蛋白的B細胞抗原表位
2.W541的Th細胞表位:利用SYFPEITHI和RANKPEP在線軟件預測,分值較高的Th細胞抗原表位結(jié)果見表2、3,其中HLA-DRB1*0101、HLA-DRB1*0401及HLA-DRB1*1501表型的表位數(shù)目較多。結(jié)合HLA-DRB1*0301、HLA-DRB1*0701、HLA-DRB1*01101、表型中分值較高的表位、無法預測的HLA-DRB1*0801表型中的表位及兩種預測軟件的結(jié)果綜合分析,判定該蛋白的優(yōu)勢候選Th表位主要集中在94~108、226~240、304~318等氨基酸區(qū)段。
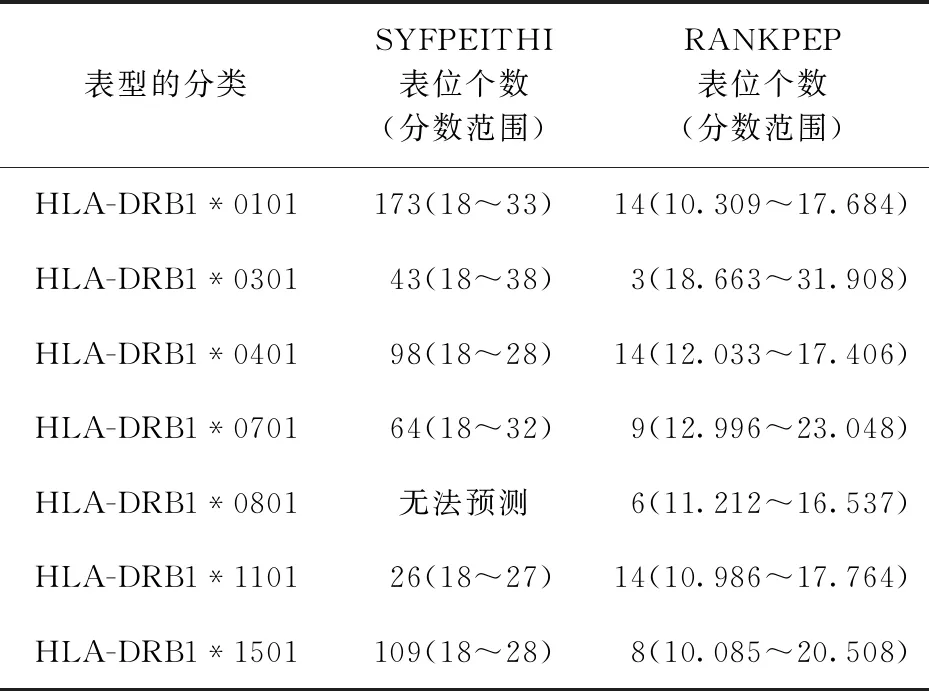
表2 MTB W541抗原的Th表位
3.W541的CTL細胞表位:運用SYFPEITHI、RANKPEP、NetMHC和IEDB 4種生物信息學軟件對W541進行預測,分值較高的CTL細胞抗原表位結(jié)果見表4、5。綜合分析得出該蛋白的CTL表位數(shù)量主要集中分布于HLA-A2和HLA-B7限制性T細胞表位,少部分位于HLA-A3限制性T細胞表位,推測其最佳候選CTL表位可能位于MPVGGQSSF(70~78),AMGDAGGYK(167~175),KLIANNTRV(199~207)等氨基酸區(qū)段。
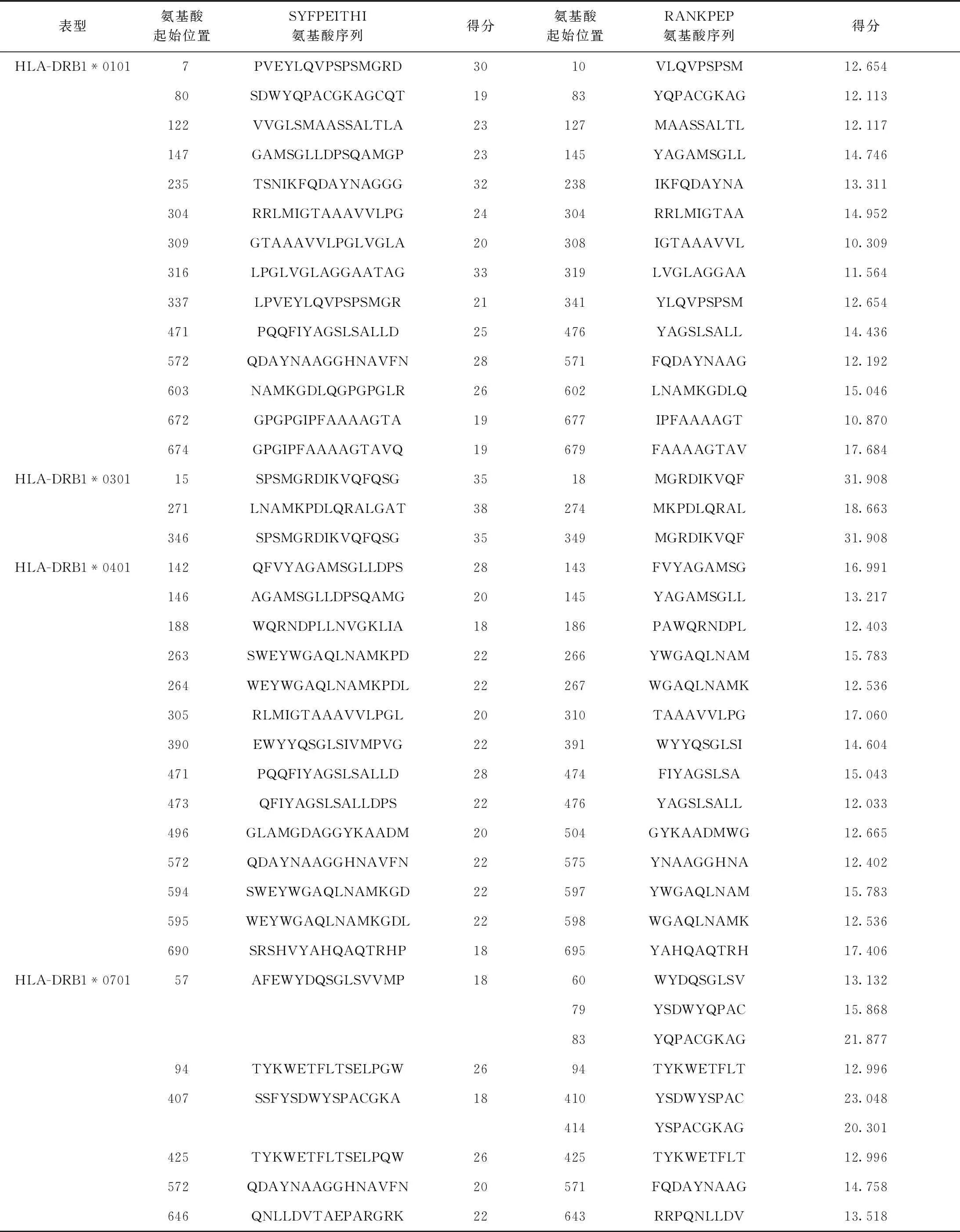
表3 MTB W541抗原的候選Th表位
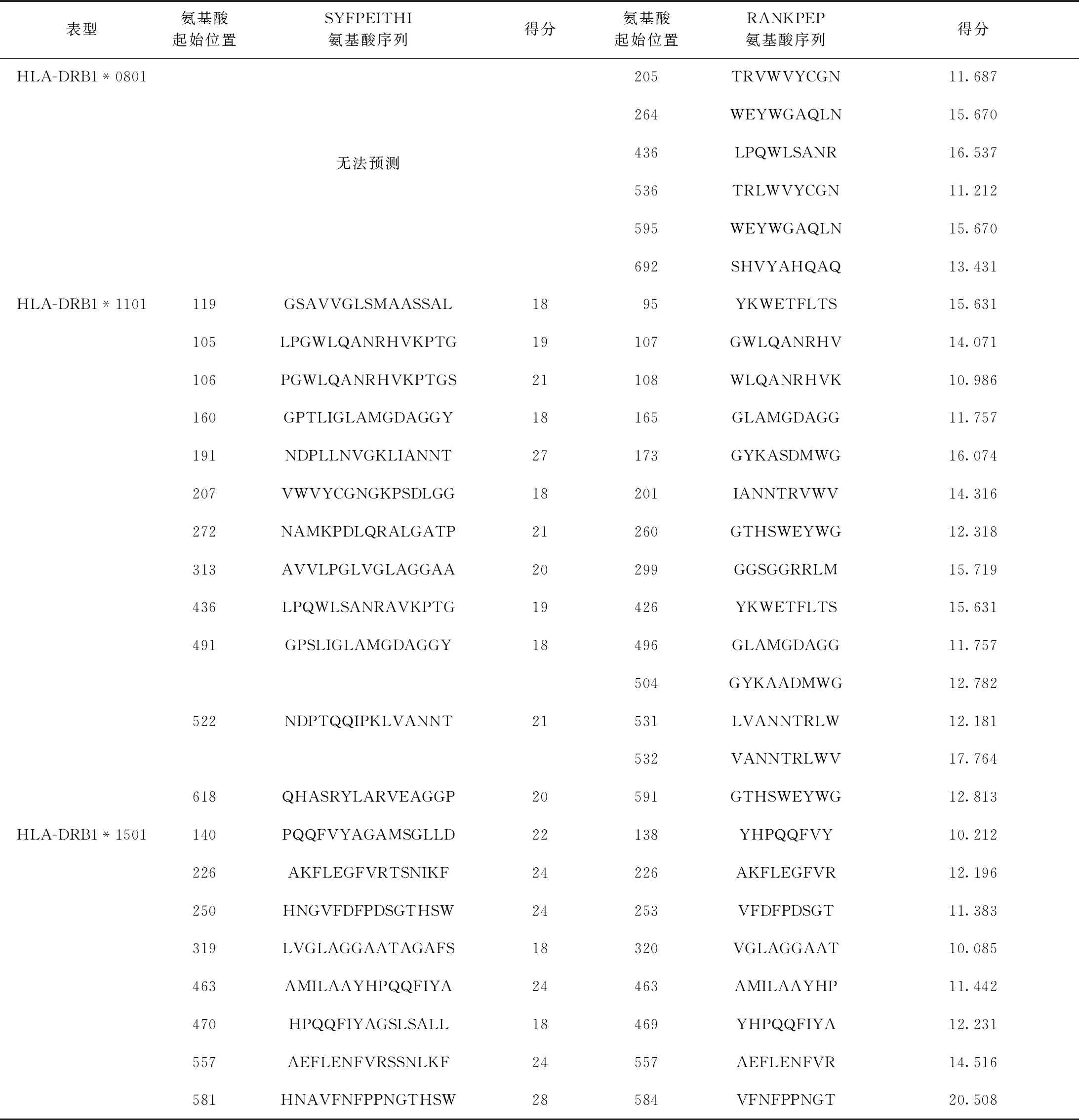
續(xù)表3
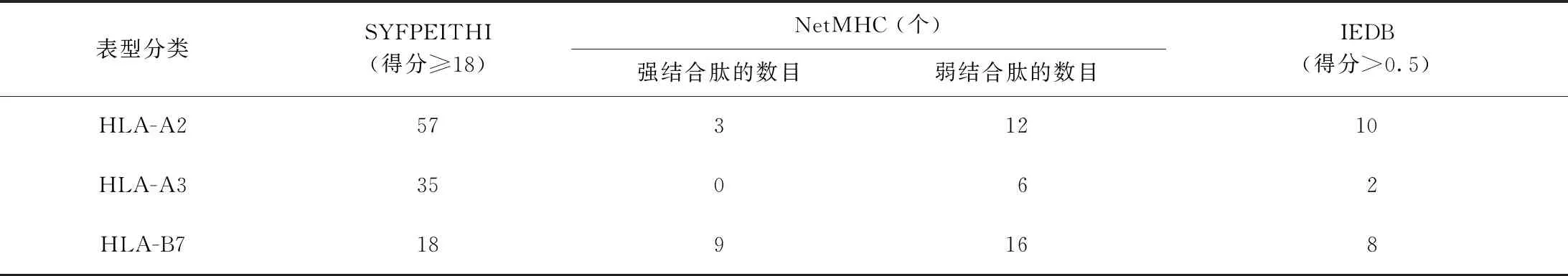
表4 MTB W541蛋白的CTL表位
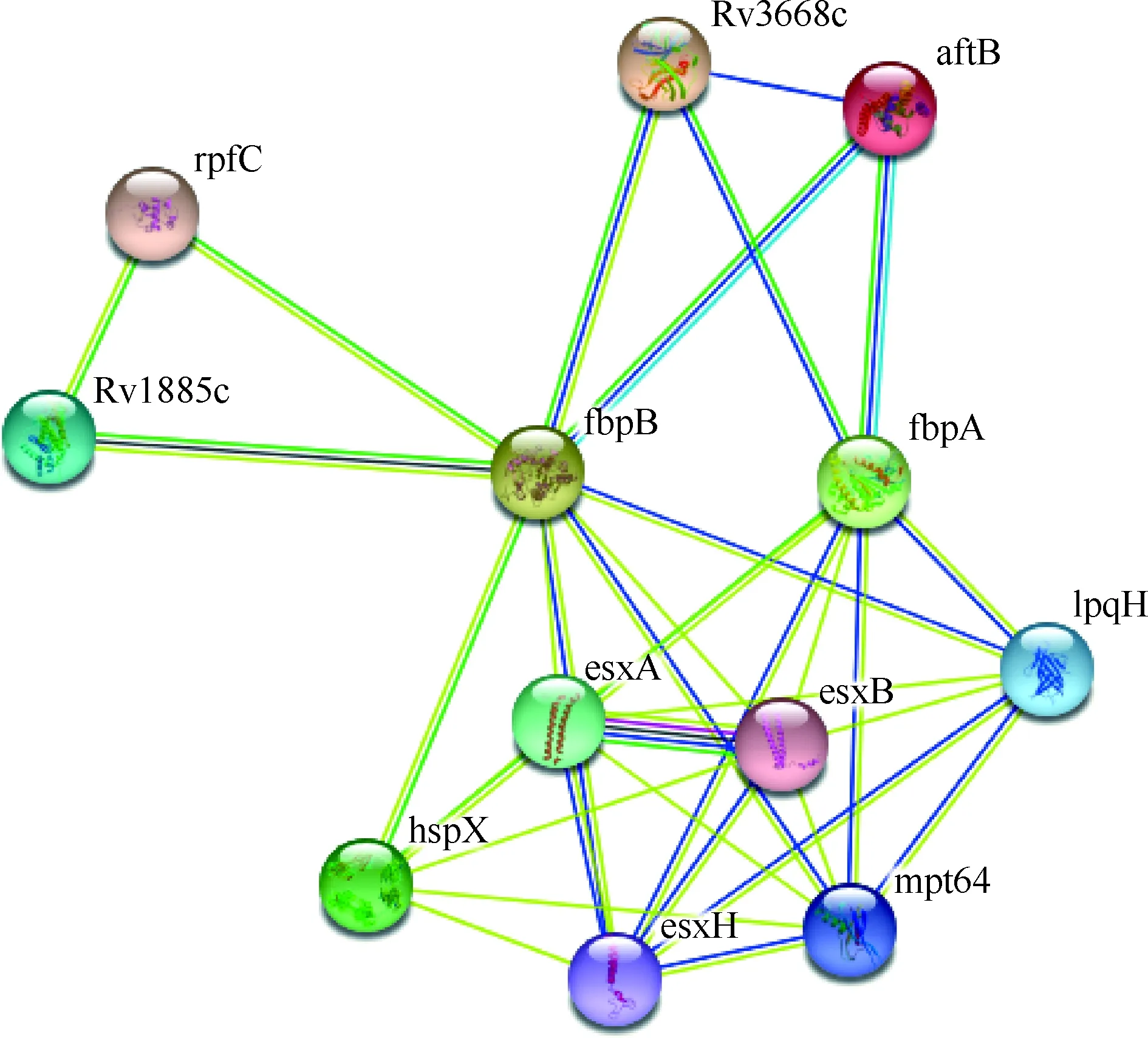
圖9 MTB W541蛋白相互作用網(wǎng)絡
六、W541蛋白相互作用網(wǎng)絡分析結(jié)果
應用STRING服務器對W541蛋白進行蛋白質(zhì)相互作用網(wǎng)絡分析,結(jié)果顯示,W541蛋白的主要組成蛋白fbpA(即Ag85A)和fbpB(即Ag85B)與10個MTB蛋白rpfC(Rv1884)、Rv1885c(即MtCM)、Rv3668c、aftB、lpqH(即Rv3763、19 kDa脂蛋白)、esxB(即Rv3874、CFP10)、esxA(即Rv3875、ESAT6)、hspX(即Rv2031c、16 kDa抗原)、esxH(即Rv0288、TB10.4)和mpt64(即Rv3036c)均存在相互作用關系(圖9)。
七、W541蛋白與人類蛋白同源性分析結(jié)果
通過BLAST分析,發(fā)現(xiàn)W541蛋白的氨基酸序列與人輸卵管相關蛋白3(tubby-related protein 3)只有3.27%(23/704)的同源性,同源性主要位于第26~92位氨基酸殘基,這段同源性達到33.82%(23/68)。與人S-甲酰谷胱甘肽水解酶也只有2.70%(19/704)的同源性。由此可見,W541蛋白與人類蛋白的同源性極低。
討 論
近年來生物信息學方法的迅猛發(fā)展和互聯(lián)網(wǎng)數(shù)據(jù)庫的開發(fā)應用,為蛋白優(yōu)勢表位的選擇和表位串聯(lián)疫苗的評估提供了有效的方法。本研究利用生物信息學方法分析MTB W541的結(jié)構(gòu)及功能,為W541疫苗的進一步優(yōu)化奠定了基礎。
信號肽不僅與蛋白質(zhì)在細胞內(nèi)的定位有關,還能決定一個蛋白質(zhì)是否為分泌蛋白[6]。而跨膜區(qū)的蛋白質(zhì)有可能是膜偶聯(lián)受體,也可能是膜偶聯(lián)酶及膜離子通道等。本研究預測W541蛋白無信號肽和跨膜區(qū),定位于細胞質(zhì)膜,提示該蛋白可能為非跨膜、不分泌的細胞質(zhì)膜蛋白,這與其構(gòu)成的4種抗原單獨預測并不完全一致,目前研究已證實Ag85A、Ag85B、Rv3407和Rv1733c均未發(fā)現(xiàn)信號肽[7-9],但殷月蘭等[8]的預測顯示Ag85A和Ag85B兩者均含有一個跨膜螺旋結(jié)構(gòu),并可通過其他分泌途徑釋放到菌體外;而de Souza等[7]在MTB H37Rv標準株的培養(yǎng)濾液和細胞壁中未能檢出Rv3407蛋白;劉靜等[9]報道Rv1733c也是一個跨膜蛋白。由此可見,4種蛋白部分抗原表位串聯(lián)后形成的W541融合蛋白的特性已發(fā)生了很大變化。
蛋白質(zhì)磷酸化是一種重要的翻譯后修飾,大多數(shù)蛋白質(zhì)在翻譯結(jié)束后需經(jīng)不同程度的化學修飾才能成為具有功能的成熟蛋白質(zhì)。在真核生物中,蛋白質(zhì)磷酸化通常發(fā)生在絲氨酸、蘇氨酸、酪氨酸和組氨酸殘基上。本研究發(fā)現(xiàn)W541蛋白含有62個磷酸化位點,劉靜等[9]和李小平等[2]預測Rv1733c/Rv3407也分別含有多個磷酸化位點,蛋白質(zhì)通過這種修飾參與激素、生長因子、細胞因子和環(huán)境應激中的信號轉(zhuǎn)導,誘導多種生理功能,調(diào)控細胞過程,從細胞增殖、分化、發(fā)育到細胞凋亡等[10]。因此,W541可能具有重要的調(diào)控作用。
蛋白質(zhì)糖基化也是一種重要的翻譯后修飾,使蛋白質(zhì)在成熟過程中折疊成正確構(gòu)象,可增加蛋白質(zhì)的穩(wěn)定性,而且這些蛋白通常與細胞信號的識別有關,如受體蛋白等。本研究發(fā)現(xiàn),W541蛋白含有6個糖基化位點,也提示它具有調(diào)節(jié)蛋白質(zhì)的功能作用,對于W541蛋白作為疫苗的溶解度、穩(wěn)定性、半衰期和活性等都將具有重要的影響。
蛋白質(zhì)的二級結(jié)構(gòu)與B細胞表位關系密切。蛋白二級結(jié)構(gòu)中的β-轉(zhuǎn)角和無規(guī)則卷曲結(jié)構(gòu)相對松散,易于扭曲、盤旋,且暴露于蛋白表面,可與抗體較好的嵌合,常含有B細胞的優(yōu)勢表位[11]。α螺旋和β折疊結(jié)構(gòu)規(guī)則不易變形,常處于蛋白質(zhì)內(nèi)部,與抗體不易結(jié)合,一般不含有B細胞表位。由于W541蛋白含有較多的Ag85A和Ag85B抗原表位,因此本研究W541蛋白的二級結(jié)構(gòu)和三級結(jié)構(gòu)預測的結(jié)果與殷月蘭等[8]對Ag85復合物預測的結(jié)果相似,都含有較大比例的無規(guī)則卷曲,它們大多位于蛋白分子表面,較可能成為優(yōu)勢B細胞抗原表位,而能夠誘導機體產(chǎn)生有效的免疫應答。本研究結(jié)果顯示,W541蛋白具有Th表位、CTL表位和B細胞表位,是一個T細胞抗原表位占優(yōu)勢的蛋白抗原,其中許多Th表位和CTL表位均已通過試驗證明,如陳燕等[12]研究證實GLPVEYLQV和KLIANNTRV抗原肽是MTB Ag85A中2個主要的HLA-A*0201限制性CD8+CTL表位。殷月蘭等[8]、liang等[13]、李小平等[2]、劉靜等[9]的研究結(jié)果已顯示W(wǎng)541蛋白的主要構(gòu)成抗原Ag85A、Ag85B和Rv3407、Rv1733c蛋白均具有誘導細胞免疫應答和體液免疫應答的效能。鄭越[14]也報道Ag85A、Ag85B DNA疫苗都具有較強的免疫原性,呈Th1型細胞介導的免疫應答。T細胞表位誘導的細胞免疫應答在抗結(jié)核免疫中發(fā)揮關鍵的作用;B細胞誘導的體液免疫應答在抗MTB感染過程中也發(fā)揮一定的免疫保護作用,如通過抗體的中和作用、調(diào)理吞噬作用、激活補體作用、抗體依賴的細胞介導的細胞毒性作用等,減少病理損傷,增強對MTB的殺傷作用。因此,W541蛋白可能成為理想的免疫原,為疫苗的研發(fā)奠定基礎。
本研究對W541蛋白相互作用網(wǎng)絡分析發(fā)現(xiàn),W541的主要組成蛋白Ag85A和Ag85B之間不存在相互作用關系;與其存在相互作用關系的10個MTB蛋白中,大多數(shù)是分泌蛋白,而且文獻報道中許多蛋白為T細胞抗原,如早期分泌抗原靶-6(ESAT-6)和培養(yǎng)濾液蛋白-10(CFP-10)因能誘導宿主產(chǎn)生強烈細胞免疫應答,成為新型結(jié)核病疫苗的熱門優(yōu)勢抗原[15]。袁偉[16]將MTB休眠期抗原HspX與Ag85B和ESAT-6聯(lián)合構(gòu)建了能夠在真核細胞表達融合蛋白的重組質(zhì)粒pcDNA-Ag85B-Esat6-HspX,發(fā)現(xiàn)DNA疫苗可在小鼠體內(nèi)刺激產(chǎn)生較強的體液和細胞免疫應答,具有較強的免疫原性。TB10.4含有CD8 T細胞表位,在整個MTB感染過程中均可誘導特異性CD8 T細胞應答,可招募特異性CD8 T細胞到感染部位并表達CD44、TNF-α和IFN-γ,上調(diào)CD8 T細胞的FasL和LAMP-1/2(CD107A/B)的表達水平,使這兩種細胞具有強烈的體內(nèi)細胞溶解活性[17]。MTB MPT64 DNA疫苗免疫小鼠能誘發(fā)特異的體液和細胞免疫應答,對小鼠抗MTB感染具有一定的免疫保護效力。rpfC蛋白[18]是一種復蘇促進因子,作為亞單位疫苗免疫C57BL/6小鼠,可誘導機體產(chǎn)生特異性IgG抗體,刺激T細胞分泌高水平的Th1型細胞因子(如IFN-γ和IL-12)和低水平的Th2型細胞因子(如IL-4和IL-5),并延長結(jié)核感染小鼠的存活時間,降低其肺和脾臟中MTB數(shù)量,證明該蛋白具有一定的免疫保護作用,可作為候選疫苗組分之一。因此,W541作為疫苗可能誘導保護性免疫在抗結(jié)核感染中發(fā)揮重要作用。
W541蛋白與人類蛋白的同源性極低,若作為疫苗免疫后,不會與人類蛋白產(chǎn)生交叉反應,不會引起自身免疫性疾病。因此,W541具有較好的安全性。
綜上所述,本研究采用生物信息學方法預測MTB W541蛋白具有多個潛在的T、B細胞抗原表位,其中以T細胞抗原表位占優(yōu)勢,作為疫苗的免疫原可能誘導保護性免疫應答,并發(fā)揮重要的調(diào)控作用,可作為候選疫苗進一步進行動物試驗評價。
利益沖突所有作者均聲明不存在利益沖突
作者貢獻李鵬川:起草文章;梁艷、張林西和吳雪瓊:指導文章撰寫工作、對文章的知識性內(nèi)容作批評性審閱

