特發性肺間質纖維化急性加重患者呼吸道微生態成分與不良預后的關系
陳熔,王旭,舒靜,莫尚堯,鄧浩
特發性肺纖維化為特發性肺炎中常見類型,發病率逐年升高,且預后較差,臨床病死率高, 治療不及時,可發展為彌漫性的間質性肺纖維化,對患者生命安全造成威脅[1-2]。隨著病情的發展,其可逐漸進展為低氧血癥、心肺功能衰竭,導致患者死亡[3]。臨床研究顯示[4],呼吸道菌群主要由共生、病原微生物組成,肺部菌群的負荷、豐度、多樣性可受到病情嚴重程度、機體生理功能影響,菌群變化特點在肺部疾病的發生、發展、急性發作中具有重要作用,且微生態失衡可對疾病的預后造成影響。病情重、全身情況差患者機體內常伴有感染的發生,可致機體肺部微生物群落改變,促進不良預后的發生[5]。基于此,現分析特發性肺間質纖維化急性加重患者呼吸道微生態成分與不良預后的關系,報道如下。
1 資料與方法
1.1 臨床資料 選取2020年1月—2021年1月四川省南充市中心醫院呼吸與危重癥醫學科診治特發性肺間質纖維化急性加重患者98例作為研究組,男55例,女43例,年齡50~75(65.32±4.85)歲;BMI 19~23(23.22±4.36)kg/m2;隨訪1年,再以患者預后情況分為預后良好亞組54例、預后不良亞組44例。另外選取同期特發性肺間質纖維化穩定期患者50例作為對照組,男28例,女22例,年齡52~74(64.98±4.77)歲;BMI 19~24(23.57±4.61)kg/m2。2組一般資料比較差異無統計學意義(P>0.05)。本研究經醫院倫理委員會審核批準(2020倫審第063號),患者或家屬知情同意并簽署知情同意書。
1.2 病例選擇標準 (1)納入標準:研究組患者符合“特發性肺纖維化急性加重診斷和治療中國專家共識”[6]中對于特發性肺間質纖維化急性加重期的診治標準,患者經CT檢查確診,近期存在不明原因呼吸困難,肺功能惡化。(2)排除標準:患者為過敏性肺泡炎,存在結節病、結締組織病,近期使用免疫抑制劑,存在冠心病、糖尿病等慢性疾病。
1.3 觀測指標與方法
1.3.1 呼吸道微生態成分檢測:(1)呼吸道菌群標本采集、DNA提取:患者入住ICU 24 h內,采用纖維支氣管鏡(奧林巴斯有限公司生產,BF-P60型)檢查肺泡灌洗液,使用生理鹽水沖洗患者支氣管肺泡,對回收液進行沖洗,4℃保存。將沖洗液離心棄去上層清液留取沉淀物,采用無菌磷酸鹽緩沖液200 μl對沉淀物進行重懸,后使用DNA提取試劑盒(上海晶諾生物科技有限公司)、PCR擴增試劑盒(北京天根生化科技有限公司)對懸浮物中DNA進行抽取。(2)菌群測序評定:采用高通量測序平臺(武漢基諾賽克科技有限公司,型號HiSeq TM2000)對細菌豐度、多樣性、菌群門進行分析,根據基因表達標簽分類細菌物種,對群落豐度、多樣性進行分析。采用Mothur對群落多樣性進行計算,使用Alpha多樣性根據實際觀測到的分類操作單元(OTU)數目進行評估,群落豐度采用chao指數、sobs指數、ace指數,豐度與數值相關,可反映群落豐度;采用shannon指數、simpson指數對群落多樣性進行評估,判斷樣品中物種豐度、物種均勻度,數值越大,多樣性越低。
1.3.2 預后情況:對患者進行1年的隨訪,時間截至2022年2月。患者咳嗽、咯痰、肺部啰音癥狀緩解,胸部X線片檢測異常影像減少為預后良好,患者臨床癥狀未發生變化,胸部X線片檢查異常影像增多為預后不良。
2 結 果
2.1 2組臨床特征比較 2組患者性別、年齡、病程、BMI、飲酒、吸煙、有無治療史比較,差異無統計學意義(P>0.05)。研究組患者TLC、VC、FEV1/FVC、IFN-γ低于對照組,病情程度重、干咳、胸悶、有家族遺傳史比例及BMI、TNF-α、IL-4高于對照組,差異均有統計學意義(P<0.05),見表1。

表1 對照組與研究組患者臨床特征比較
2.2 2組微生態豐度、多樣性、菌門比較 與對照組比較,研究組chao指數、sobs指數、ace指數、shannon指數及擬桿菌門、放線菌門占比降低,simpson指數及厚壁菌門、變形菌門占比升高(P<0.01),見表2。
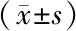
表2 對照組與研究組患者呼吸道微生態豐度、多樣性、菌門比較
2.3 不同預后亞組間微生態豐度、多樣性、菌門比較 隨訪1年研究組患者預后良好54例、預后不良44例。與預后良好亞組比較,預后不良亞組chao指數、sobs指數、ace指數、shannon指數及擬桿菌門、放線菌門占比降低,simpson指數及厚壁菌門、變形菌門占比升高(P<0.01),見表3。
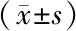
表3 不同預后亞組患者呼吸道微生態豐度、多樣性、菌門比較
2.4 呼吸道微生態成分對特發性肺間質纖維化急性加重患者不良預后的診斷價值 繪制ROC曲線,結果顯示,chao指數、sobs指數、ace指數、simpson指數、shannon指數、擬桿菌門、厚壁菌門、變形菌門、放線菌門及聯合檢測診斷特發性肺間質纖維化急性加重患者不良預后的AUC為0.709、0.751、0.679、0.709、0.777、0.724、0.732、0.688、0.697、0.908,聯合檢測價值高于單項指標檢測,見表4。

表4 呼吸道微生態成分對特發性肺間質纖維化急性加重患者不良預后的診斷價值
3 討 論
特發性肺間質纖維化是以侵襲肺泡壁為主的,肺泡組織、周邊支撐結構病變疾病的總稱,隨著臨床病情的不斷發展,患者出現呼吸困難、刺激性咳嗽癥狀[7-8]。臨床對于特發性肺間質纖維化發病機制尚未明確,相關研究顯示,慢性炎性反應、細胞外基質過度沉積可導致特發性肺間質纖維化的發展[9-11]。
TNF-α為炎性反應調節因子,可刺激超氧化物的產生,使成纖維細胞增殖速度加快,促進膠原蛋白的合成,TNF-α可結合肺泡上皮細胞,使肺泡上皮細胞凋亡、再生、壞死,導致TNF-α產生,使其發生纖維化。IL-4主要是由殺傷T細胞產生,在免疫反應中具有重要作用,IL-4可使纖維細胞增殖,到最后肺組織重構,降低肺功能[12-13]。IFN-γ可抵抗病毒的產生,并對免疫系統進行調控。研究顯示[14],呼吸道微生態平衡主要是由微生物進入呼吸道、呼吸道微生物的清除、微生態生長環境3個因素決定的,決定因素平衡失調后,可使患者呼吸道生態發生變化。在健康機體環境內,不適于細菌生長,機體內細菌繁殖較少,機體出現疾病后,可導致微生物生長環境發生變化,呼吸道微生物菌群大量繁殖[15]。呼吸道微生態失調與呼吸系統疾病的發生密切相關,在慢性呼吸系統疾病患者中,多數患者伴有胃腸道功能紊亂,且部分炎性腸病患者呼吸道癥狀較為嚴重,腸道免疫健康可對患者肺部健康造成影響[16]。疾病發生后,患者腸道、呼吸道微生態環境發生改變,導致微生物組成發生變化,腸道微生物菌群可通過對肺部微生物免疫應答的調控影響呼吸系統疾病的發生。研究顯示[17-18],益生菌可使細胞免疫、體液免疫增強,對機體內免疫應答進行調節,預防慢性呼吸系統疾病的發展。本研究發現,2組患者TLC、VC、FEV1/FVC、TNF-α、IL-4、IFN-γ表達水平具有一定差異性,可導致患者不良預后。相關學者研究顯示[19-21],機體呼吸道內菌群系統較為復雜,肺部微生態平衡遭到破壞后,患者可出現肺部疾病,導致其不良結局,特發性肺間質纖維化急性加重期患者預后較差,且患者病情不穩定,機體內生理系統較為紊亂,對患者體內微生態平衡造成破壞,導致不良預后的發生,與本研究結果一致,表明特發性肺間質纖維化急性加重期患者呼吸道微生態失調后可造成預后不良的發生。
研究顯示[22-24],肺部微生態的穩定性主要取決于菌群的組成、豐度、多樣性,呼吸道微生態多樣性、定植,可對黏膜纖毛清除功能進行破壞,使黏液生成量增加,肺部菌群受到破壞,并損傷氣道上皮,導致機體出現免疫反應,造成惡性循環。chao指數、sobs指數、ace指數、shannon指數、simpson指數為Alpha多樣性指數,sobs指數、chao指數、ace指數可反映群落豐富度,chao指數可對物種總數進行估計,chao指數越大,表明物種越多,shannon指數、simpson指數可對菌群多樣性進行判定,樣品中物種豐富度、物種均勻度可對chao指數、sobs指數、ace指數、shannon指數、simpson指數造成影響。本研究發現,chao指數、sobs指數、ace指數、shannon指數在特發性肺間質纖維化急性加重患者體內表達降低,simpson指數升高,且預后不良患者體內chao指數、sobs指數、ace指數、shannon指數降低,simpson指數升高。相關學者研究表明[25-27],肺炎、肺囊性纖維化、特發性肺間質纖維化發生時,可導致患者菌群多樣性、群落負荷發生改變,破壞肺部菌群、黏膜纖毛清除功能,導致機體出現免疫反應,加重患者病情,與本研究保持一致,表明特發性肺間質纖維化急性加重期是由共生菌減少、致病菌繁殖導致的,且可導致患者不良預后。ROC曲線顯示,chao指數、sobs指數、ace指數、shannon指數、simpson指數、各菌門占比情況聯合診斷特發性肺間質纖維化急性加重期患者不良預后具有較高診斷價值。
綜上所述,呼吸道微生態成分變化與特發性肺間質纖維化急性加重期患者不良預后相關,對其呼吸道微生態成分進行分析,可用于臨床特發性肺間質纖維化急性加重期患者不良預后的診斷,具有較高的使用價值。
利益沖突:所有作者聲明無利益沖突
作者貢獻聲明
陳熔:設計研究方案,提出研究思路,實施研究過程,論文撰寫、審核;王旭:分析試驗數據,進行統計學分析;舒靜、莫尚堯、鄧浩:資料搜集整理

