免疫抑制劑環磷酰胺對小鼠流感相關性腦病的影響*
張香港,趙澄,陳純靜,胡玨,盧芳國
(湖南中醫藥大學,湖南 長沙 410208)
流感相關性腦炎/腦病(influenza-associated encephalitis/encephalopathy)是急性流感過程中伴隨中樞神經系統功能障礙的一種臨床綜合征。流行病學調查表明,老人、兒童、孕婦以及免疫缺陷人群由于體質特殊,感染流感之后出現的癥狀也有其特殊性,患中樞神經系統并發癥的風險較高[1]。流感相關性腦病模型的建立是其防治研究的基礎。環磷酰胺是一種活性烷基化劑,具有免疫抑制作用,可抑制體液免疫和細胞免疫,導致機體整體免疫功能障礙,常用于建立免疫抑制動物模型[2]。有研究表明小鼠經環磷酰胺腹腔注射后,細胞免疫受抑制,中樞神經系統對病毒的易感性增加[3]。基于以上背景,本研究觀察免疫抑制劑環磷酰胺對小鼠流感相關性腦病的影響,旨在為流感相關性腦病模型建立提供參考,以期為流感相關性腦病防治研究奠定基礎。
材料和方法
1 材料
1.1 動物SPF級BLAB/c小鼠80只,體質量(18±2)g,雌雄各半,購自湖南斯萊克景達實驗動物有限公司,動物生產許可證號為SCXK(湘)2019-0004,實驗單位使用許可證編號為SYXK(湘)2019-0009。實驗過程中對小鼠的處理措施已通過湖南中醫藥大學實驗中心動物倫理委員會審查。
1.2 病毒株A型流感病毒(A/PR/8/34)小鼠肺適應株由湖南師范大學病毒研究室提供,-80℃保存于湖南中醫藥大學病原微生物實驗室。經10 d齡雞胚尿囊腔培養傳代,用于本實驗血凝效價為1∶640。
1.3 主要試劑注射用環磷酰胺(百特國際有限公司);白細胞介素6(interleukin 6,IL-6)抗體(R&D);腫瘤壞死因子α(tumor necrosis factor-α,TNF-α)抗體(ABclonal);閉鎖小帶蛋白1(zonula occluden-1,ZO-1)抗體(Abcam);山羊抗兔Ⅱ抗(Proteintech);IL-6 ELISA試劑盒和TNF-αELISA試劑盒(上海酶聯生物公司)。
2 主要方法
2.1 動物模型制備小鼠隨機分為正常對照組、環磷酰胺組、病毒組、環磷酰胺+病毒組,每組20只。環磷酰胺組、環磷酰胺+病毒組小鼠按照75 mg/kg的劑量腹腔注射環磷酰胺1次,其余各組小鼠同步注射相同體積0.9%生理鹽水;末次注射后24 h,病毒組、環磷酰胺+病毒組小鼠經鼻腔接種稀釋度為1∶100的流感病毒液0.05 mL建立流感病毒感染模型,其余各組小鼠同步鼻腔接種0.9%生理鹽水0.05 mL。觀察并記錄小鼠每日體質量。分別在小鼠感染流感病毒后的第3、7天每組隨機選取10只小鼠(雌雄各半),采集標本。
2.2 肺、腦指數測量常規稱量記錄小鼠體質量及肺、腦重量,計算肺、腦指數。肺指數(%)=肺組織質量(g)/體質量(g)×100%,腦指數(%)=腦組織質量(g)/體質量(g)×100%。
2.3 HE染色法觀察腦組織病理學改變各組小鼠腦組織以4%多聚甲醛固定1周后,經脫水包埋、切片、脫蠟、染色、透明、封片,于光學顯微鏡下觀察病理學變化。
2.4 各組小鼠肺組織、腦組織流感病毒載量水平檢測分別稱取小鼠肺、腦組織50 mg按試劑盒說明書提取總RNA,以β-actin為內參照,采用RT-qPCR進行流感病毒核蛋白(nucleoprotein,NP)產物擴增和結果分析。NP上游引物序列為5"-CCTGTGTGTATGGACCTGCC-3",下游引物序列為:5"-CTCTTGGGACCACCTTCGTC-3";β-actin上游引物序列為5"-ACATCCGTAAAGACCTCTATGCC-3",下游引物序列為5"-TACTCCTGCTTGCTGATCCAC-3"。
2.5 ELISA法檢測腦組織勻漿中IL-6和TNF-α的含量稱取100 mg腦組織,加入900 uL的已加入PMSF(1∶100)的PBS研磨成勻漿,離心后取上清液,按ELISA試劑盒說明書進行檢測,測得吸光度值后通過標準曲線計算樣本濃度。
2.6 免疫組化法檢測腦組織中IL-6、TNF-α和ZO-1的表達腦組織經固定、脫水、包埋、切片、脫蠟后采用PV-9000通用二步法檢測其蛋白表達水平,光學顯微鏡下觀察陽性表達。每張樣本切片隨機選取5個視野,用Image-Pro Plus 5.0軟件計算視野的平均光密度值,作為該樣本的相對表達量。
3 統計學處理
實驗數據使用SPSS 25.0處理分析。數據采用均數±標準差(mean±SD)表示,正態分布資料多組間比較使用單因素方差分析,兩兩比較使用LSD檢驗(方差齊)或Games-Howell檢驗(方差不齊);非正態分布資料采用Kruskal-Wallis秩和檢驗。以P<0.05為差異有統計學意義。
結 果
1 各組小鼠肺、腦指數及肺、腦組織病毒載量水平比較
感染后第3、7天,與正常對照組比較,病毒組小鼠肺指數顯著增加(P<0.05),環磷酰胺+病毒組小鼠肺、腦指數顯著增加(P<0.01);與病毒組比較,環磷酰胺+病毒組小鼠肺指數顯著增加(P<0.05)。感染后3天,環磷酰胺+病毒組小鼠腦指數較病毒組顯著增加(P<0.01),見圖1A。
感染后第3、7天,病毒組、環磷酰胺+病毒組小鼠肺組織中H1N1流感病毒NP基因相對表達量較正常對照組小鼠顯著增高(P<0.01)。與病毒組比較,感染后7天的環磷酰胺+病毒組小鼠肺組織中H1N1流感病毒NP基因相對表達量較病毒組顯著增高(P<0.01)。各組小鼠腦組織中未檢出H1N1流感病毒NP基因表達,見圖1B。
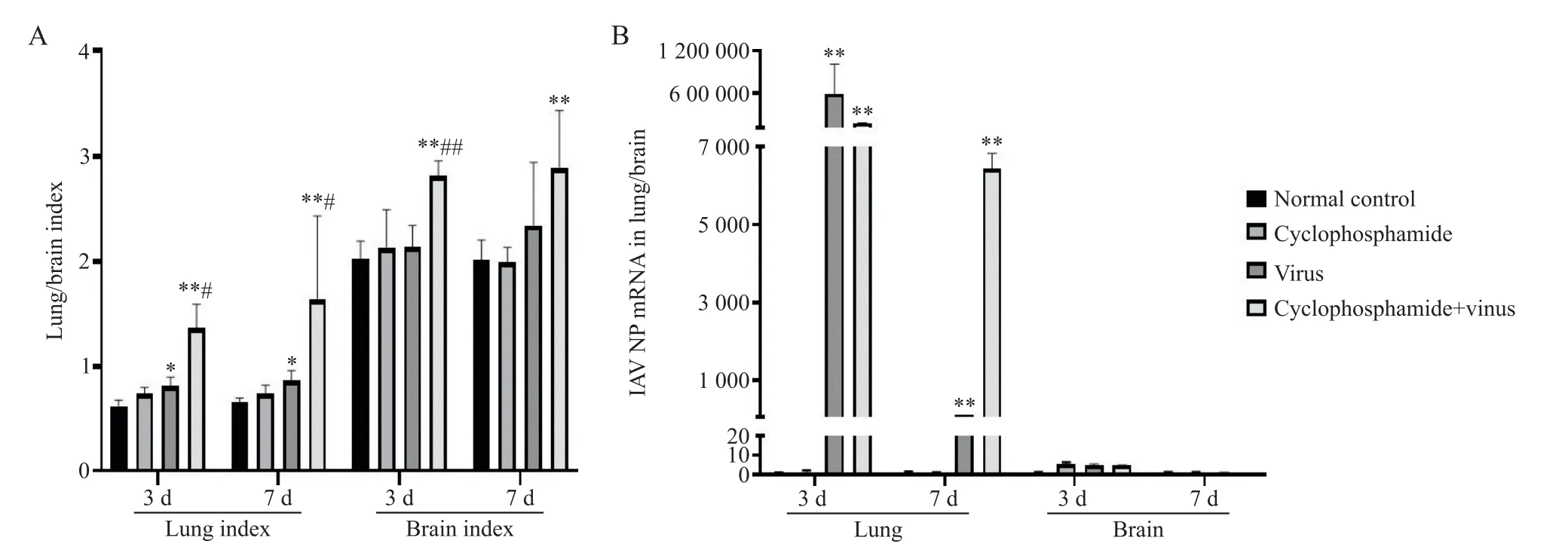
Figure 1.Comparison of lung/brain index and viral load in lung/brain tissues of mice in each group.A:lung/brain index(n=8);B:viral load in lung/brain tissues(n=3).Mean±SD.*P<0.05,**P<0.01 vs normal control group;#P<0.05,##P<0.01 vs virus group.圖1 各組小鼠肺、腦指數及肺、腦組織病毒載量比較
2 各組小鼠腦組織病理變化
正常對照組和環磷酰胺組小鼠海馬和皮質細胞形態、排列正常;感染病毒后3 d,病毒組小鼠海馬細胞形態、排列正常,皮質水腫;環磷酰胺+病毒組海馬大量神經細胞固縮壞死,皮質水腫;感染病毒后7 d,病毒組小鼠皮質水腫消失,環磷酰胺+病毒組小鼠仍見海馬大量神經細胞固縮壞死,皮質水腫。見圖2。
3 各組小鼠腦組織勻漿中IL-6和TNF-α含量水平比較
感染后3 d,病毒組小鼠腦組織勻漿中IL-6含量水平較正常對照組顯著升高(P<0.05);環磷酰胺+病毒組小鼠腦組織勻漿中IL-6含量水平較正常對照組顯著升高(P<0.05),TNF-α含量水平較正常對照組及病毒組顯著升高(P<0.01)。感染后7 d,環磷酰胺+病毒組小鼠腦組織勻漿中IL-6和TNF-α含量水平較正常對照組及病毒組顯著升高(P<0.05)。見表1。

表1 各組小鼠腦組織勻漿中IL-6、TNF-α含量水平Table 1.Levels of IL-6 and TNF-αin brain tissue homogenates(ng/g.Mean±SD.n=3)
4 各組小鼠腦組織中IL-6、TNF-α和ZO-1蛋白表達水平的比較
4.1 各組小鼠腦組織中IL-6蛋白表達水平的比較感染后3 d,與正常對照組比較,環磷酰胺+病毒組小鼠海馬和皮質中IL-6蛋白表達水平均顯著升高(P<0.05);與環磷酰胺組比較,環磷酰胺+病毒組小鼠皮質中IL-6蛋白表達水平顯著升高(P<0.01)。感染后7 d,病毒組小鼠海馬中IL-6蛋白表達水平較正常對照組及環磷酰胺組顯著升高(P<0.01);環磷酰胺+病毒組小鼠海馬和皮質中IL-6蛋白表達水平較正常對照組和病毒組均顯著升高(P<0.01)。見圖3。

Figure 2.Pathological changes of brain tissue of mice in each group(HE staining,×200).The red arrow in the figure indicates necrotic pyknosis nerve cells,and the blue arrow indicates edema.圖2 各組小鼠腦組織病理變化
4.2 各組小鼠腦組織中TNF-α蛋白表達水平比較感染后3、7 d,環磷酰胺+病毒組小鼠海馬和皮質中TNF-α蛋白表達水平較正常對照組、環磷酰胺組及病毒組顯著升高(P<0.05)。見圖4。
4.3 各組小鼠腦組織中ZO-1蛋白表達水平比較感染后3、7 d,病毒組、環磷酰胺+病毒組小鼠海馬及皮質中ZO-1蛋白表達水平較正常對照組及環磷酰胺組顯著降低(P<0.05)。環磷酰胺+病毒組小鼠感染后3 d的海馬、感染后7 d的皮質中ZO-1蛋白表達水平較病毒組顯著降低(P<0.05)。見圖5。

Figure 3.IL-6 protein expression in brain tissue of mice in each group(IHC,×400).Mean±SD.n=3.*P<0.05,**P<0.01 vs normal control group;△△P<0.01 vs cyclophosphamide group;##P<0.01 vs cyclophosphamide+virus group.圖3 各組小鼠腦組織中IL-6蛋白表達
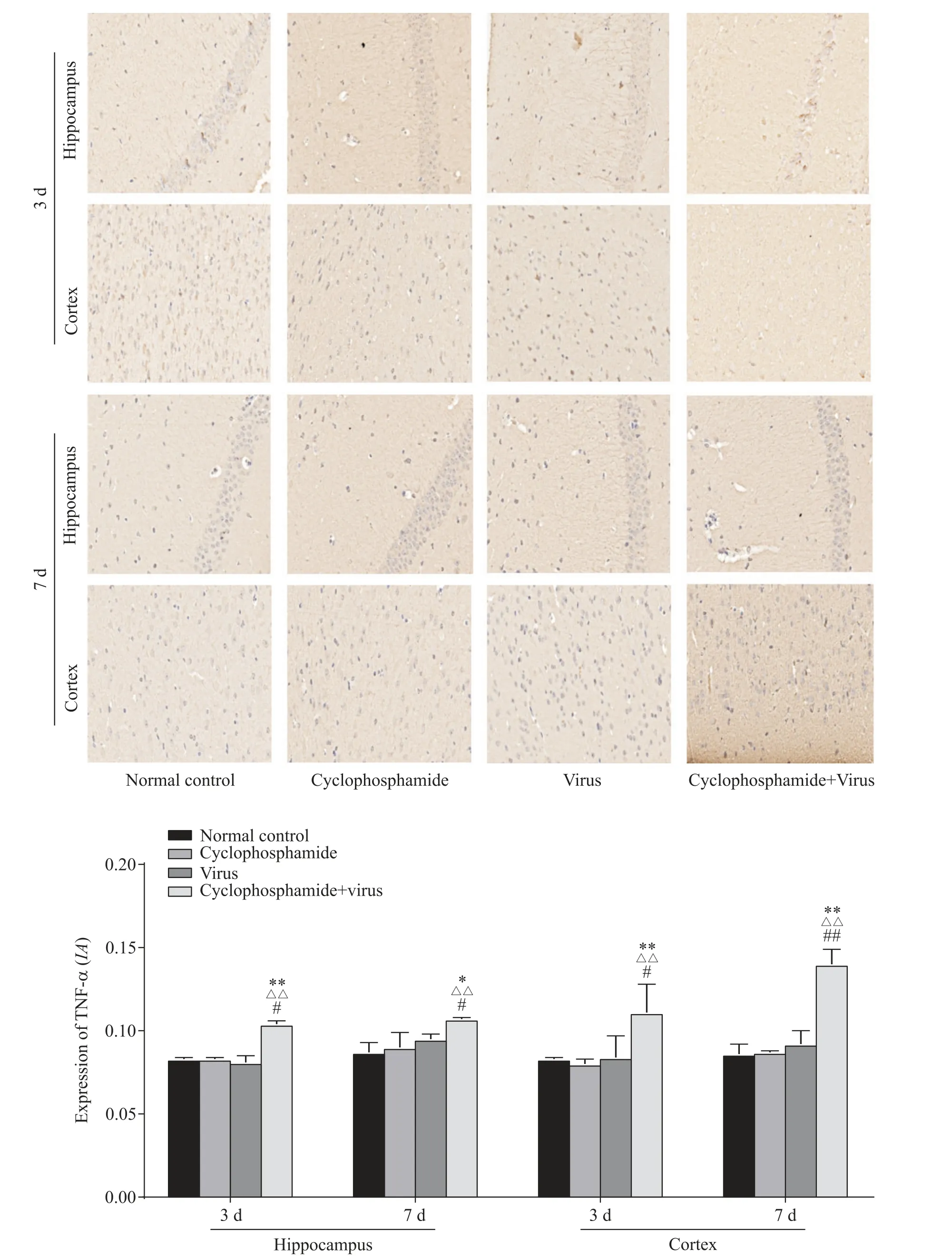
Figure 4.TNF-αprotein expression in brain tissue of mice in each group(IHC,×400).Mean±SD.n=3.*P<0.05,**P<0.01 vs normal control group;△△P<0.01 vs cyclophosphamide group;#P<0.05,##P<0.01 vs cyclophosphamide+virus group.圖4 各組小鼠腦組織中TNF-α蛋白表達

Figure 5.ZO-1 protein expression in brain tissue of mice in each group(IHC,×400).Mean±SD.n=3.*P<0.05,**P<0.01 vs normal control group;△P<0.05,△△P<0.01 vs cyclophosphamide group;#P<0.05,##P<0.01 vs cyclophosphamide+virus group.圖5 各組小鼠腦組織中ZO-1蛋白表達
討 論
本研究在腹腔注射環磷酰胺(75 mg/kg,1次)后24 h,經鼻腔接種流感病毒液所建立的流感病毒感染模型小鼠肺指數顯著增加,感染后7 d小鼠肺組織中病毒載量水平顯著高于病毒組,說明感染流感病毒后,免疫抑制小鼠肺部損傷較正常小鼠嚴重,病程延長;小鼠腦指數顯著增加,腦組織除出現皮質水腫外,海馬組織也出現大量神經細胞固縮壞死,且感染后皮質水腫無自愈傾向,表明環磷酰胺的應用有利于小鼠流感相關性腦病的發生。
多項研究[4-9]表明:流感相關性腦病的發病機制與血漿和腦脊液中高水平的細胞因子(IL-6、IL-10和TNF-α)有關,支持急性“細胞因子風暴”的主要假說。即機體感染流感病毒后過度的促炎細胞因子與趨化因子引發中樞神經系統的免疫病理損傷,是發生流感相關性腦病的免疫機制之一[10]。本研究表明:環磷酰胺腹腔注射,再感染A型流感病毒后小鼠腦組織勻漿中IL-6和TNF-α含量水平及海馬和皮質中IL-6和TNF-α蛋白表達均顯著升高。說明經環磷酰胺處理后的小鼠感染流感病毒后,腦組織中炎癥因子IL-6和TNF-α均釋放增加,且炎癥因子含量水平與腦組織損傷密切相關。本課題組前期研究證實流感病毒感染后,機體肺部產生炎癥的同時,肺組織及腦組織中JAK1-STAT1信號通路激活及下游炎癥因子表達水平失衡[11],這可能又是流感病毒感染后發生“細胞因子風暴”的分子機制之一。
由于流感相關性腦病常發生于兒童,兒童較成人血腦屏障發育不完善,流感病毒破壞血腦屏障導致中樞神經系統功能失常也被認為是流感相關腦炎的可能發病機制。孫桂蓮[12]等通過檢測流感病毒相關腦病患者血清中基質金屬蛋白酶(matrix metalloproteinases,MMPs)水平發現MMPs可能參與了流感腦病的發病。在炎性因子作用下,MMPs可通過水解蛋白作用破壞血腦屏障基底膜及內皮細胞之間的緊密連接(tight junction,TJ)[13]。血腦屏障(blood-brain barrier,BBB)是一種多細胞血管結構,將中樞神經系統與外周血循環分隔開來,血管內皮細胞及細胞間的TJ是BBB的重要構成部分[14]。BBB的功能基礎是內皮細胞間的TJ蛋白,通過TJ蛋白的變化可發揮閘門及柵欄樣的調控作用。ZO-1是TJ蛋白之一,它的表達水平能夠很好地反應血腦屏障結構的完整性[15]。本研究發現,環磷酰胺聯合流感病毒應用于小鼠時,與單用病毒比較,小鼠腦組織中ZO-1蛋白水平顯著下降,說明小鼠血腦屏障的完整性遭到一定程度的破環,有利于流感相關性腦病的發生。

