基于Q-marker等多維度評價延胡索配方顆粒的質量
張 純, 范曉良, 陳葉青, 李 雪, 金佩芬
(1.嘉興市食品藥品與產品質量檢驗檢測院中藥室,浙江 嘉興 314001;2.浙江中醫藥大學附屬嘉興中醫院臨床藥學室,浙江 嘉興 314001;3.嘉興學院醫學院,浙江 嘉興 314001)
延胡索為罌粟科植物延胡索CorydalisyanhusuoW. T. Wang 的干燥塊莖,功效活血散瘀、利氣止痛[1],其止痛的藥效物質基礎主要為生物堿[2],并具有鎮靜催眠、抗藥物成癮、抗炎、抗缺血、抗潰瘍、抗抑郁等作用[3-8]。延胡索配方顆粒是在原飲片基礎上直接發展而來的中藥配方顆粒,市場需求量巨大,但目前該制劑國家標準中的含量測定指標僅為延胡索乙素[1],故對其藥效關聯性較強物質成分群進行質量控制具有重要意義。
2016年,劉昌孝院士首次提出“中藥質量標志物”(Q-marker)的概念[9-10],通過對延胡索系統研究,確定延胡索乙素、延胡索甲素、黃連堿、巴馬汀、去氫延胡索甲素、D-四氫藥根堿、原阿片堿作為其Q-marker[11]。本實驗在此基礎上,結合水分、溶化性、浸出物、TLC鑒別、聚類分析、指紋圖譜等對延胡索配方顆粒進行多維度評價,以期為該制劑質量控制及標準提升提供參考。
1 材料
1.1 儀器 Waters e2695-2998高效液相色譜系統,配置DAD檢測器(美國Waters公司);XS205DU電子天平(瑞士Mettler-Toledo公司);Mili-Q Reference超純水系統(美國Millipore公司);C300真空泵(美國圣斯特公司);KQ-800KDE高功率數控超聲波清洗器(昆山市超聲儀器有限公司);DGG-9053A電熱恒溫鼓風干燥箱(上海森信實驗儀器有限公司);暗箱式紫外透射儀(上海寶山顧村電光儀器廠);薄層色譜板(德國默克公司)。
1.2 試劑與藥物D-四氫藥根堿(批號AF200527-07,純度98%)、黃連堿(批號112026-201802,純度94%)、延胡索甲素(批號AF200519-10,純度98%)、去氫延胡索甲素(批號AF200415-17,純度98%)對照品均購自湖南旭瑞中領生物科技有限公司;原阿片堿(批號110853-201805,純度99.6%)、延胡索乙素(批號110726-201819,純度99.8%)、鹽酸巴馬汀(批號110732-201309,純度95.1%)對照品均購自中國食品藥品檢定研究院。18批延胡索配方顆粒源于各廠家或醫療機構,具體信息見表1。甲醇、乙腈、磷酸為色譜純;其他試劑均為分析純;水為自制超純水。

表1 樣品信息
2 方法與結果
2.1 水分、溶化性測定 按照2020年版《中國藥典》四部通則0832水分測定第二法(烘干法)及通則0104溶化性檢查相關規定進行測定,測得18批樣品中水分為2.59%~6.24%,均符合藥典要求(水分不大于8.0%),并且均無焦屑等異物。
2.2 浸出物測定 本品研細,取約2 g,精密稱定,精密加入100 mL乙醇,按照2020年版《中國藥典》四部通則2201醇溶性浸出物測定法項下的熱浸法進行測定,測得18批樣品中浸出物為10.39%~27.70%,符合試點統一標準(浸出物不少于10.0%)。
2.3 TLC定性鑒別 取本品0.5 g,研細,加70%甲醇50 mL,超聲處理30 min,濾過,濾液蒸干,殘渣加10 mL水溶解,濃氨試液調pH至堿性,乙醚振搖提取3次,每次10 mL,合并乙醚液,蒸干,殘渣加1 mL甲醇溶解,作為供試品溶液;取延胡索對照藥材1 g,同法制成對照藥材溶液;取延胡索乙素對照品適量,甲醇制成每1 mL含0.5 mg該成分的對照品溶液。以甲苯-丙酮(9∶1)為展開劑二次展開,取出晾干后碘蒸氣顯色,在365 nm紫外燈下檢視,結果見圖1。由此可知,主斑點清晰,分離度良好,與對照藥材、對照品在相同位置處顯示相同顏色的斑點。
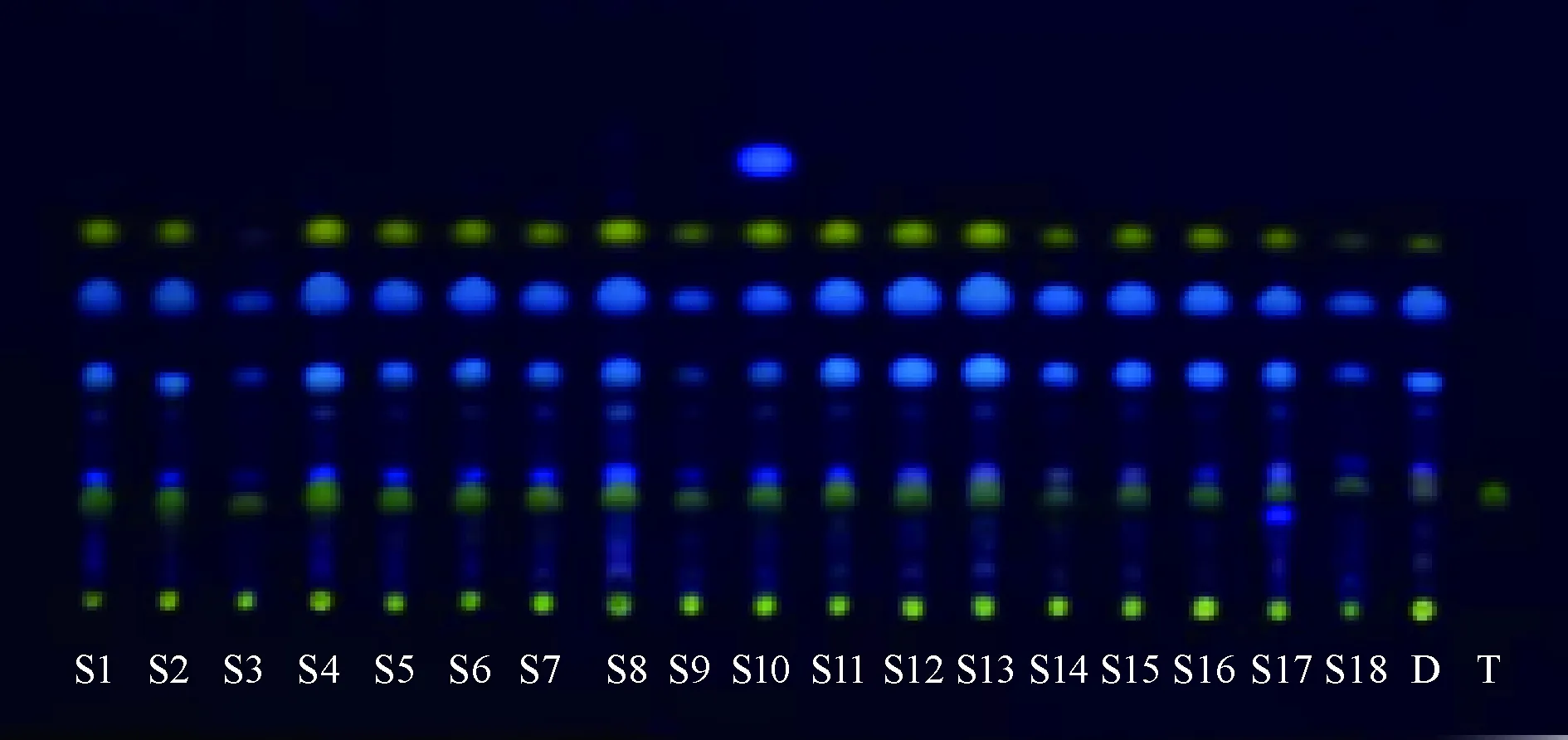
注:D為延胡索,T為延胡索乙素對照品。
2.4 HPLC指紋圖譜建立
2.4.1 色譜條件 Agilent ZORBAX SB-C18色譜柱(4.6 mm×250 mm,5 μm);流動相乙腈(A)-0.1%磷酸(含0.08%三乙胺)(B),梯度洗脫(0~10 min,90%~87%B;10~65 min,87%~75%B;65~66 min,75%~15%B;66~80 min,15%B);體積流量1.0 mL/min;柱溫30 ℃;檢測波長280 nm;進樣量10 μL。
2.4.2 供試品溶液制備 取本品適量,研細,精密稱取粉末0.2 g,置于150 mL錐形瓶中,精密加入70%甲醇25 mL,密塞,稱定質量,在30 ℃恒溫下超聲(250 W、40 kHz)處理25 min,放冷,70%甲醇補足減失的質量,搖勻,過0.22 μm微孔濾膜,即得。
2.4.3 方法學考察 以6號峰(延胡索乙素)為參照(S),取供試品溶液適量,在“2.4.1”項色譜條件下進樣測定6次,測得各共有峰相對保留時間RSD<0.50%,相對峰面積RSD<2.5%,表明儀器精密度良好。取本品適量,按“2.4.2”項下方法平行制備6份供試品溶液,在“2.4.1”項色譜條件下進樣測定,測得各共有峰相對保留時間RSD<0.50%,相對峰面積RSD<3.0%,表明該方法重復性良好。取供試品溶液適量,于0、3、6、12、24、36、48 h在“2.4.1”項色譜條件下進樣測定,測得各共有峰相對保留時間RSD<0.50%,相對峰面積RSD<2.0%,表明溶液在48 h內穩定性良好。
2.4.4 圖譜生成 取18批樣品,按“2.4.2”項下方法制備供試品溶液,在“2.4.1”項色譜條件下進樣測定,將數據導入“中藥色譜指紋圖譜相似度評價系統(2012版)”,以S1為參照圖譜,中位數法生成對照圖譜,設定時間窗寬度為0.5,采用多點校正,見圖2,發現有15個共有峰,相似度見表2,可知在0.981~1.000范圍內,符合指紋圖譜要求。以6號峰(延胡索乙素)為參照(S),測得各共有峰相對保留時間RSD為0.12%~0.97%,相對峰面積RSD為23.3%~51.5%,表明不同廠家、批次樣品成分組成一致,但在含量上存在差異。

圖2 18批樣品HPLC指紋圖譜

表2 18批樣品相似度
2.4.5 聚類分析 以共有峰峰面積與稱樣量比值為變量,采用組間連接法,以平方歐式距離為測量度進行聚類分析[12-14],結果見圖3。由此可知,各批樣品聚為4類,其中S1~S2、S3~S4、S12~S17各自聚類,而其余廠家樣品較分散。

圖3 18批樣品聚類分析樹狀圖
2.5 含量測定
2.5.1 對照品溶液制備 取D-四氫藥根堿、原阿片堿、延胡索乙素、黃連堿、延胡索甲素、鹽酸巴馬汀、去氫延胡索甲素對照品適量,70%甲醇制成質量濃度分別為0.084 4、0.168 5、0.960 1、0.266 7、0.247 9、0.133 6、0.699 4 mg/mL的溶液,即得。
2.5.2 供試品、陰性樣品溶液制備 同“2.4.2”項。
2.5.3 色譜條件 同“2.4.1”項,色譜圖見圖4。
2.5.4 線性關系考察 將對照品溶液稀釋成系列質量濃度,在“2.4.1”項色譜條件下進樣測定。以對照品質量濃度為橫坐標(X),峰面積為縱坐標(Y)進行回歸,并以信噪比(S/N)10∶1為定量限,3∶1為檢測限,結果見表3,可知在各自范圍內線性關系良好。

1.D-四氫藥根堿 2.原阿片堿 3.延胡索乙素 4.黃連堿 5.延胡索甲素 6.鹽酸巴馬汀 7.去氫延胡索甲素1.D-tetrahydrojatrorrhizine 2.protopine 3.tetrahydropalmatine4.coptisine 5.corydaline 6.palmatine 7.dehydrocorydaline

表3 各成分線性關系
2.5.5 方法學考察
2.5.5.1 精密度試驗 精密吸取對照品溶液適量,在“2.4.1”項色譜條件下進樣測定6次,測得D-四氫藥根堿、原阿片堿、延胡索乙素、黃連堿、延胡索甲素、鹽酸巴馬汀、去氫延胡索甲素峰面積RSD分別為1.89%、1.81%、1.62%、1.90%、1.63%、1.71%、1.87%,表明儀器精密度良好。
2.5.5.2 重復性試驗 取本品(批號1909001C)適量,按“2.4.2”項下方法平行制備6份供試品溶液,在“2.4.1”項色譜條件下進樣測定,測得D-四氫藥根堿、原阿片堿、延胡索乙素、黃連堿、延胡索甲素、鹽酸巴馬汀、去氫延胡索甲素含量RSD分別為0.84%、1.36%、1.08%、0.98%、0.99%、1.38%、1.83%,表明該方法重復性良好。
2.5.5.3 穩定性試驗 取供試品溶液(批號1909001C)適量,于0、3、6、12、24、36、48 h在“2.4.1”項色譜條件下進樣測定,測得D-四氫藥根堿、原阿片堿、延胡索乙素、黃連堿、延胡索甲素、鹽酸巴馬汀、去氫延胡索甲素峰面積RSD分別為1.14%、1.02%、0.79%、1.45%、1.68%、1.41%、1.10%,表明溶液在48 h內穩定性良好。
2.5.5.4 加樣回收率試驗 精密稱取各成分含量已知的本品(批號1909001C)6份,每份0.1 g,置于150 mL錐形瓶中,精密加入對照品溶液1 mL,按 “2.4.2”項下方法平行制備6份供試品溶液,在“2.4.1”項色譜條件下進樣測定,計算回收率。結果,D-四氫藥根堿、原阿片堿、延胡索乙素、黃連堿、延胡索甲素、鹽酸巴馬汀、去氫延胡索甲素平均加樣回收率分別為97.81%、101.53%、99.71%、102.33%、98.97%、101.63%、100.85%,RSD分別為1.59%、1.06%、0.83%、0.95%、1.38%、1.88%、0.89%。
2.5.6 樣品含量測定 取18批樣品,按“2.4.2”項下方法制備供試品溶液,在“2.4.1”項色譜條件下進樣測定,計算含量,結果見表4。

表4 各成分含量測定結果(mg/g)
3 討論
目前,雖然國家先后頒布了近200種中藥配方顆粒的質量標準[15-16],但其質量和標準問題仍是未來急需應對的兩大挑戰[17]。《中藥配方顆粒質量控制與標準制定技術要求》規定,中藥配方顆粒除符合2020年版《中國藥典》對顆粒劑的通則要求外,還應具備湯劑基本屬性。Q-marker作為反映中藥安全性和有效性的標識性物質[18],完全符合上述理念,可有效反映從湯劑到配方顆粒藥效物質成分的傳遞,可用于中藥配方顆粒的質量評價。
本實驗發現,18批延胡索配方顆粒水分、溶化性、浸出物檢測結果均符合2020年版《中國藥典》及配方顆粒試點統一標準的規定;TLC鑒別方法靈敏度高,分離度好;各批樣品相似度較好,在主要成分組成上具有較高的一致性,但其含量存在一定差異,特別是7個Q-marker,其中來源于廣東某公司生產的6批樣品較小,在聚類分析中也歸為一類,表明其質量較穩定,而部分廠家樣品聚類較分散,需引起關注。
4 結論
本實驗對延胡索配方顆粒質量進行多維度全面評價,所建立的方法準確可靠,簡便可行,可為該制劑質量控制提供參考依據。

