腹炎消通過調控Notch2/Hes-1通路對重癥胰腺炎大鼠急性肺損傷的影響
陳玉梅, 楊 靜, 蘇 淼, 董 梁, 王麗華
(衡水市人民醫院消化內科,河北 衡水 053000)
重癥急性胰腺炎是一種嚴重的胰腺炎性疾病,可以從胰腺的局部損傷發展為全身性炎癥反應綜合征和多器官功能障礙綜合征[1]。急性肺損傷是重癥急性胰腺炎最嚴重的并發癥之一,可導致急性呼吸窘迫綜合征的發展并導致高死亡率[2]。目前,重癥急性胰腺炎相關急性肺損傷的主要治療方法是藥物治療,但治療藥物有限,效果不令人滿意,故開發新的有效治療藥物至關重要。根據重癥急性胰腺炎的發病部位及臨床特點,中醫將其歸屬于“脾心痛”“胰癉”范疇,其基本病機為腑氣不通,瘀毒內蘊[3]。中醫藥治療急性胰腺炎是我國臨床特色,不少中藥方劑及其提取物具有治療重癥急性胰腺炎,并減輕與其相關急性肺損傷的功效[4-5]。腹炎消由大黃、連翹、蒲公英、銀花、厚樸、炒萊菔子、桃仁、紅花、敗醬草等組成,具有通里攻下、清熱解毒、行氣消積、消腫散癰的功效,但其對重癥急性胰腺炎及其并發癥急性肺損傷是否具有保護作用尚不清楚。因此,本研究通過建立重癥急性胰腺炎大鼠模型,觀察腹炎消對其并發癥急性肺損傷的影響并初步探討其機制,為重癥急性胰腺炎及其并發癥的治療提供理論依據。
1 材料
1.1 動物 SPF級SD大鼠76只,雄性,體質量(220±20)g,購自河北伊維沃生物科技有限公司,實驗動物生產許可證SCXK(冀)2020-002。飼養環境為相對濕度45%~55%,溫度(20±2)℃,12 h/12 h光照/黑暗,自由獲取食物和水。本研究中涉及活體動物的所有實驗程序均經衡水市人民醫院倫理委員會批準,并嚴格遵守《實驗動物的護理和使用指南》的指導原則進行。
1.2 藥物制備 腹炎消由蒲公英30 g,銀花30 g,厚樸12 g,炒萊菔子30 g,桃仁12 g,連翹12 g,薏苡仁30 g,甘草6 g,敗醬草30 g,元胡15 g,白芍15 g,姜半夏10 g,黃芩15 g,柴胡15 g,生大黃15 g(后下)組成,上述藥材經衡水市人民醫院趙衛國主任中醫師鑒定為正品,加入8倍量的水充分浸泡30 min,煎煮40 min,過濾藥液,藥渣再加入6倍量的水繼續煎煮40 min,過濾藥液,合并2次藥液,煎煮濃縮至1 mL,相當于生藥2 g/mL。
1.3 試劑 3.5%牛磺膽酸鈉、DAPT(γ-分泌酶抑制劑,可抑制Notch信號通路)(貨號T7515、D5942)購自美國Sigma-Aldrich公司;HE染色試劑、RIPA裂解液、BCA試劑盒(貨號C0105、P0013B、P0010)均購自上海碧云天生物技術有限公司;大鼠白介素-6(interleukin-6,IL-6)、腫瘤壞死因子-α(tumor necrosis factor-α,TNF-α)、細胞間黏附分子-1(intercellular adhesion molecule-1,ICAM-1)ELISA檢測試劑盒(貨號RA20607、RA20035、RA20614)均購自武漢貝茵萊生物科技有限公司;淀粉酶(amylase,AMY)檢測試劑盒(貨號C016-1-1)購自南京建成生物工程研究所;RT-qPCR引物由上海吉瑪制藥技術有限公司設計和合成;兔源一抗Hes家族BHLH轉錄因子1(Hes family BHLH transcription factor 1,Hes-1)、Notch2、β-actin、HRP標記的山羊抗兔IgG(H+L)(貨號PA5-28802、PA5-87455、MA5-32479、65-6120)均購自美國Thermo Fisher Scientific公司。
1.4 儀器 ABL90 FLEX血氣分析儀(丹麥Radiometer公司);iMark680多功能酶標儀、蛋白轉膜裝置(美國Bio-Rad公司);BX51電動顯微鏡(日本Olympus公司)。
2 方法
2.1 模型建立 大鼠適應性飼養1周后,隨機選取12只作為假手術組,其余64只采用3.5%牛磺膽酸鈉誘導重癥急性胰腺炎[6-7]。大鼠術前禁食12 h,不禁水,用2%戊巴比妥鈉(40 mg/kg)腹腔注射麻醉后,暴露腹腔,在腹部切開1個切口,將胰十二指腸分離到十二指腸內側后,用金屬夾夾住胰膽管,將4.5號針逆行刺進距十二指腸壁2 mm的胰膽管,然后用無創金屬夾夾住十二指腸側的胰管,使用微量輸液泵將3.5%牛磺膽酸鈉逆行注射入胰膽管(1 mL/kg,6 mL/h)誘導大鼠重癥急性胰腺炎,觀察大鼠胰腺變化,當確認胰腺囊膜下出現明顯水腫和出血時,則說明造模成功;假手術組大鼠以相同的方式注射等量生理鹽水。術后縫合大鼠腹部,未成功造模大鼠有4只,模型建立成功率為93.75%。
2.2 分組及給藥 將造模成功的60只大鼠隨機分為模型組,DAPT組,腹炎消低、高劑量組,腹炎消+DAPT組,每組12只。術后12 h,DAPT組大鼠腹腔注射5 mg/kg DAPT(溶于生理鹽水)[8],腹炎消低、高劑量組大鼠灌胃給予17.8、35.6 g/kg腹炎消水煎液(相當于臨床劑量1、2倍),腹炎消+DAPT組大鼠腹腔注射5 mg/kg DAPT 30 min后,灌胃給予35.6 g/kg腹炎消水煎液,24 h后到達實驗終點。
2.3 大鼠肺功能檢測 大鼠麻醉后腹主動脈取血,立即使用血氣分析儀測定動脈血中氧分壓(PaO2)和二氧化碳分壓(PaCO2),計算氧合指數(PaO2/FiO2)。本實驗大鼠吸入空氣(氧氣體積分數21%),故吸入氧氣濃度(FiO2)為0.21。
2.4 血清AMY活性檢測 全血1 500 r/min離心10 min,分離得到血清,按照試劑盒說明書,采用碘-淀粉比色法檢測血清AMY活性。
2.5 肺組織濕/干質量比檢測 取大鼠右肺中葉,生理鹽水沖洗殘留血跡后,濾紙吸干表面水分,稱定質量,獲得肺濕質量,然后將肺組織在60 ℃下烘烤48 h后稱定質量,獲得干質量,計算濕/干質量比。
2.6 ELISA法檢測肺組織炎性因子水平 將剩余右肺組織,以1∶9比例加入預冷生理鹽水,制備10%組織勻漿,研磨后離心取上清液,按照ELISA試劑盒說明書檢測勻漿液中TNF-α、IL-6、ICAM-1水平。
2.7 HE染色觀察胰腺、肺組織病理學變化 取出大鼠胰腺和肺組織,將左側肺組織分為兩部分,一部分放入凍存管中,液氮速凍后,移至-80 ℃冰箱保存,另一部分肺組織和胰腺組織于4%多聚甲醛中固定,石蠟包埋,切片。組織切片經二甲苯脫蠟、梯度乙醇脫水后,進行蘇木精-伊紅(HE)染色,光學顯微鏡下觀察胰腺和肺組織的病理學變化。肺組織病理評分標準為(1)肺泡腔內是否有出血、充血;(2)肺泡壁或者血管壁中是否有炎性細胞聚集;(3)肺泡壁是否有明顯增厚,上述每一項按照損傷的嚴重程度分為0分,無以上病理損傷;1分,局部有輕微損傷;2分,有中等損傷且局部顯著;3分,有嚴重且廣泛的損傷。胰腺組織病理評分標準見表1。

表1 胰腺組織病理評分標準
2.8 免疫組化法檢測肺組織Notch2、Hes-1蛋白表達 取“2.7”項下石蠟切片,使用微波在檸檬酸鈉緩沖液中進行抗原修復,3% H2O2封閉非特異性抗體結合位點,滴加一抗Notch2、Hes-1(1∶200)于4 ℃孵育過夜,洗去一抗后與HRP標記的山羊抗兔IgG于37 ℃孵育1 h,DAB顯色,蘇木精復染細胞核,在顯微鏡下觀察和拍照。棕黃色或棕褐色沉積為陽性表達,使用Image-Pro Plus 6.0軟件進行光密度(OD)值分析,每張切片選擇3個不同區域,結果取平均值。
2.9 RT-qPCR法檢測肺組織Notch2、Hes-1 mRNA表達 取-80 ℃冰箱保存的肺組織,使用TRIzol試劑提取總RNA,分光光度計測定總RNA濃度,使用PrimeScriptTMRT試劑盒將RNA反轉錄為互補DNA(cDNA),根據擴增試劑盒的說明,進行RT-qPCR反應。反應體系為Premix Ex TaqTM(2×)10 μL、正反向引物各0.8 μL,cDNA(200 ng/μL)2 μL,ddH2O 6.4 μL。反應條件為95 ℃預變性1 min;95 ℃變性18 s,60 ℃退火55 s,72 ℃延伸2 min,共40個循環。實驗重復3次。采用2-ΔΔCT法,β-actin為內參,計算Notch2、Hes-1 mRNA相對表達。引物序列見表2。

表2 引物序列
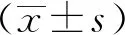
3 結果
3.1 腹炎消對重癥急性胰腺炎大鼠肺功能的影響 與假手術組比較,模型組大鼠PaO2、PaO2/FiO2降低(P<0.05),PaCO2升高(P<0.05);與模型組比較,DAPT組和腹炎消各劑量組大鼠PaO2、PaO2/FiO2升高(P<0.05),PaCO2降低(P<0.05);與DAPT組和腹炎消高劑量組比較,腹炎消+DAPT組PaO2、PaO2/FiO2升高(P<0.05),PaCO2降低(P<0.05),見表3。

表3 腹炎消對大鼠肺功能的影響
3.2 腹炎消對重癥急性胰腺炎大鼠血清AMY活性和肺組織濕/干質量比的影響 與假手術組比較,模型組大鼠血清AMY活性、肺組織濕/干質量比升高(P<0.05);與模型組比較,DAPT組和腹炎消各劑量組大鼠血清AMY活性、肺組織濕/干質量比降低(P<0.05);與DAPT組和腹炎消高劑量組比較,腹炎消+DAPT組大鼠血清AMY活性、肺組織濕/干質量比降低(P<0.05),見表4。

表4 腹炎消對大鼠血清AMY活性和肺組織濕/干質量比的影響
3.3 腹炎消對重癥急性胰腺炎大鼠肺組織TNF-α、IL-6、ICAM-1水平的影響 與假手術組比較,模型組大鼠肺組織勻漿液中TNF-α、IL-6、ICAM-1水平升高(P<0.05);與模型組比較,DAPT組和腹炎消各劑量組大鼠肺組織TNF-α、IL-6、ICAM-1水平降低(P<0.05);與DAPT組和腹炎消高劑量組比較,腹炎消+DAPT組大鼠肺組織TNF-α、IL-6、ICAM-1水平降低(P<0.05),見表5。

表5 腹炎消對大鼠肺組織TNF-α、IL-6、ICAM-1水平的影響
3.4 腹炎消對重癥急性胰腺炎大鼠胰腺、肺組織病理學變化的影響 假手術組大鼠胰腺和肺組織沒有明顯的病理形態學變化;模型組大鼠胰腺組織細胞壞死、胞質空泡、水腫嚴重、炎性細胞浸潤,肺組織有炎性細胞浸潤,出血,肺泡間隔增厚,與假手術組比較,胰腺和肺組織損傷病理評分增加(P<0.05);與模型組比較,DAPT組和腹炎消各劑量組大鼠胰腺和肺組織上述病理損傷減輕,炎性細胞浸潤減少,胰腺和肺組織損傷病理評分降低(P<0.05);與DAPT組和腹炎消高劑量組比較,腹炎消+DAPT組大鼠胰腺和肺組織上述病理損傷進一步減輕,胰腺和肺組織損傷病理評分降低(P<0.05),見圖1、表6。

表6 腹炎消對大鼠胰腺和肺組織病理評分的影響(分,
3.5 腹炎消對重癥急性胰腺炎大鼠肺組織Notch2、Hes-1蛋白表達的影響 與假手術組比較,模型組大鼠肺組織Notch2、Hes-1蛋白表達升高(P<0.05);與模型組比較,DAPT組和腹炎消各劑量組大鼠肺組織Notch2、Hes-1蛋白表達降低(P<0.05);與DAPT組和腹炎消高劑量組比較,腹炎消+DAPT組大鼠肺組織Notch2、Hes-1蛋白表達降低(P<0.05),見圖2、表7。

表7 腹炎消對大鼠肺組織Notch2、Hes-1蛋白表達的影響(OD值,
3.6 腹炎消對重癥急性胰腺炎大鼠肺組織Notch2、Hes-1 mRNA表達的影響 與假手術組比較,模型組大鼠肺組織Notch2、Hes-1 mRNA表達升高(P<0.05);與模型組比較,DAPT組和腹炎消低、高劑量組大鼠肺組織Notch2、Hes-1 mRNA表達降低(P<0.05);與DAPT組和腹炎消高劑量組比較,腹炎消+DAPT組大鼠肺組織Notch2 mRNA和Hes-1 mRNA表達降低(P<0.05),見表8。

表8 腹炎消對重癥急性胰腺炎大鼠肺組織Notch2、Hes-1 mRNA表達的影響
4 討論
近年來研究證明,中醫藥治療重癥急性胰腺炎可改善患者癥狀,減少并發癥,防止復發[9-10]。祖國醫學認為重癥急性胰腺炎應以“益氣養陰、清熱解毒、活血化瘀、通里攻下”為主要治則。腹炎消方中生大黃、連翹、蒲公英、銀花有清熱解毒、消腫散結、蕩滌腸胃的功效,且大黃可促進肺泡巨噬細胞凋亡,抑制炎癥因子分泌,減輕重癥急性胰腺炎大鼠肺部炎癥[11];大黃素可抑制NLRP3炎性小體活化,并抑制肺組織中NF-κB核積累,保護大鼠免受重癥急性胰腺炎相關肺損傷[12-13]。厚樸、炒萊菔子可行氣消積、消食除脹、降逆平喘;厚樸酚能減輕重癥急性胰腺炎大鼠急性肺損傷[5]。桃仁、紅花可活血祛瘀、活血通經、散瘀止痛,也是治療重癥急性胰腺炎方劑中的常用中藥[14];桃仁提取物對急性胰腺炎大鼠腸道屏障功能具有保護作用[15]。薏苡仁清熱利濕、排膿消腫,敗醬草清熱解毒、消癰排膿、祛瘀止痛,何俊余等[16]發現在大承氣湯的基礎上加薏苡仁、敗醬草治療急性胰腺炎,契合其邪實熱盛、腑氣不通、熱毒熾盛、血敗肉腐以致成癰的病機。因此,腹炎消可能是減輕與重癥急性胰腺炎相關急性肺損傷的有效方劑。
TNF-α、IL-6是重癥急性胰腺炎嚴重程度和預后評估的早期指標[13];ICAM-1在重癥急性胰腺炎相關急性肺損傷中表達升高,是預測嚴重病程的良好標志物,并且TNF-α與ICAM-1在急性肺損傷的病程中可相互促進[17-18];血清AMY活性是診斷急性胰腺炎的重要指標[19]。在本研究中,重癥急性胰腺炎模型大鼠PaO2、PaO2/FiO2降低,PaCO2,血清AMY活性,肺組織濕/干質量比,肺組織TNF-α、IL-6、ICAM-1水平升高,說明模型大鼠肺功能受損,肺組織出現嚴重炎癥反應。經腹炎消干預后,大鼠的血氧狀態明顯改善,血清AMY活性、肺組織濕/干質量比和肺組織炎性因子水平降低,且胰腺和肺組織水腫、炎性細胞浸潤和出血等病理損傷減輕,提示腹炎消可降低肺部炎癥反應,改善重癥急性胰腺炎大鼠肺功能。
Notch/Hes通路調控炎癥細胞的凋亡,Notch2廣泛表達于血管內皮細胞、肺泡上皮細胞和間質成纖維細胞,參與早期肺部發育[20];Hes-1是Notch2的效應子,在肢體缺血/再灌注誘發肺損傷后Notch2被激活,位于下游的Hes-1上調,刺激炎性細胞因子釋放,導致肺損傷[21]。有研究發現,在重癥急性胰腺炎早期肺組織中Notch/Hes1通路被激活,可導致下游IL-6、TNF-α上調,與急性肺損傷的進展密切相關[22]。Notch2的敲低對肺組織具有保護作用,DAPT可通過抑制Notch通路減輕LPS誘導的小鼠急性肺損傷[23-24]。本研究結果顯示,DAPT和腹炎消干預均可降低重癥急性胰腺炎大鼠肺組織Notch2和Hes-1表達,且兩者聯合應用后,Notch2和Hes-1表達較單獨使用降低,說明腹炎消可抑制Notch2/Hes-1通路的激活。
綜上所述,腹炎消可降低大鼠肺部炎癥,改善與重癥急性胰腺炎相關的急性肺損傷,其機制可能與抑制Notch2/Hes-1通路的激活有關。

