質量管理小組活動在規范中成藥生產企業藥品不良反應中醫術語MedDRA編碼中的實踐與探索
吳 穎 何桂英 劉雪梅 龍 平 彭良帥
太極集團四川綿陽制藥有限公司質管部,四川綿陽 621000
藥品不良反應(adverse drug reaction,ADR),是指合格藥品在正常用法用量下出現的與用藥目的無關的有害反應。《監管活動醫學詞典》(medical dictionary for regulatory activities,MedDRA) 是 在“人用藥品技術要求國際協調理事會”(International council for harmonisation of technical requirements for pharmaceuticals for human use,ICH)的主辦下編制的國際醫學術語集。MedDRA術語集是生物制藥監管領域被國際認可的醫學術語集,是藥事管理機構和醫藥行業數據互換和共享的標準化術語集。國家實行藥品不良反應報告制度,藥品生產企業(包括進口藥品的境外制藥廠商)、藥品經營企業、醫療機構應當按照規定報告所發現的藥品不良反應[1-3]。藥品不良反應報告涉及的MedDRA編碼就是將不良反應中的原始用語轉化為MedDRA術語集中統一的術語,編碼后不僅有助于監管機構及行業內各組織的交流溝通,還能提高不良反應數據分析的時效性和可用性。
MedDRA術語集的層級結構為五級結構[4],見圖1。層級結構提供了上下級別,上級術語是范圍較廣的一組術語,適用于其下級的每個術語。層級結構的各層級則代表本術語集內的各種縱向聯系。層級結構是實現靈活的數據檢索和清晰的數據表達的重要機制。五級結構為數據檢索提供了多種選擇,根據檢索特異度的要求可通過特異的或寬泛的組來檢索。低位語(lowest level term,LLT)的特異性最高。首選語(preferred term,PT)是對某種癥狀、體征、疾病、診斷、適應證、檢查、外科和內科操作、疾病史、社會史或家族史等單一醫學概念進行獨特表達的專用術語,PT必須定義明確,無歧義,特異性和描述性強且符合國際標準。
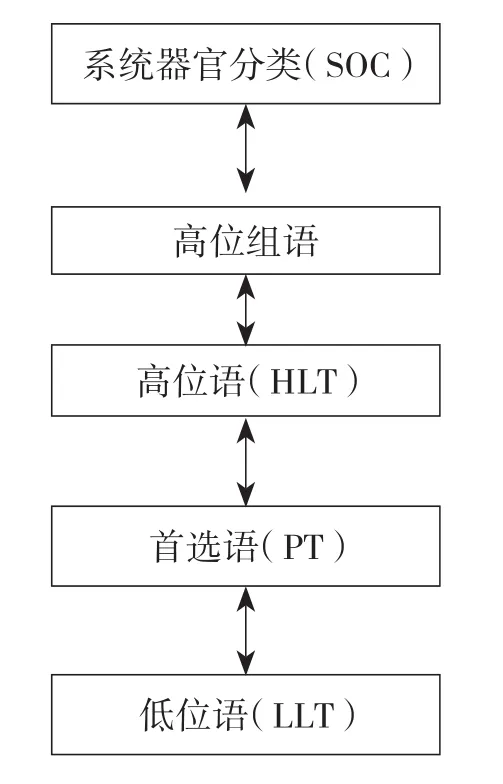
圖1 MedDRA術語集層級結構
國家藥品監督管理局要求藥品上市許可持有人自2022年7月1日起,在提交上市后藥品不良反應報告中使用MedDRA編碼[5]。然而,MedDRA術語集是基于西醫學體系構建而成,作為中成藥生產企業,在使用MedDRA術語對收集到的不良反應原始數據進行編碼時發現,不良反應原始數據中患者的“用藥原因”多是中醫術語,如“上火”“肝膽濕熱”“舒筋活血”“腰膝酸軟”“養血安神”“胸悶”“胸脅苦滿”等,在MedDRA術語集中無法找到對應的術語,無法進行編碼。編碼人員往往根據主觀理解在MedDRA術語集中選擇相近的術語進行編碼。然而,不同人員或同一人員在不同時間編碼的結果很容易不一致,甚至與患者原始的用藥原因偏差過大,導致公司不良反應數據編碼不規整、不統一,最終影響數據的分析和統計,甚至失去了藥品不良反應報告的意義[6]。例如“反胃”,有報告編碼為“惡心”(圖2),有報告編碼為“嘔吐”(圖3);如“納差”,有報告編碼為“食欲減退”(圖4),有報告編碼為“攝食量減少”(圖5)。

圖2 “反胃”MedDRA編碼1

圖3 “反胃”MedDRA編碼2

圖4 “納差”MedDRA編碼1

圖5 “納差”MedDRA編碼2
為使公司不良反應中醫術語MedDRA編碼更規整、統一,組建了融智創新質量管理小組(QC小組),通過開展QC創新活動,探索如何規范公司不良反應中醫術語MedDRA編碼。
1 設定目標及目標論證
1.1 設定目標
探索如何規范不良反應中醫術語MedDRA編碼,使編碼統一、規范,利于不良反應數據的統計和分析。
1.2 目標可行性分析
公司配備了具有豐富藥物警戒經驗的專業技術人才,人力資源充沛;購買安裝了藥物警戒系統,內嵌MedDRA編碼程序,并獲得了MedDRA的使用授權,信息化工具或系統均滿足條件;QC小組活動的開展促進了內生動力,提高了人員積極性,助于課題推動及目標達成。
2 提出方案并確定最佳方案
為達到設定目標,小組制訂出三種方案,見表1。經過調研、考察、討論,最終決定建立《中醫術語MedDRA編碼對照表》。

表1 方案對比及最佳方案確定表
3 對策制定
小組經過討論,按照5W1H原則制定了對策表。見表2。

表2 對策表
4 對策實施
4.1 數據規整及編碼
將每一例不良反應數據中患者的“用藥原因”(原始數據)進行規整,規整為意思相近的西醫術語,使用該術語在MedDRA術語集中檢索,選擇恰當的低位語(LLT)和首選語(PT),完成編碼。
4.2 建立對照表并對照編碼
建立《中醫術語MedDRA編碼對照表》,將已編碼的原始數據和首選語(PT)納入對照表中,隨著不良反應數據逐漸增多,按照4.1編碼后增加至對照表中,后續相同的“用藥原因”直接搜索對照表進行編碼。
4.3 《中醫術語MedDRA編碼對照表》
QC小組活動開展一年以來,《中醫術語MedDRA編碼對照表》共納入321條“用藥原因”MedDRA編碼對照信息,見表3。

表3 中醫術語MedDRA編碼對照表(部分)
5 效果檢查
5.1 目標完成情況
建立了《中醫術語MedDRA編碼對照表》,達到了使中醫術語MedDRA編碼統一、規范的目的,利于不良反應數據的統計和分析。對本次QC小組活動開展前后,部分不良反應“用藥原因”的MedDRA編碼結果進行了比較,結果見表4。

表4 QC小組活動開展前后MedDRA編碼結果比較
5.2 效益
通過本次QC小組活動的開展,公司不良反應中醫術語MedDRA編碼更統一、規范,此外,還明顯提高了編碼人員的編碼效率,降低了對固定人員MedDRA編碼能力的依賴性,同時還能加快新人對該業務的上手速度,即使未曾學過MedDRA編碼規則的人員,在編碼過程中使用《中醫術語MedDRA編碼對照表》進行搜索,選擇匹配的術語,可快速完成編碼。因此,本活動的實踐還間接降低了企業人力資源管理的成本。
6 討論
6.1 QC小組活動成效
經過小組人員的共同努力,成功實現了使不良反應中醫術語MedDRA編碼統一、規范的目標,未來將持續更新《中醫術語MedDRA編碼對照表》的內容。通過本次QC小組活動,將QC工具運用到日常工作中,工作質量和效率有所提高,創新能力得到了提升。
6.2 標準化
本次活動建立的對照表是針對每一例藥品不良反應的用藥原因,一例不良反應的用藥原因可能是一種,也可能是多種。后續計劃開展標準化工作,針對每一種用藥原因來統計數據,建立更專業、精準的中醫術語MedDRA編碼數據庫。
6.3 建議
MedDRA術語集目前已被各國廣泛應用,有數據統計截至2020年,MedDRA用戶已經覆蓋126個國家,MedDRA的語言版本就有14種[7]。陸續有國家開始強制使用MedDRA,如我國,在前期做了大量工作以促進MedDRA在我國的應用[8-9],但其只適用于西醫術語編碼使用,無法適用于中醫術語。在中國知網等數據庫以多種檢索詞檢索藥品不良反應中醫術語MedDRA編碼相關內容,搜索到的相關研究寥寥無幾,發表時間最近的為2018年,未搜到近三年發表的相關研究。有研究[10]探討構建基于MedDRA術語的中醫藥臨床試驗編碼術語集,通過確定主次系統器官分類(System Organ Class,SOC)來解決SOC中醫與現有SOC中同義詞條的編碼表達和后期檢索問題,從而有利于中醫藥臨床試驗數據的交換、共享、檢索和再分析。有研究[11]提出成立研究指導組和課題組,擬定中醫術語范圍,維護符合MedDRA規則的中醫學編碼術語,確定術語英文翻譯,建立國際公認的中醫學不良反應術語集,并持續維護和更新,以促進中醫學不良反應的規范編碼、分析、監管和數據共享。有研究[12]以MedDRA術語集為參照和基礎,根據中醫標準用語與差異性研究的結果所得出的類名詞分別加入術語集,將術語集進行擴充,加入有中醫含義及中醫特有的中醫名詞,初步建立新的編碼數據庫。
《中華人民共和國藥品管理法》[13]于2019年12月1日正式施行,提出“國家建立藥物警戒制度,對藥品不良反應及其他與用藥有關的有害反應進行監測、識別、評估和控制。”《藥物警戒質量管理規范》[14]已經于2021年12月1日開始施行,規范要求藥品上市許可持有人開展符合法律法規要求的藥品不良反應報告與處置活動。《藥品上市許可持有人MedDRA編碼指南》[15]也于2022年5月6日發布并實施,該指南只適用西藥學體系的不良反應編碼。自2022年7月1日起藥品上市許可持有人的不良反應報告強制使用MedDRA編碼。從目前監管形式看,國家對藥品上市許可持有人合規報告不良反應的質量要求越來越高,監管力度越來越大。建議國家藥品不良反應監測中心考慮與MSSO合作,召集中醫和西醫術語專家,從中醫的特色和特點出發,開展專項研究,研制專門的中醫學不良反應編碼術語集,或者在MedDRA術語集中新增中醫術語,以規范中醫學不良反應編碼,便于藥品上市許可持有人規范開展不良反應監測和上報工作,同時促進監管機構及行業內各組織的交流溝通,更利于中醫藥走上國際化。

