電針預處理對腦缺血再灌注損傷大鼠皮質神經細胞線粒體融合蛋白2表達的影響
丁娜 袁陽 王明山 張高峰 陳懷龍 時飛 孫曉鵬
(1 青島大學附屬青島市市立醫院麻醉科,山東 青島 266071; 2 青島市西海岸新區區立醫院麻醉科)
目前,人群中缺血性腦卒中(ischemic stroke,IS)的發病率、致死率、致殘率均較高[1],急性期溶栓是較為有效的治療方法,但恢復腦血流會導致缺血再灌注(I/R)損傷[2],其中細胞線粒體是該病理過程的中繼站和放大器,維持線粒體形態功能對細胞的存活至關重要[3]。本課題組前期研究結果顯示,電針預處理可抑制大鼠腦I/R時皮質神經細胞的線粒體分裂,減少神經細胞凋亡,發揮腦保護作用[4]。線粒體融合蛋白2(Mfn2)分布于線粒體外膜,在線粒體融合分裂中發揮著重要作用,可以調控線粒體的形態和功能[5]。因此,本研究通過分析電針預處理對大鼠I/R時腦皮質缺血半暗區神經細胞線粒體上Mfn2蛋白表達的影響,以進一步探討電針預處理對大鼠腦I/R損傷可能的影響機制。
1 材料與方法
1.1 動物來源及分組
清潔級健康雄性SD大鼠93只,8~12周齡,體質量200~300 g,購自青島大任富城畜牧有限公司[許可證號:SCXKL(魯)2014-007]。在標準動物房內飼養,溫度20~25 ℃,12-12 h明暗交替環境。將大鼠隨機分為假手術組(S組)、腦缺血再灌注組(I/R組)、電針預處理組(E組),每組31只。
1.2 各組大鼠的處理
S組大鼠僅暴露頸部血管,不進行阻閉。I/R組用線栓法[6]制作大鼠左側大腦中動脈栓塞模型。E組于造模前連續5 d電針刺激大鼠百會穴[4],最后一次針刺結束24 h后同I/R組處理。
1.3 大鼠神經功能缺損評分的評定
于再灌注6、24、48 h時隨機取9只大鼠,按Longa評分法對其行神經功能缺損進行評分[7],1~3分為造模成功。造模成功后行以下指標檢測。
1.4 大鼠神經細胞凋亡率的計算
按照Tunel試劑盒(碧云天生物科技研究所)說明書要求的步驟檢測大鼠神經細胞凋亡情況[8]。于再灌注6、24和48 h時隨機選取4只大鼠,斷頭取腦,取左側腦皮質缺血半暗區組織制作石蠟切片,選用二甲苯、乙醇脫蠟,蛋白酶K消化,PBS沖洗后置入過氧化氫溶液中孵育,DAB顯色后切片。細胞核呈棕褐色的為Tunel細胞,即凋亡神經細胞。參照相關文獻[9]計算大鼠神經細胞凋亡率:在各組玻片組織中隨機選取5張切片,于400倍光鏡下拍照,利用IPP 6.0軟件計算細胞凋亡率,細胞凋亡率=Tunel細胞數量/細胞總數×100%。
1.5 大鼠標本細胞形態學觀察
于再灌注24 h時隨機取4只大鼠,以100 g/L水合氯醛腹腔注射麻醉(0.4 mg/kg)后,生理鹽水灌注循環系統,直至心耳變為白色,右心房流出的液體由血色變為清澈。灌注固定后,取腦皮質缺血半暗區,剪成約1 mm3的小塊,浸入 30 g/L戊二醛前中固定,10 g/L 鋨酸后固定;梯度乙醇脫水后,浸透、包埋、切片;常規醋酸鈾和檸檬酸鉛染色,通過透射電鏡觀察神經細胞中線粒體超微結構的變化。
1.6 Western blot 法檢測腦皮質缺血半暗區神經細胞線粒體上Mfn2及胞漿中Cyt C的表達水平
于再灌注6、24和48 h時每組隨機取5只大鼠,斷頭取腦,取缺血半暗區腦組織,4 ℃條件下制成勻漿。用組織線粒體分離試劑盒(碧云天生物科技研究所)采用差速離心法分離線粒體和胞漿[10]。提取的線粒體加入線粒體裂解液離心后取上清液,上清液含線粒體蛋白。然后配置10%和5%丙烯酰胺的分離膠和濃縮膠,加樣線粒體上清液蛋白或胞漿蛋白進行電泳濃縮、分離,半干法轉移到PVDF膜上,印跡膜封閉2 h后,線粒體上清液蛋白中加入Mfn2一抗(稀釋度1∶1 000,上海恪敏生物科技公司),胞漿蛋白中加入Cyt C一抗(稀釋度1∶1 000,上海恪敏生物科技公司)。室溫孵育1 h后,TBST洗膜,曝光、洗片。以IMAGE J軟件分析灰度值,Mfn2以COX-IV作為內參照,Cyt C 以β-actin作為內參照,Mfn2和Cyt C分別與其內參照蛋白灰度值的比值表示相對表達量。
2 結 果
2.1 3組大鼠神經功能缺損評分比較
時間、時間與分組交互作用對大鼠神經功能缺損評分均無明顯影響(P>0.05),分組對神經功能缺損評分有明顯影響(F=235.53,P<0.05)。與S組比較,I/R組和E組3個時間點的神經功能缺損評分均顯著升高(F=79.17~109.35,P<0.01);與I/R組比較,E組3個時間點神經功能缺損評分均顯著降低(P<0.01)。見表1。
2.2 3組大鼠神經細胞凋亡率比較
時間、分組、時間與分組交互作用對神經細胞凋亡率有明顯影響(F=13.71~328.20,P<0.05)。組內3個時間點比較,I/R組和E組神經細胞凋亡率差異均有顯著性(F=28.08、30.82,P<0.01)。組間比較,在3個時間點I/R組和E組神經細胞凋亡率均顯著高于S組(F=30.79~213.91,P<0.01),E組均顯著低于I/R組(P<0.01)。見表1。
2.3 各組大鼠大腦皮質缺血區神經細胞線粒體上Mfn2及胞漿中Cyt C蛋白水平比較
時間、分組、時間與分組交互作用對線粒體上Mfn2及胞漿中Cyt C蛋白水平均有明顯影響(F=22.00~2 019.71,P<0.05)。組內3個時間點比較,I/R組和E組線粒體上Mfn2表達水平比較差異均有顯著性(F=181.57、19.64,P<0.01),I/R組和E組胞漿中Cyt C蛋白水平比較差異均具有顯著意義(F=87.29、54.40,P<0.01)。組間比較,在3個時間點I/R組和E組線粒體上Mfn2表達水平均顯著低于S組(F=94.86~453.95,P<0.01),E組均顯著高于I/R組(P<0.01);組間比較,在3個時間點I/R組和E組胞漿內Cyt C蛋白水平均顯著高于S組(F=279.81~1 297.13,P<0.01),E組均顯著低于I/R組(P<0.01)。見表1。
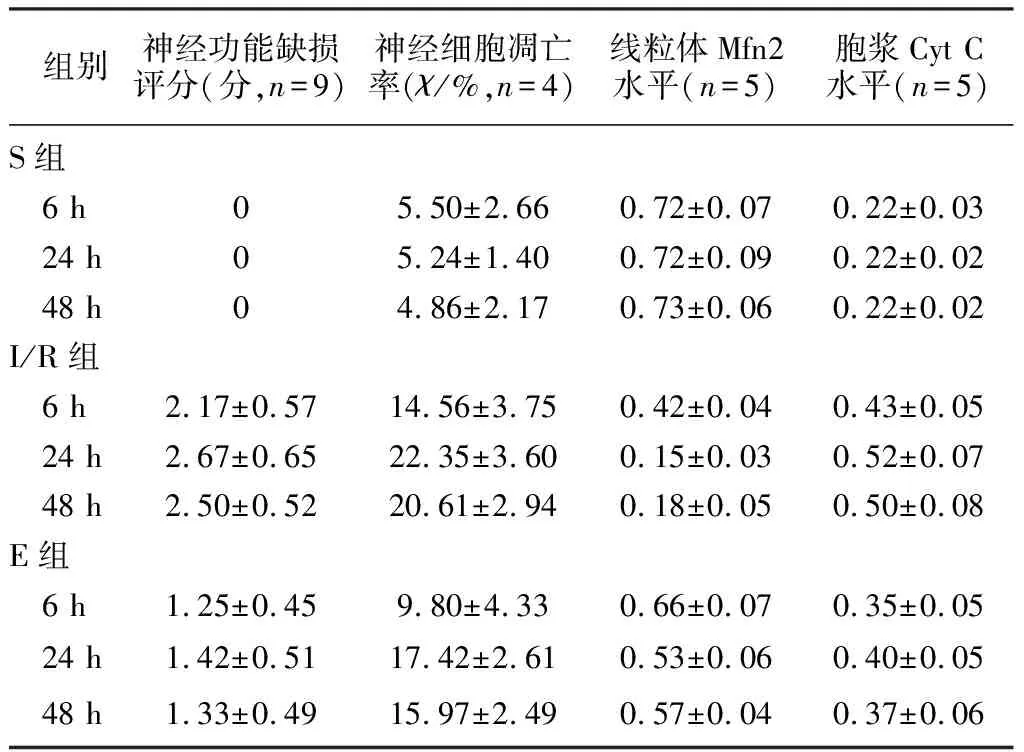
表1 3組大鼠不同時間點相關指標比較
2.4 3組大鼠大腦皮質缺血半暗區神經細胞線粒體超微結構比較
電鏡下S組神經細胞中線粒體呈短棒狀,結構清晰完整。I/R組和E組中可見不同程度的線粒體分裂,膜間隙腫脹,基質包含物沉積,空泡形成,嵴模糊或消失,與I/R組比較E組病變較輕(圖1)。
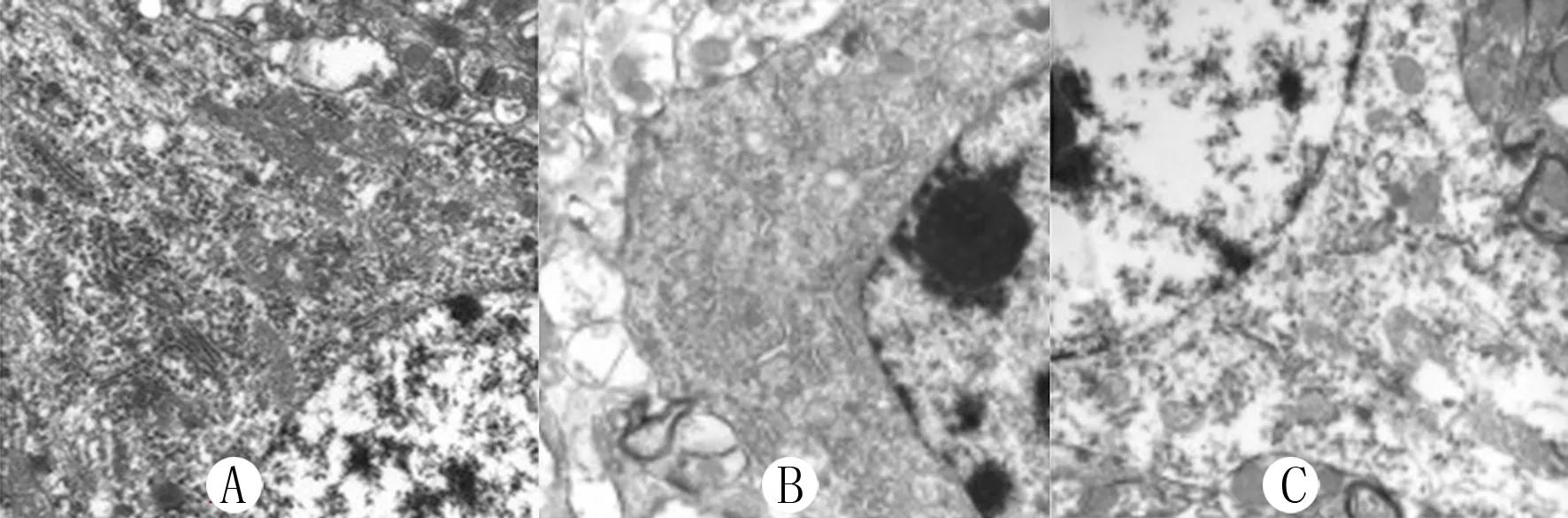
A:S組,B:I/R組,C:E組。枸櫞酸鉛電子染色,100 000倍
3 討 論
研究顯示,電針預處理可激發機體適度應激,合成和釋放一些內源性保護物質進行自我反饋調節,以維持機體內環境的穩定,通過多通道、多靶點誘導腦缺血耐受,改善腦I/R損傷[11]。但其機制尚未完全闡明,本研究從Mfn2介導的線粒體形態改變出發,進一步探討電針預處理的腦保護機制。
本研究中,通過短暫栓塞大鼠大腦中動脈,制備大鼠腦I/R損傷模型,再灌注后大鼠神經功能缺損評分升高,大腦皮質缺血半暗區神經細胞凋亡率增高,說明模型制備成功。電針預處理后,神經功能缺損評分降低,神經細胞凋亡率降低,提示電針預處理減輕了大鼠腦I/R損傷。
線粒體為細胞提供能量,并可通過交換基因組促進細胞修復[12]。生理狀態下線粒體不斷融合分裂,并依靠融合分裂平衡來維持其穩態和正常功能,其中Mfn2是調節線粒體融合分裂水平的重要蛋白之一[13]。細胞代謝過程中,線粒體分裂和融合在維持細胞功能中起關鍵作用。ROCHA等[14]的研究顯示,Mfn2基因突變引起線粒體形態結構缺陷,從而誘發遺傳性的2A型Charcot-Marie-Tooth病。HAN等[15]的研究也發現,Mfn2缺失會引起細胞凋亡。既往研究表明,在I/R等應激狀態下,小鼠腦皮質神經細胞線粒體融合減少,分裂增加,膜電位消失,通透性轉換孔開放,膜間隙中的Cyt C等促凋亡遞質釋放增加,最終導致細胞凋亡[16]。Cyt C是第一個被證明在凋亡細胞線粒體中釋放的蛋白,線粒體中Cyt C的釋放,導致細胞的不可逆凋亡。本研究結果顯示,電鏡下I/R時大鼠大腦皮質缺血半暗區神經細胞線粒體形態改變,膜間隙腫脹,空泡形成,嵴模糊或消失,Cyt C釋放增加,神經細胞凋亡率增加,而電針預刺激后線粒體腫脹變形減輕,雙層膜結構較完整,嵴形態和數目趨于完整,Cyt C釋放減少,神經細胞凋亡率減低。提示電針預刺激會提高神經細胞對I/R的耐受。
研究顯示,PBDE-47可誘導PC12細胞產生神經毒性,而促進線粒體融合通過恢復線粒體穩態和抑制過度細胞凋亡減輕PBDE-47損傷[17]。與青年小鼠相比,老年大鼠肝臟因缺乏Sirt1和Mfn2表達,更容易遭受I/R損傷[18]。在細胞凋亡的過程中,Mfn2的表達及其水平能反映細胞凋亡的程度。ZHANG等[19]的研究結果顯示,特異性靶向缺失Mfn2會導致線粒體端粒縮短,從而增加細胞凋亡。PATRUSHEV等[20]研究顯示,抑制Mfn2表達后,線粒體形態大小不一,各不相同,碎片化程度加重。本研究中I/R損傷后細胞線粒體上Mfn2表達水平下降,線粒體融合降低,Cyt C釋放增加。而經過電針預處理,大鼠在同樣經歷I/R損傷后,細胞線粒體上Mfn2表達下降程度降低,線粒體形態改變減輕,Cyt C釋放減少。
綜上所述,電針預處理大鼠百會穴可以減輕腦I/R損傷后神經損傷癥狀,減輕細胞凋亡,其腦保護機制可能與上調Mfn2表達,增強線粒體融合有關。
利益沖突聲明:所有作者聲明不存在利益沖突。
ConflictsofInterest: All authors disclose no relevant conflicts of interest.
倫理批準和動物權利聲明:本研究涉及的所有動物實驗均已通過青島大學醫學部倫理委員會的審核批準(批準號2019008)。所有實驗過程均遵照《醫學實驗動物管理實施細則》進行。
EthicsApprovalandAnimalRight: All animal experiments involved in this study have been reviewed and approved by The Ethics Committee of Qingdao University Faculty of Medicine(Approval Letter No.2019008).All experimental animal protocols were carried out by following the guidelines of Implementation Rules for The Management of Medical Laboratory Animals.
作者貢獻:丁娜、袁陽、時飛、孫曉鵬、王明山參與了實驗設計;丁娜、張高峰、陳懷龍參與了論文寫作和修改。所有作者均閱讀并同意發表該最終稿件。
Contributions: The study was designed byDINGNa,YUANYang,SHIFei,SUNXiaopeng, andWANGMingshan.The manuscript was drafted and revised byDINGNa,ZHANGGaofeng, andCHENHuailong.Model establishment and indicators detection were implemented by.All the authors have read the last version of the paper and consented submission.

