基因組改組技術在微生物育種方面的應用
韓 笑,杜春梅,2,李玉婷,董錫文,2*
(1.佳木斯大學 生命科學學院,黑龍江 佳木斯 154007;2.佳木斯大學 應用微生物研究所,黑龍江 佳木斯 154007)
1 基因組改組技術的基本概念及發展歷史
基因組改組技術是在脫氧核糖核酸(deoxyribonucleic acid,DNA)重組基礎上,結合傳統育種技術,采用多親本之間的DNA重組和全基因組片段交換,將多個優良表型重組在一起的過程。20世紀90年代中期,STEMMER W P[1]首次提出基因組改組的概念。2002年,ZHANG Y X等[2]在《Nature》雜志上發表了首篇應用基因組改組技術改良微生物菌株的報道。僅用1年的時間,通過2輪原生質體的遞歸融合,快速的增強了弗氏鏈霉菌(Streptomyces fradiae)合成泰樂菌素(Tylosin)的能力[2]。該基因組改組技術的改良成效,相當于誘變育種工作20年的效果[2]。
2 基因組改組技術的一般流程
基因組改組技術的一般流程見圖1,包括親本庫的構建、原生質體的遞歸融合和目標表型的篩選3個部分。
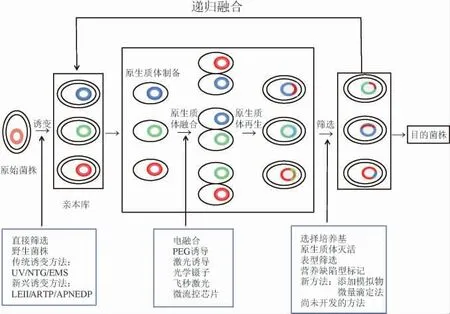
圖1 基因組改組技術的一般流程Fig.1 General process of genome shuffling technique
2.1 親本庫的構建
基因組改組的第一步是構建一個基因多樣化的親本庫。首先要初步篩選具有良好的遺傳多樣性和表型變化明顯的原始菌株,然后對原始菌株進行誘變處理,篩選出遺傳性狀優良的不同類型的突變株,作為后續原生質體融合的親本庫。目前,誘變仍是常見的親本庫的構建方法,通常用傳統的物理誘變(紫外(ultraviolet,UV)誘變)或化學誘變(亞硝基胍(nitrosoguanidine,NTG)誘變、甲基磺酸乙酯(ethyl methyl sulfonate,EMS)誘變)處理,經過一輪或多輪誘變,從而獲得豐富基因型的正突變株[3]。例如,王灝等[4]通過紫外誘變和化學誘變對釀酒酵母f4、f5、f6進行誘變,獲得具有耐高溫和耐乙醇能力的正突變株。但傳統的誘變方法具有誘變時間長和誘變效率低的局限性,為了提高親本菌株的突變效率,一些新興的誘變方法得到了發展和應用,如常壓室溫等離子體(atmospheric room temperature plasma,ARTP)、常壓非平衡放電等離子體(atmospheric nonequilibrium discharge plasma,APNEDP)和低能離子注入(low energy ion implantation,LEII)等方法[5-6]。NIU F X等[7]利用ARTP誘變,獲得了9株莽草酸(shikimic acid,SA)滴度較高、16株生長速度較快、7株莽草酸滴度和生長速度均優于親本的改良菌株。此外,根據隨機組合的策略,為了更加合理地構建親本庫,如多重自動基因組工程(multiple automated genome engineering,MAGE)和真核生物多重自動基因組工程(eukaryotic multiplex genome engineering,eMAGE),可以引入到基因組改組中,篩選出具有更高多樣性和更多功能的大型親本庫[7]。
2.2 原生質體的遞歸融合
原生質體的遞歸融合是基因組改組的關鍵步驟。來自親本的原生質體經歷混合、融合、再生等過程,將來自多個親本菌株的遺傳特征進行融合,使不同基因組的基因整合到一個全新的基因組中。傳統融合方法主要使用化學試劑(聚乙二醇)或電脈沖誘導細胞融合,其融合效率較低[3];激光誘導、光學鑷子、飛秒激光和微流控芯片等新興融合方法顯著提高了原生質體的融合速率,改善了傳統融合方法效率較低的問題[8-10]。例如,GONG J等[11]利用擁有超高時空分辨率的飛秒激光誘導紅發夫酵母(Phaffia rhodozyma)的原生質體融合,約20 min之后能夠發現細胞融合,160 min之內兩個細胞融合成一個較大的細胞,融合效率達到80%。
原生質體融合的效率受融合方法的影響,反過來融合方法又因菌株而異[12]。因此,在進行原生質體融合之前,首先需要對單個菌株的融合方法進行優化,以保證原生質體的高效融合和再生,從而獲得所需的重組菌株[13]。除了優化使用方法外,還可以從技術方面提高原生質體的融合效率。目前,原核細胞和真核細胞已經成功地通過高效的原生質體制備和融合來快速篩選各種菌株[14]。總之,融合速度越快,獲得目的表型的速度越快。
2.3 目的表型的篩選
基因組改組的最后一步是目的表型的篩選。篩選方法種類多樣,篩選技術由于菌株改良的目標而有所不同。一般的篩選方法包括表型觀察篩選、產物理化特性篩選、基質利用能力篩選、選擇性壓力篩選、高通量篩選(high throughputscreening,HTS)等[15]。例如,通過水解圈、透明圈和抑菌圈等篩選產量提高的優良菌株[16];通過生長狀態和選擇培養基篩選耐受能力較好的優良菌株[17];通過高通量篩選方法篩選所需的目的表型和底物利用率提高的菌株[18]。目前出現了一些新穎的篩選方法,例如,添加菌株產物類似物至培養基中,以便有效分離得到高產菌株[19];使用顏色或熒光篩選代謝物產量提高的菌株,通過識別和篩選色素或受熒光影響的產品來選擇目的菌株的理想表型[20-21]。基于光譜裝置,可以建立檢測范圍廣泛的化學物質的高通量篩選方法,通過合適的高通量篩選方法可以迅速的分析目的菌株的多種性狀,并且對目的菌株進行多種方式的快速分類[22]。總之,目的表型的篩選方法越高效,那么目的表型所需的篩選時間越短。
3 基因組改組技術在微生物育種方面的應用
基因組改組技術是一種快速改善細胞表型的新型全基因組工程技術,該技術已經被廣泛用于種內、種間和屬間許多重要菌株的表型改良[5,21,23]。
3.1 應用基因組改組技術提高代謝物產量
基因組改組最重要的應用就是提高代謝產物的產量(見表1)。代謝產物的高產性狀在遺傳水平上主要受多個基因的調控,利用傳統的誘變育種方法都難以實現代謝物產量的提高[24]。基因組改組技術可以成功操縱復雜表型,快速獲得所需表型的高產菌株。例如,安絲菌素具有較高的抗腫瘤活性和抗菌活性,能夠抑制人腫瘤細胞的分裂,是一種很有前途的藥物前體[25]。親本菌株束絲放線菌(Actinosynnema pretiosum)ATCC 31565的安絲菌素產量較低,限制了其市場供應,LI J等[26]通過3輪基因組改組,使改良菌株G3-96的安絲菌素產量達到410.1 mg/L,比親本菌株的安絲菌素產量提高44.5%,比野生菌株的安絲菌素產量提高93.8%。表面活性肽(surfactin)是一種很有前途的微生物脂肽,在食品、環境、農業和醫藥等領域有著廣泛的應用,由于表面活性肽的生產效率較低,成本較高,其商業應用受到了很大限制。CHEN L等[27]采用基因組改組技術對貝萊斯芽孢桿菌(Bacillus velezensis)進行改良,經過3輪基因組改組,獲得了高產、基因穩定的改良菌株F34,其表面活性肽產量從229.6 mg/L提高到908.15 mg/L,在30 L發酵罐中產量達到917.05 mg/L,是原始菌株的3.99倍。
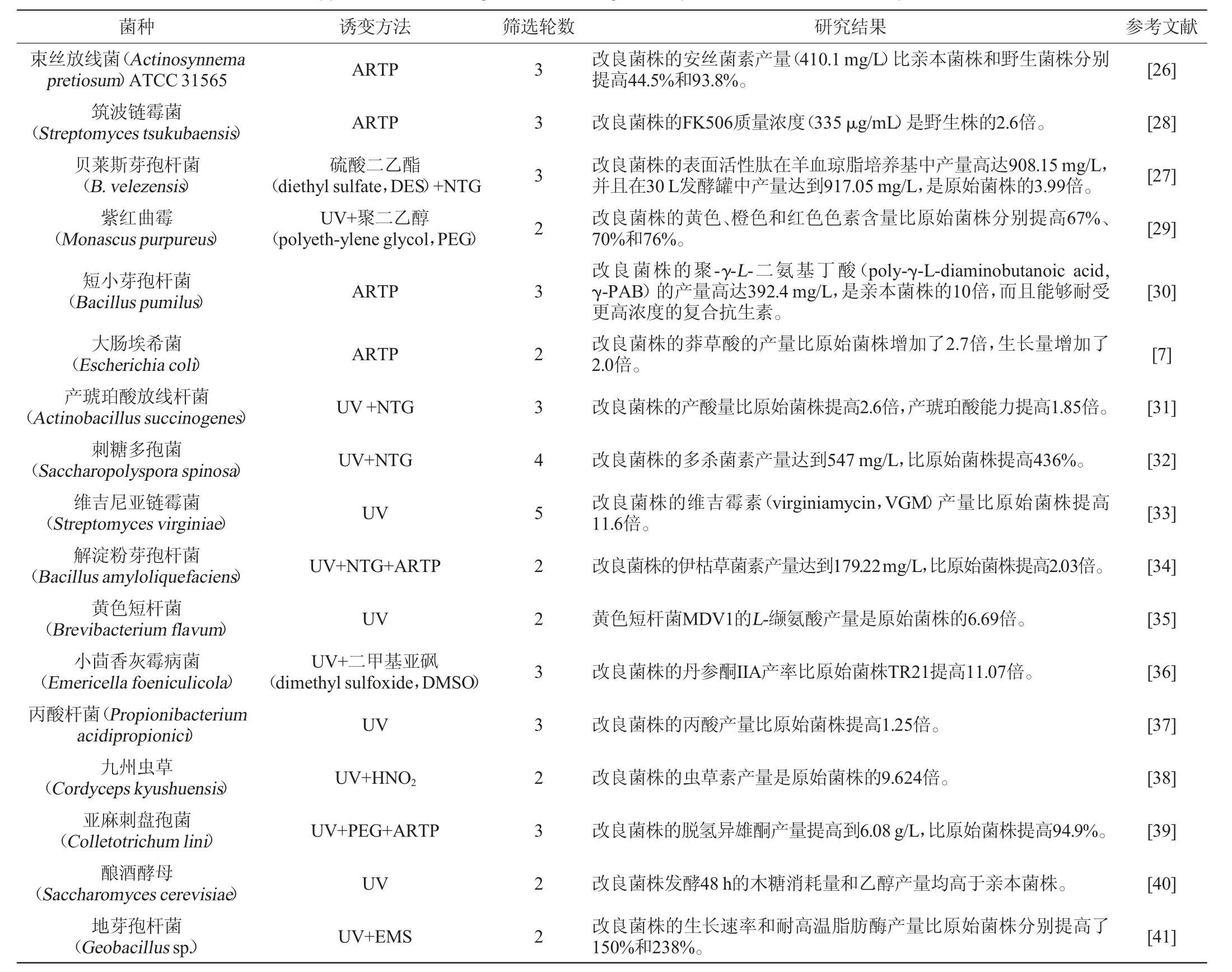
表1 基因組改組技術提高代謝物產量的應用現狀Table 1 Application status of genome shuffling technique to increase metabolite production
3.2 應用基因組改組技術提高改良菌株耐受能力
微生物菌株的最重要性狀之一就是對環境條件具有一定的耐受性,這些環境脅迫會嚴重影響微生物菌株的代謝活性和生產力[42]。許多耐受性的表型受基因組中分布的多基因調控,難以用傳統育種、代謝工程或其他遺傳操作方法進行修飾[43]。近年來,利用基因組改組技術提高微生物菌株對這些脅迫條件的耐受能力已經有了廣泛的研究,如耐熱性、耐糖性、耐酸性、耐鹽性、乙醇耐受性和異丙醇耐受性(見表2)。例如:SHI D等[12]對釀酒酵母(S.cerevisiae)進行3輪基因組改組,獲得的改良菌株SM-3能在55 ℃條件下的平板培養基上生長,提高了菌株SM-3的耐熱性、乙醇耐受性和乙醇產量,緩解了溫度對于釀酒酵母的發酵生產限制。YU L等[44]對鼠李糖乳桿菌(Lactobacillus rhamnosus)進行2輪基因組改組后,改組菌株的乳酸產量、細胞生長和葡萄糖消耗分別較野生型提高71.4%、44.9%和62.2%。基因組改組提高了菌株耐受葡萄糖能力的同時提高了L-乳酸的產量。TIAN K等[45]通過基因組改組技術提高了改良菌株G423耐酸性的同時也提高了Nisin的產量,使得菌株G423可以在pH3.7培養基上存活,且Nisin效價(4543 IU/mL)比原始菌株F44高59.9%。CAO X等[46]通過基因組改組技術提高了魯氏酵母(Zygosaccharomyces rouxii)的耐鹽性,篩選到的改良菌株S3-2不僅在高鹽的培養基中生長狀態良好,而且對氯化鉀和氯化鋰表現出更強的抗逆性,同時能夠加速醬油的風味形成和提高醬油的品質。SNOEK T等[47]對釀酒酵母(S.cerevisiae)的親本菌株進行了3輪基因組改組,淘汰了乙醇耐受性較低的改良菌株,得到了具有最大乙醇產量和乙醇耐受性提高7%的釀酒酵母改良菌株。DE GéRANDO H M等[48]利用基因組改組技術對拜氏梭菌(Clostridium beijerinckii)進行改良,最終得到3株異丙醇耐受能力提高的改良菌株,其異丙醇耐受能力最高達50 g/L,比原始菌株提高42.85%。CHENG C等[49]通過基因組改組技術提高了釀酒酵母(S.cerevisiae)對木質纖維素水解物中存在的一種或多種抑制副產物的耐受能力,改組之后的釀酒酵母菌株對存在于木質纖維素生物質水解物中的抑制性副產物的耐受性增加。以上研究表明通過基因組改組技術不僅可以提高微生物菌株的單一性狀,而且可以同時改善微生物菌株的多種性狀,充分展示了該項技術的應用潛力。
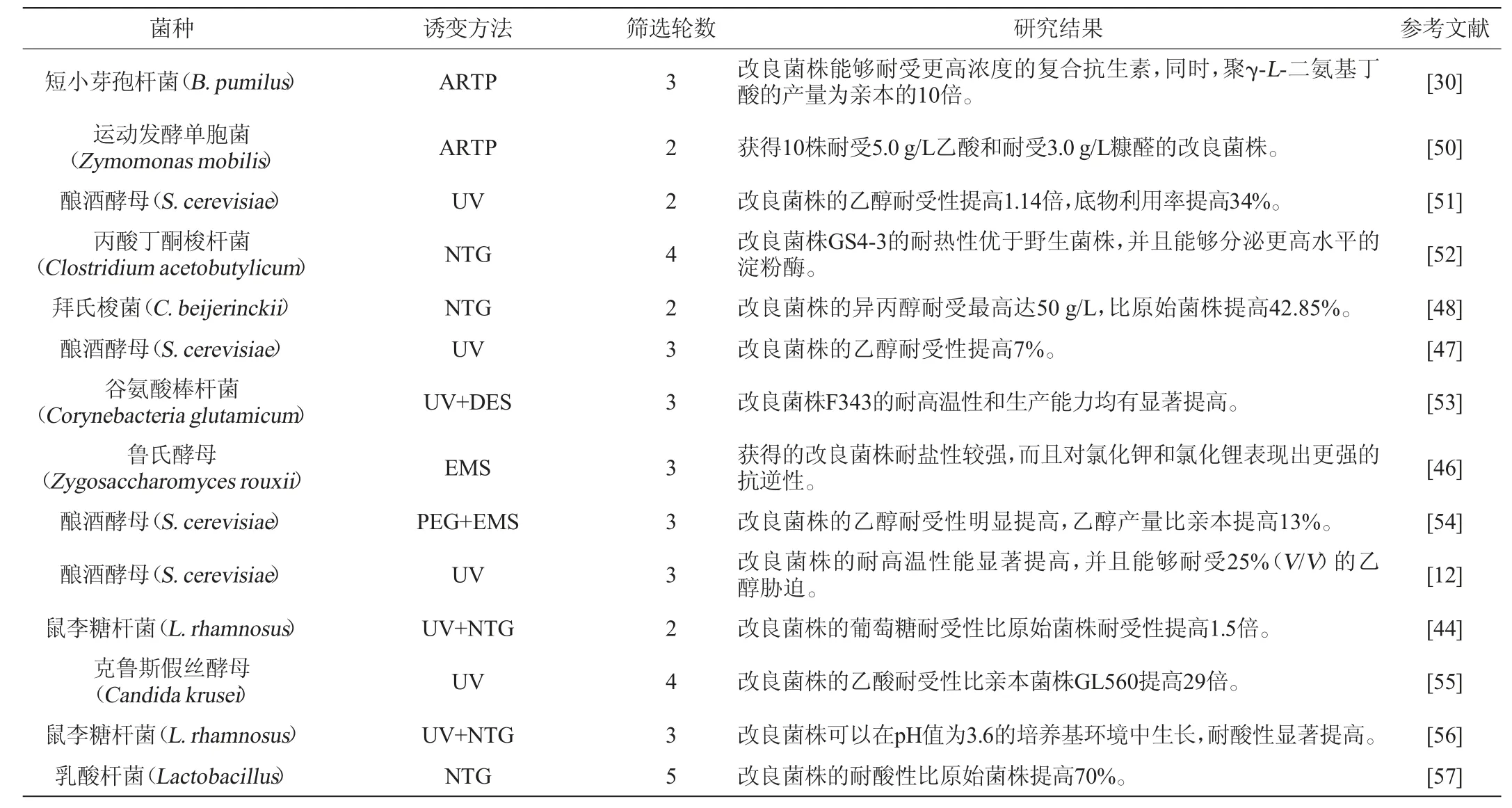
表2 基因組改組技術提高菌株耐受能力的應用現狀Table 2 Application status of genome shuffling technique to improve strain tolerance
3.3 應用基因組改組技術提高底物利用效率
高效的底物利用能力是微生物菌株改良中所期望獲得的目的表型之一,通過基因組改組的方法,可以獲得底物利用率提高的菌株(見表3)。例如,JETTI K D等[51]利用釀酒酵母(S.cerevisiae)和樹干畢赤酵母(Pichia stipitis)進行基因組改組,獲得了一株底物的利用率明顯高于親本菌株的改良菌株SP2-18,該菌株能夠利用木糖;JOHN R P等[23]使用德氏乳桿菌(Lactobacillus delbrueckii)和解淀粉芽孢桿菌(Bacillus amyloliquefaciens)作為親本菌株,從淀粉廢物中生產L-乳酸,3輪基因組改組之后,改良菌株F2從83 g/L木薯甘蔗渣(淀粉含量50%)中直接生產40 g/L乳酸,使淀粉轉化率達到96%;趙晨等[58]以枯草芽孢桿菌(Bacillus subtilis)SFR-3A作為原始菌株,通過基因組改組技術篩選到具有高抗逆性D-核糖高產菌株SFRCP-100,該菌株在5 L發酵罐中的D-核糖產量達到38.2 g/L,其轉化率達到35%。

表3 基因組改組技術提高菌株對底物轉化率的應用現狀Table 3 Application status of genome shuffling technique to improve substrate conversion rate of strain
此外,通過基因組改組提高底物利用率也可以用于降解環境污染成分[59-62]。生物系統天生具有將復雜底物轉化為簡單分子的能力,使其能夠對環境污染成分進行生物降解。由于從環境中分離出的野生菌株的降解速度較慢,因此,需要提高微生物降解高分子底物的能力。LEE B U等[59]通過基因組改組技術對具有降解2,4,6-三硝基甲苯(2,4,6-trinitrotoluene,TNT)能力的嗜麥芽寡養單胞菌(Stenotrophomonas maltophilia)OK-5進行4輪基因組改組后,改良菌株對TNT的降解作用比原始菌株提高6倍;YI L等[60]利用紫外誘變和亞硝基胍誘變結合基因組改組技術,提高了假單胞菌(Pseudomonas parafulva)YAB-1對于持久性有機污染物全氟辛酸(perfluorooctanoic acid,PFOA)的降解能力,改良菌株對PFOA的降解率達到58.6%,比原始菌株提高1.8倍[60]。
以上研究結果不僅表明了基因組改組技術在提高底物利用率方面的成功應用,而且證明了該項技術可以有效地促進微生物菌株對于有毒化合物的降解以及該項技術在改善環境微生物污染中的廣闊的應用前景。
3.4 基因組改組技術在微生物菌株改良中其他方面的應用
研究發現通過基因克隆、突變或原生質體融合等技術可能會激活基因組中的沉默基因,從而產生新的活性代謝產物[63]。在這方面,一些研究人員已經證明了基因組改組在激活某些代謝方面也很有效(見表4),因此,基因組改組技術可以作為一項探索新基因和代謝產物的新方法。WANG M等[64]通過基因組改組得到的改良菌株G-444產生的18個新化合物,與原始菌株瘤座孢屬(Tuberculariasp.)TF5的化合物在結構類型和代謝物上都有所不同,表明通過基因組改組之后一些沉默基因被激活;CAO X等[46]利用基因組改組技術篩選出的改良菌株S3-2在高鹽液體發酵中,提升了醬油風味,而且減少了香氣形成所需的總時間。此外,改良菌株S3-2具有較高的氨基酸氮含量,其中乙酸乙酯含量為對照的2.38倍,并且改良菌株S3-2使4-羥基-2-乙基-5-甲基-3-呋喃酮(4-hydroxy-2-ethyl-5-methyl-3-furanone)的生成率提高75%,同時產生了4-乙基愈創木酚(4-ethylguaiacol)這一重要的風味成分。
此外,通過基因組改組技術使微生物菌株的其他目的表型也得到了顯著提高(見表4),如提高了植物乳桿菌(Lactobacillus plantarum)163的抑菌活性,提高了乳酸片球菌(Pediococcus acidilactici)對雞沙門氏菌(Salmonella gallinarum)的抑菌活性,提高了植物乳桿菌(Lactobacillus plantarum)C88的粘附力,提高了鏈霉菌(Streptomyces bikiniensis)對黃瓜枯萎病菌(Cucumber fusarium)的生防活性[65-68]。充分說明了基因組改組技術是一種范圍廣泛、功能強大的微生物菌株改良技術。

表4 基因組改組技術在微生物育種其他方面的應用現狀Table 4 Application status of genome shuffling technique in other aspects of microbial breeding
4 結論與展望
基因組改組作為一種快速改良微生物菌株全基因組的技術,既可以對多個親本的全基因組進行改良,又不需要十分了解改良菌株的遺傳背景,成功地完成了許多微生物菌株的表型改良,其中包括藥用微生物菌株,農業微生物菌株和工業微生物菌株的改良,具有極大的應用于實際生產的潛力,促進了微生物菌種選育工作的技術方法和路線上的變革,開創了菌種改良和改造工作的新局面[69]。但是基因組改組技術仍有較大的發展空間,首先,基因組改組技術可以與合理的基因工程相結合,可以提前將具有明確遺傳背景的單個基因、代謝途徑或代謝網絡進行定向改造,然后用于進一步的基因組改組。而且,隨著基因組學和生物信息學的發展,基因組改組作為連接其他技術的重要橋梁,將為闡明代謝網絡和調控機制提供更大的機會。此外,根據自動化裝置和快速檢測方法的發展,高通量篩選方法也將隨之更新。因此,建立普適的高通量篩選方法仍然存在較大困難。
相信隨著多元策略創造遺傳多樣性、先進的原生質體誘導技術和高效的高通量篩選方法的應用,基因組改組技術將在未來的微生物菌株改良中發揮出更加重要的作用,創造出更大的社會價值和經濟價值。

