紅桿菌NBS58-1產胞外多糖發酵條件優化及其保濕性研究
李春雨,楊棒棒,周 佳,羅 宇,屈建航*
(河南工業大學 生物工程學院,河南 鄭州 450001)
多糖(即多聚糖)一般是通過10個以上的單糖由糖苷鍵連接起來而形成的聚合糖高分子碳水化合物[1],種類繁多,結構復雜。根據來源不同,多糖分為動物多糖、植物多糖、微生物多糖[2]。微生物多糖是由細菌、真菌、藻類等微生物在代謝過程中產生的對其本身有保護作用的生物高聚物,相較于動物多糖與植物多糖,微生物多糖獲取成本低,方法簡便,且不受地域、季節、蟲害、光照等條件限制,同時還具有發酵條件易調控、多糖易分離等優點[3]。
微生物多糖以胞外多糖(exopolysaccharides,EPS)為主,微生物胞外多糖具有保濕、乳化[4]、流變[5]、粘合、金屬絡合[6]等特性以及抗氧化[7]、抗炎癥[8]、抗腫瘤[9]、免疫調節[10]等生物活性,在食品、生物技術、化妝品和制藥工業中具有較大的潛在應用價值。其中部分細菌多糖的化學結構中存在大量親水性羥基,使得多糖具有較強的吸濕保濕活性[11],在化妝品行業中具有廣闊的應用前景。周璇[12]研究發現,地衣芽孢桿菌Ⅱ4-01胞外多糖在相對濕度為43%和81%環境中,純多糖的吸濕能力強于殼聚糖和黃原膠;在干硅膠環境下,多糖的保濕性要明顯優于殼聚糖和黃原膠。楊棒棒等[13]研究發現,類芽孢桿菌ZX-5胞外多糖在干燥環境中具有優于甘油和殼聚糖的保濕性。
目前產胞外多糖優良菌種的篩選及其發酵條件優化,仍是微生物胞外多糖研究的關鍵。張麗等[14]對培養基成分進行優化,優化后齊整小核菌產糖量提高了54.42%。王琪等[15]對篩選的一株產胞外多糖羅漢果內生菌株進行發酵條件優化,優化后產糖量是優化前的1.9倍。
本研究對本實驗室自主分離篩選和鑒定的一株細菌新種紅桿菌(Rufibacter hautae)NBS58-1進行發酵產糖條件的優化,并研究其保濕性,為微生物胞外多糖的菌種資源開發及其相關應用奠定理論基礎和技術參考。
1 材料與方法
1.1 材料與試劑
1.1.1 菌株
紅桿菌(Rufibacter hautae)NBS58-1:本實驗室自主分離篩選和鑒定[16]。
1.1.2 試劑
葡萄糖、丙酮酸鈉、硝酸鈉、尿素、蔗糖、麥芽糖、棉子糖、阿拉伯糖、瓊脂粉、無水乙醇、苯酚(均為分析純):天津市科密歐化學試劑有限公司;酵母浸粉、酸水解酪蛋白、胰蛋白胨(均為生化試劑):北京奧博星生物技術有限公司。
1.1.3 培養基
R2A培養基[16]:酵母浸粉0.5 g/L、酸水解酪蛋白0.5 g/L、胰蛋白胨0.5 g/L、葡萄糖0.5 g/L、可溶性淀粉0.5 g/L、K2HPO4·3H2O0.3g/L、MgSO4·7H2O0.05g/L、丙酮酸鈉0.3g/L,pH 7.0、115 ℃滅菌30 min。固體R2A培養基加入瓊脂粉15 g。
1.2 儀器與設備
VS-840-2潔凈工作臺、SPX-250B-D培養箱、BSDYX2400立式雙層智能精密搖床:上海博迅實業有限公司醫療設備廠;UV-2450紫外可見分光光度計:日本島津公司;TGL-16G高速離心機:上海安亭科學儀器廠。
1.3 方法
1.3.1 菌株NBS58-1生長曲線及其產胞外多糖曲線繪制
R2A固體培養基上挑取NBS58-1新鮮菌種,接種至R2A液體培養基,28 ℃、150 r/min培養48 h作為種子液。將種子液以5%(V/V)的接種量接至R2A液體培養基中,在28 ℃、150 r/min、裝液量100 mL/250 mL條件下進行發酵產糖。分別于不同時間(0、15 h、22 h、27 h、39 h、46 h、52 h、58 h、65 h、75 h、87 h)取3 mL發酵液樣品,測定波長600 nm處的吸光度值,用蒸餾水作為空白對照,以發酵時間為橫坐標,吸光度值為縱坐標繪制菌株生長曲線。
參照竇富超[17]的方法繪制葡萄糖標準曲線,分別于不同時間(0、15 h、22 h、27 h、39 h、46 h、52 h、58 h、65 h、75 h、87 h)取3 mL發酵液樣品,采用硫酸苯酚法[18]測定多糖含量,以發酵時間為橫坐標,胞外多糖產量為縱坐標,繪制菌株產胞外多糖曲線。
1.3.2 單因素試驗
以R2A培養基的成分為基礎,固定R2A培養基起始pH 7,溫度28 ℃,接種量5%。分別考察碳源(葡萄糖、蔗糖、麥芽糖、棉子糖、阿拉伯糖)及碳源添加量(0.5 g/L、1 g/L、2 g/L、5 g/L、10 g/L、15 g/L、20 g/L、40 g/L),氮源(酵母浸粉、胰蛋白胨、酸水解酪蛋白、尿素、硝酸鈉)及氮源添加量(0.5 g/L、1.0 g/L、2.0 g/L),pH(6.0、6.5、7.0、7.5、8.0),溫度(10 ℃、20 ℃、28 ℃、37 ℃、45 ℃),接種量(3%、5%、8%、10%、15%)對NBS58-1產胞外多糖量的影響。
1.3.3 胞外多糖發酵條件優化響應面試驗設計
在單因素試驗的基礎上,使用Design Expert12軟件進行響應面設計,選取3個影響顯著的因素蔗糖添加量(A)、初始pH(B)、溫度(C)設計3因素3水平的試驗組合,考察因素變化對胞外多糖產量(Y)的影響。

表1 胞外多糖發酵條件優化響應面試驗因素與水平Table 1 Factors and levels of response surface tests for extracellular polysaccharide fermentation condition optimization
1.3.4 胞外多糖保濕性評價
參照WANG Z C等[19]的方法提取純化胞外多糖。參照周璇[12]吸濕保濕試驗方法,并稍作修改。
(1)吸濕性試驗:精密稱取胞外多糖凍干樣品、烘干至質量恒定的殼聚糖和透明質酸各0.1 g,置于干燥平皿中,將平皿分別放置在裝有適量飽和碳酸鈉溶液(相對濕度43%)和飽和硫酸銨溶液(相對濕度81%)的20 ℃恒溫干燥器中,定時稱量樣品質量。每組每個樣品3次平行。樣品吸濕率計算公式如下:

式中:mt為t時間樣品質量,g;m0為干燥樣品質量,g。
(2)保濕性試驗:精密稱取胞外多糖凍干樣品、烘干至恒重的殼聚糖和透明質酸各0.1 g,分別加入3倍體積去離子水,將樣品均勻完全浸潤后,放置于盛有干硅膠的干燥器中(相對濕度0%),定時稱量樣品質量。樣品保濕率計算公式如下:

式中:mt為t時間樣品質量,g;m0為干燥樣品質量,g;m水為加入去離子水質量,g。
1.3.5 數據統計分析
所有試驗設置3個平行,結果以“平均值±標準差”形式表示。單因素試驗采用SPASS 22.0軟件進行顯著性分析,采用Origin 2021b軟件作圖。響應面試驗設計及分析采用DesignExpert 12軟件。
2 結果與分析
2.1 菌株NBS58-1生長曲線及其產胞外多糖曲線
菌株NBS58-1生長曲線及產胞外多糖曲線如圖1所示。由圖1可知,菌株NBS58-1在52 h時生長量達到最大,在58 h時EPS產量達到最大。

圖1 菌株NBS58-1生長曲線及產胞外多糖曲線Fig.1 Growth curve and extracellular polysaccharide production curve of strain NBS58-1
2.2 單因素結果分析
2.2.1 碳源對菌株NBS58-1產EPS的影響
由圖2(A)可知,5種不同碳源均能促進菌株NBS58-1產生一定量的胞外多糖,蔗糖作為單一碳源時效果最佳,組間差異顯著(P<0.05)。由圖2(B)可知,在蔗糖添加量為0.5~15 g/L時,菌株NBS58-1產EPS量不斷增加;在15 g/L時達到最大,為100.77 mg/L;在15~40 g/L時,隨著蔗糖添加量的增大而減小,可能是由于培養基中蔗糖含量過高,導致菌體內外滲透壓失衡,其生長受到抑制,從而影響菌株胞外多糖的合成[20]。因此選擇蔗糖添加量為15 g/L。

圖2 碳源種類(A)及蔗糖添加量(B)對菌株NBS58-1產胞外多糖的影響Fig.2 Effect of carbon source (A) and sugar addition (B) on extracellular polysaccharide production by strain NBS58-1
2.2.2 氮源對菌株NBS58-1產EPS的影響
氮源對微生物的生長至關重要,而不同的微生物有自身的氮源需求[21]。由圖3(A)可知,不同氮源對NBS58-1產EPS量的影響有顯著差異(P<0.05),有機氮源明顯優于無機氮源,以酵母浸粉作為氮源時,更有利于菌株NBS58-1產胞外多糖。由圖3(B)可知,適當提高酵母浸粉濃度有利于菌株產糖。當酵母浸粉濃度過低時,細胞合成菌株生長繁殖時所需的蛋白質、核酸等受到影響,進而影響產糖量[22];當酵母浸粉質量濃度為1 g/L時,產糖量最大,為33.98 mg/L;當酵母浸粉質量濃度>1 g/L時,NBS58-1產EPS開始下降,原因可能是氮源添加量過高,發酵液粘稠,溶氧量減小,導致菌株產糖的分泌與合成受到影響[23]。因此選擇酵母浸粉添加量為1 g/L。

圖3 氮源種類(A)及酵母浸粉添加量(B)對菌株NBS58-1產胞外多糖的影響Fig.3 Effect of nitrogen source (A) and yeast extract addition (B) on extracellular polysaccharide production by strain NBS58-1
2.2.3 溫度對菌株NBS58-1產EPS的影響
由圖4可知,當其他條件不變時,溫度在10~28 ℃范圍內隨著溫度升高,菌株NBS58-1產EPS量隨之增大;在28 ℃時,EPS產量達到最大;28~45 ℃范圍內,隨著溫度升高,NBS58-1產EPS量隨之減小。原因可能溫度過高或過低,都有可能影響酶蛋白的活性及細胞膜的通透性,進而影響菌體的正常生長及產糖[24]。因此選擇溫度為28 ℃。

圖4 溫度對菌株NBS58-1產胞外多糖的影響Fig.4 Effect of temperature on extracellular polysaccharide production by strain NBS58-1
2.2.4 初始pH對菌株NBS58-1產EPS的影響
由圖5可知,初始pH對菌株NBS58-1產EPS有顯著影響(P<0.05);在pH 6~8范圍內,EPS產量先增大后減小,在pH 7時產量最大,因此選擇pH 7。

圖5 初始pH對菌株NBS58-1產胞外多糖的影響Fig.5 Effect of initial pH on extracellular polysaccharide production by strain NBS58-1
2.2.5 接種量對菌株NBS58-1產EPS的影響
接種量的多少直接影響菌體生長速率,不同菌株的種子液培養方式不同則最適接種量差異較大[25]。由圖6可知,在同一發酵時間,隨著接種量增加,菌株NBS58-1產EPS先增大后減小,原因可能是在營養成分一定時,接入過多菌種,營養物質加速消耗,用于合成EPS的能力不足[26]。在接種量為5%時,EPS產量最大,為44.59 mg/L。因此選擇接種量為5%。

圖6 接種量對菌株NBS58-1產胞外多糖的影響Fig.6 Effect of inoculum on extracellular polysaccharide production by strain NBS58-1
2.3 響應面優化試驗結果及分析
對蔗糖添加量(A)、初始pH(B)、溫度(C)3個因素選取3個水平進行Box Behnken試驗,結果如表2所示。

表2 Box Behnken試驗設計與結果Table 2 Design and results of Box Behnken tests
由表2數據可得出各因素對菌株NBS58-1產EPS影響的回歸方程:Y=128.1-18.78A+19.84B-28.59C-2.44AB-14.29AC-15.83BC-53.31A2-20.86B2-33.62C2。由表3可知,模型的F值為62.41,P<0.01,模型顯著,失擬項P值=0.264 0,P>0.05,不顯著。決定系數R2=0.987 7,調整決定系數R2adj=0.971 9,與決定系數R2相差<0.2,信噪比=26.267 4>4,表明試驗精準度和準確度高,該模型可以較好的應用于對菌株NBS58-1 EPS產量的理論預測。一次項A、B、C,二次項A2、B2、C2以及交互項AC、BC對菌株NBS58-1 EPS產量有極顯著影響(P<0.01);交互項AB對菌株NBS58-1 EPS產量影響不顯著。

表3 回歸模型方差分析結果Table 3 Results of variance analysis of regression model
響應面可直觀反映試驗中不同因素以及兩兩因素之間交互作用。響應面的坡度越大,則顯示試驗因素對NBS58-1 EPS產量影響越大。等高線的橢圓程度表示兩兩因素之間交互作用對EPS產量影響的顯著性,等高線橢圓程度越大,影響越顯著。圖7結果表明,碳源添加量的坡度大于初始pH的坡度,表明在碳源添加量與初始pH交互作用中碳源添加量的影響大于初始pH。碳源添加量與溫度的坡度較陡峭且顏色變化快,表明兩者交互作用對菌株NBS58-1 EPS產量影響顯著。初始pH與溫度的等高線圖橢圓程度大,表明二者交互作用顯著,與方差分析結果一致。

圖7 蔗糖添加量、初始pH與溫度間交互作用對菌株NBS58-1產胞外多糖影響的響應曲面與等高線Fig.7 Response surface plots and contour lines of effect of interaction between sucrose addition,initial pH and temperature onextracellular polysaccharide production by strain NBS58-1
為了驗證模型的準確性,根據預測最優條件(pH 7.33、溫度22.88 ℃、蔗糖添加量14.13 g/L、酵母浸粉添加量1 g/L、K2HPO4·3H2O 0.3 g/L、MgSO4·7H2O 0.05 g/L、丙酮酸鈉0.3 g/L)得到預測EPS產量為140.2 mg/L,為方便實際操作,修改試驗條件為初始pH 7.5、溫度23 ℃、蔗糖添加量14.1 g/L、酵母浸粉添加量1 g/L、K2HPO4·3H2O 0.3 g/L、MgSO4·7H2O 0.05 g/L、丙酮酸鈉0.3 g/L,在此條件下進行驗證,重復3次,得到EPS產量為138.85 mg/L,與預測值接近,表明模型模擬可靠,能較好的預測真實值。
2.4 菌株NBS58-1產胞外多糖保濕性評價
2.4.1 吸濕性
透明質酸、殼聚糖、菌株NBS58-1產胞外多糖在不同相對濕度條件下吸濕能力如圖8所示,在不同相對濕度環境下,3個樣品的吸濕率都隨時間的增加而增大。在相對濕度43%條件下,40 h時透明質酸、EPS、殼聚糖的吸濕率分別為29.15%、20.01%、18.6%;在相對濕度81%條件下,40 h時透明質酸、EPS、殼聚糖的吸濕率分別為35.7%、23.15%、20.3%,表明相對濕度越大,樣品在同一時間的吸濕率越高。吸濕能力排序為透明質酸>EPS>殼聚糖,EPS的吸濕能力雖然比透明質酸吸濕能力差,但優于殼聚糖的吸濕能力,有一定開發應用潛力。

圖8 透明質酸、殼聚糖和菌株NBS58-1產胞外多糖吸濕性比較Fig.8 Comparison of moisture absorption of hyaluronic acid,chitosan and extracellular polysaccharide produced by strain NBS58-1
2.4.2 保濕性
菌株NBS58-1產胞外多糖的保濕性評價如圖9所示,透明質酸、EPS、殼聚糖在干燥環境下保濕率隨時間的延長而降低,在48 h內,EPS的保濕率優于透明質酸與殼聚糖;在48 h時,EPS保濕率為58%,與透明質酸相當,且優于殼聚糖;48 h后,保濕率透明質酸>EPS>殼聚糖,表明該胞外多糖具有一定的保濕效果。
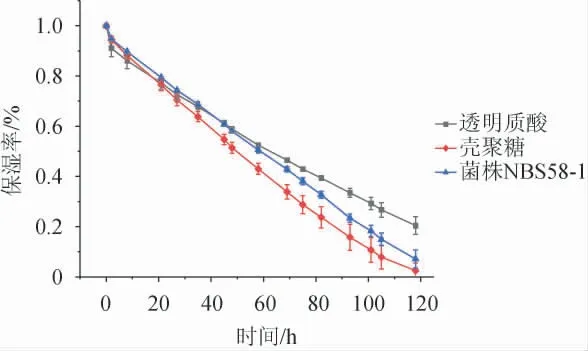
圖9 透明質酸、殼聚糖和菌株NBS58-1產胞外多糖保濕性比較Fig.9 Comparison of moisture retention of hyaluronic acid,chitosan and extracellular polysaccharide produced by strain NBS58-1
3 結論
該研究通過單因素試驗、Box-Behnken試驗和響應面分析,優化了細菌NBS58-1產胞外多糖條件,并研究其產生的胞外多糖的吸濕保濕能力。結果表明,最佳發酵產糖工藝為初始pH 7.5、溫度23 ℃、蔗糖14.1 g/L、酵母浸粉1 g/L、可溶性淀粉0.5 g/L、K2HPO4·3H2O 0.3 g/L、MgSO4·7H2O 0.05 g/L、丙酮酸鈉0.3 g/L,在此條件下發酵58 h,菌株NBS58-1的產EPS量為138.85 mg/L,是優化前的3.08倍。保濕性研究結果表明,在相對濕度0%條件下,48 h內該胞外多糖的保濕率優于透明質酸與殼聚糖。在相對濕度43%和81%條件下,吸濕能力稍低于透明質酸,但高于殼聚糖。微生物產胞外多糖結構復雜,功能多樣,后續將繼續探究該胞外多糖的結構及其他功能與活性。

