谷氨酸棒桿菌表達大腸桿菌來源海藻糖酶
滿在偉,崔慧慧,李錦,張迎陽,張建波,張建濤*
(1.常州大學 生物與食品工程學院,江蘇 常州 213164;2.山東恒仁工貿有限公司,山東 棗莊 277533)
海藻糖是由葡萄糖以α-1,1糖苷鍵連接而成的二糖,無還原性、化學性質穩定,能夠保護細胞的生物大分子,是生物體的一種應激合成產物[1-2]。海藻糖酶可以水解海藻糖的α-1,1糖苷鍵,將海藻糖分解為兩分子葡萄糖[3-5]。近年來,海藻糖酶逐漸應用于發酵工業。玉米乙醇發酵中,海藻糖是發酵殘糖的重要成分。在玉米乙醇發酵工業中,利用含有海藻糖酶活性的葡糖淀粉酶套件可水解發酵殘糖中的海藻糖,進而提高乙醇產率和利潤率[6]。谷氨酸棒桿菌發酵生產谷氨酸過程中,菌體會合成海藻糖并積累于發酵液中,導致發酵液中殘糖濃度偏高。在谷氨酸發酵過程中添加海藻糖酶,可大幅降低發酵液中海藻糖濃度并提高谷氨酸得率,還可減小海藻糖對下游谷氨酸提取的影響[7-10]。另外,海藻糖酶也可用于海藻糖的快速檢測。利用海藻糖酶將樣品中海藻糖特異性分解成葡萄糖,對分解而來的葡萄糖進行檢測即可得出樣品中海藻糖的含量[11]。
隨著海藻糖酶的應用逐漸增加,微生物生產海藻糖酶相關研究逐漸受到重視。通過菌株篩選可得產海藻糖酶微生物,如大黃歐文氏菌(Erwinia rhapontici)[12]、路德維希腸桿菌(Enterobacter ludwigii)[13]、分散泛菌(Pantoea dispersa)[14]、 玫瑰色微球菌(Micrococcus roseus)[15]等。通過將海藻糖酶基因在特定微生物中過量表達,也可獲得高效合成海藻糖酶重組菌株。利用大腸桿菌(Escherichia coli,E.coli)BL21 可過量表達 E.coli str.K-12 substr.MG1655的海藻糖酶編碼基因,獲得的海藻糖酶可高效水解海藻糖[16]。利用黑曲霉HL-1表達來源于嗜熱毀絲霉(Myceliophthora thermophila)和瘤胞毀絲霉(Myceliophthora sepedonium)的高活力海藻糖酶編碼基因,采用增加基因拷貝數和發酵培養基優化方法提高產酶水平,純化后的海藻糖酶用于酵母乙醇發酵可提高葡萄糖乙醇轉化率[17-20]。利用畢赤酵母表達來源于嗜熱真菌的海藻糖酶編碼基因,獲得的海藻糖酶也可用于酵母乙醇發酵過程并提高乙醇轉化率[21]。
E.coli BL21中同樣存在海藻糖酶編碼基因trl,該基因與E.coli str.K-12 substr.MG1655的海藻糖酶編碼基因相似度為98.42%,基因中存在26個核苷酸差異,編碼蛋白中507位氨基酸殘基存在差異。目前,鮮有關于E.coli BL21中海藻糖酶Trl的相關研究和報道。谷氨酸棒桿菌(Corynebacterium glutamicum,C.glutamicum)是一種一般認為安全的(generally recognized as safe,GRAS)菌株,營養要求低,蛋白合成能力強,蛋白水解酶活性低。C.glutamicum廣泛應用于氨基酸、有機酸、生物燃料等發酵生產[22]。近年來,將C.glutamicum作為蛋白表達宿主用于表達目標蛋白逐漸受到重視[23-24]。
本研究將E.coli BL21來源的海藻糖酶在C.glutamicum ATCC13032中表達,對表達條件和重組海藻糖酶性質進行研究,為海藻糖酶相關研究和應用提供參考。
1 材料與方法
1.1 材料與試劑
1.1.1 菌株與質粒
E.coli BL21菌株、C.glutamicum ATCC13032菌株、C.glutamicum表達質粒pXMJ19:常州大學食品生物技術實驗室保藏。
1.1.2 試劑與培養基
基因組提取試劑盒、聚合酶鏈式反應(polymerase chain reaction,PCR)試劑盒、基因膠回收純化試劑盒、基因連接試劑盒、質粒提取試劑盒、核酸電泳試劑盒、蛋白電泳試劑盒、改良型Bradford蛋白濃度測定試劑盒:生工生物工程(上海)股份有限公司;限制性內切酶EcoR I和 Hind III、異丙基-β-D-硫代半乳糖苷(isopropyl-β-D-thiogalactopyranoside,IPTG)、氯霉素:生工生物工程(上海)股份有限公司;酵母粉、蛋白胨:安琪酵母股份有限公司。
盧里亞-貝爾塔尼(Luria-Bertani,LB)培養基:酵母粉5 g/L,蛋白胨10 g/L,NaCl 10 g/L,固體培養基加入瓊脂20 g/L,根據需要加入氯霉素10 mg/L。
LB加葡萄糖(LBG)培養基:LB培養基添加葡萄糖5 g/L。
1.2 儀器與設備
恒溫培養箱(StabS2型):上海潤度生物科技有限公司;離心機(1-14型):德國 Sigma公司;電轉儀(MicroPulser):美國Bio-Rad公司;生物傳感分析儀(S-10):深圳市西爾曼科技有限公司。
1.3 方法
1.3.1 海藻糖酶表達質粒構建
利用基因組提取試劑盒提取E.coli BL21基因組并冷凍保存。利用引物19-trl-Hind III F(5′-CCCAAGCTTAAAGGAGGGAAATCATGCTCAATCAGAAAATTCAAAACC-3′)和 19-trl-EcoR I R(5′-CCGGAATTCTTATGGTTCGCCGTACAAACC-3′)和PCR試劑盒以E.coli BL21基因組為模板PCR擴增E.coli BL21海藻糖酶編碼基因trl,并利用基因膠回收純化試劑盒進行trl基因純化。利用EcoR I和Hind III限制性內切酶酶切pXMJ19質粒和trl基因,酶切后產物利用基因膠回收純化試劑盒進行純化。然后,利用基因連接試劑盒將酶切純化后的pXMJ19質粒片段和trl基因片段進行連接。連接產物轉化E.coli DH5α感受態,涂布LB氯霉素平板并于37℃培養12 h。挑取轉化子利用液體LB氯霉素培養基37℃振蕩培養12 h,利用質粒提取試劑盒提取質粒,并利用EcoR I和Hind III限制性內切酶酶切驗證。將驗證正確連接的質粒命名為pXMJ19-trl質粒。
1.3.2 表達海藻糖酶重組C.glutamicum Cgtrl構建
利用電轉化方法將pXMJ19-trl質粒轉入C.glutamicum ATCC13032菌株,構建表達海藻糖酶重組菌株 Cgtrl。取 2 μL pXMJ19-trl質粒加入 100 μL C.glutamicum ATCC13032感受態,1 800 V、5 ms電擊。電擊后涂布于LBG氯霉素平板,30℃培養。長出的轉化子菌落即為含有pXMJ19-trl質粒的重組菌株Cgtrl。將重組菌株Cgtrl菌落劃線至LBG氯霉素平板,30℃培養36 h,培養好的平板可直接用于后續試驗或者置于冰箱冷藏保存。
1.3.3 重組菌株Cgtrl海藻糖酶誘導表達和誘導表達條件優化
重組菌株Cgtrl冷藏保存的平板重新劃線至LBG氯霉素平板進行30℃培養36 h。利用接種環在培養好的平板上劃取滿環菌苔接種至10 mL LBG氯霉素液體培養基中,30℃、180 r/min培養12 h,獲得種子液。然后,取1 mL種子液接入50 mL LBG氯霉素液體培養基中,30℃、180 r/min培養3 h后加入0.5 mmol/L IPTG,繼續25℃、180 r/min培養7 h,誘導海藻糖酶表達。然后收集菌體,進行細胞破碎及蛋白電泳分析。
采用改變單因子的方法對誘導條件進行優化。添加不同濃度 IPTG(0.3、0.4、0.5、0.6 mmol/L),25 ℃、180 r/min誘導培養7 h,優化誘導劑添加量。添加0.5 mmol/L IPTG 后,在不同溫度(16、19、22、25、28 ℃)下180 r/min誘導培養7 h,優化誘導溫度。添加0.5 mmol/L IPTG后,在22℃、180 r/min誘導培養不同時間(7、12、17、22 h),優化誘導時間。海藻糖酶酶活力為單位體積發酵液中的酶活力(U/mL),根據相應體積發酵液菌體稀釋或濃縮倍數折算得出。
1.3.4 海藻糖酶酶液制備
重組菌株Cgtrl海藻糖酶誘導表達結束后,離心(8 000×g,5 min,4℃)收集菌體。利用原培養液體積一半的50 mmol/L pH7.0磷酸鉀緩沖液懸浮菌體,冰浴條件下超聲破碎細胞。細胞破碎液離心(8 000×g,5 min,4℃),所得上清即為海藻糖酶酶液。
1.3.5 海藻糖酶酶活力測定
利用50 mmol/L的pH7.0磷酸鉀緩沖液配制10 g/L海藻糖溶液,30℃預熱10 min的5 mL海藻糖溶液中加入50 L海藻糖酶酶液,30℃反應10 min后沸水浴5 min。利用生物傳感分析儀檢測反應液中生成的葡萄糖濃度。
海藻糖酶酶活定義:每分鐘水解1 μmol海藻糖生成2 μmol的葡萄糖所需的酶量定義為一個酶活力單位(1U)。海藻糖酶比酶活為每毫克蛋白中所含的酶活力。
1.3.6 重組海藻糖酶酶學性質
1)底物特異性
利用50 mmol/L的pH7.0磷酸鉀緩沖液配制10 g/L海藻糖、麥芽糖、蔗糖、乳糖、纖維二糖溶液,按照1.3.5方法測定海藻糖酶酶活力。
2)溫度對重組海藻糖酶活力的影響
海藻糖溶液分別在 30、35、40、45、50、55、60、65、70℃水浴中預熱30 min,然后每5 mL預熱好的海藻糖溶液加入25 L海藻糖酶酶液,繼續在各溫度下反應10 min。將最高酶活設置為100%。
3)重組海藻糖酶溫度穩定性
重組海藻糖酶酶液加入10%體積的甘油,然后分別放置于-20、5、20、30、40、45 ℃溫度下,取樣按照1.3.5方法測定海藻糖酶酶活力。將初始酶活設置為100%。
4)pH值對重組海藻糖酶活力的影響
利用pH5.8~7.8的50 mmol/L磷酸鉀緩沖液溶解海藻糖,配制不同pH值的10 g/L海藻糖溶液。每5 mL不同pH值的海藻糖溶液加入25 L海藻糖酶酶液,45℃反應10 min。將最高酶活力設置為100%。
5)海藻糖水解率
利用50 mmol/L pH6.6磷酸鉀緩沖液將重組海藻糖酶酶液稀釋至8 000 U/L(45℃、pH6.6條件下酶活力)。利用50 mmol/L pH6.6磷酸鉀緩沖液配制0.25、0.5、1、2、4 g/L海藻糖溶液。取0.5 mL海藻糖溶液加入0.5 mL8000U/L的重組海藻糖酶酶液,45℃反應5min。根據產生的葡萄糖濃度計算海藻糖水解率。

式中:342為海藻糖相對分子質量,360為兩分子葡萄糖的相對分子質量。
2 結果與分析
2.1 重組菌株Cgtrl構建及海藻糖酶表達
圖1為pXMJ19-trl質粒單雙酶切驗證圖。
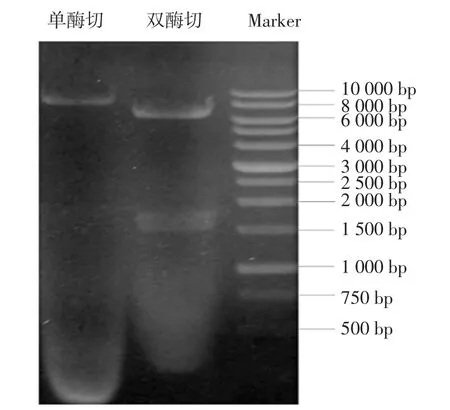
圖1 pXMJ19-trl質粒酶切Fig.1 Restriction enzyme digestion of pXMJ19-trl plasmid
E.coliBL21海藻糖酶編碼基因trl長度為1650bp。由圖1可以看出,雙酶切出現大小正確的條帶,因此pXMJ19-trl質粒構建成功。海藻糖酶蛋白分子量為63.7 kD,由圖2蛋白可知,在66 kD位置附近出現明顯加粗的蛋白條帶。酶活分析表明C.glutamicum ATCC13032細胞破碎液中無海藻糖酶活力,重組菌株Cgtrl細胞破碎液中海藻糖酶活力為10.2 U/mg蛋白。結果表明,過表達海藻糖酶重組菌株Cgtrl構建成功。
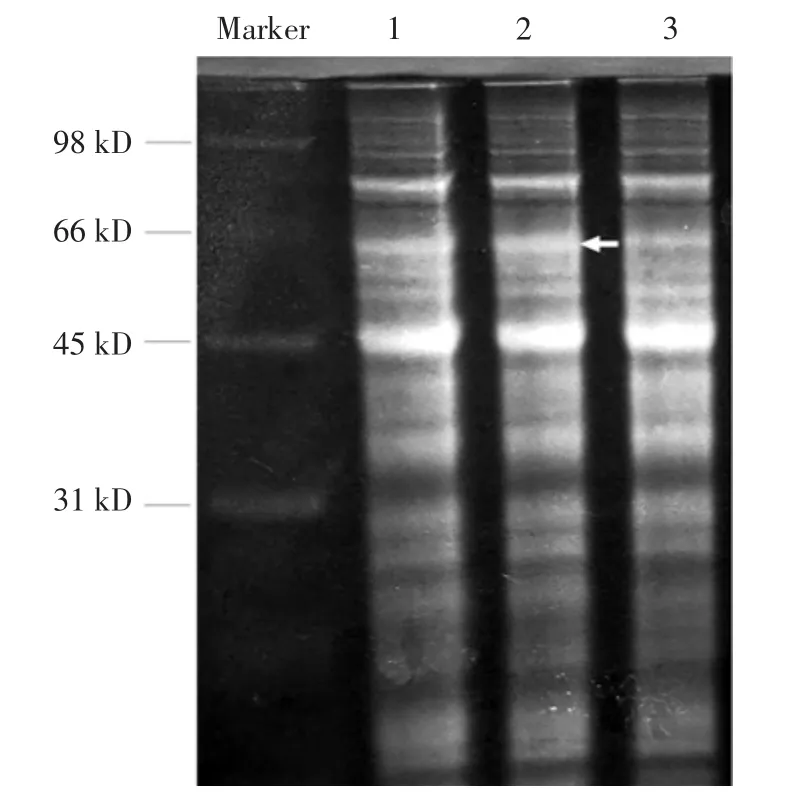
圖2 重組菌株Cgtrl蛋白電泳分析Fig.2 Protein electrophoresis of recombinant strain Cgtrl
2.2 重組菌株Cgtrl海藻糖酶誘導表達條件優化
2.2.1 IPTG添加量對海藻糖酶表達的影響
IPTG添加量對海藻糖酶表達的影響如圖3所示。
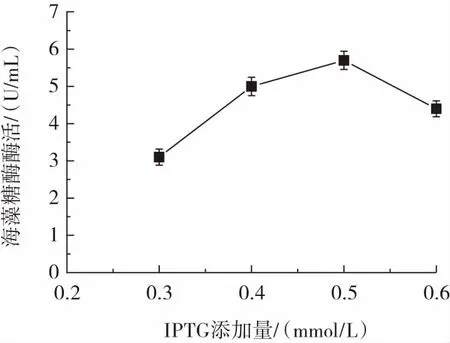
圖3 IPTG添加量對海藻糖酶表達的影響Fig.3 The effect of IPTG additive amount on trehalase expression
由圖3可知,當IPTG添加量為0.5 mmol/L時,重組菌株Cgtrl細胞破碎液中海藻糖酶酶活力最高,達到5.7 U/mL。IPTG添加量過低則誘導效率低,不利于酶的表達。同時,IPTG對微生物細胞具有一定毒性,過量添加同樣不利于海藻糖酶的表達[25]。因此,最適IPTG添加量為0.5 mmol/L。
2.2.2 誘導溫度對海藻糖酶表達的影響
誘導溫度對海藻糖酶表達的影響如圖4所示。
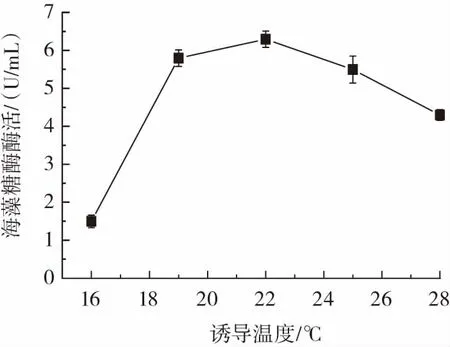
圖4 誘導溫度對海藻糖酶表達的影響Fig.4 The effect of induction temperature on trehalase expression
由圖4可知,當誘導溫度為22℃時,海藻糖酶酶活力最高,達到6.3 U/mL。溫度過低,細胞代謝減慢,不利于酶的合成。而溫度偏高,則有可能形成包涵體或者加快酶的變性失活,導致酶活力降低[16]。因此,誘導溫度選擇22℃。
2.2.3 誘導時間對海藻糖酶表達的影響
誘導時間對海藻糖酶表達的影響如圖5所示。

圖5 誘導時間對海藻糖酶表達的影響Fig.5 The effect of induction time on trehalase expression
由圖5可知,當誘導時間為12 h時,海藻糖酶酶活最高,達到9.1 U/mL。誘導時間過長,海藻糖酶酶活力基本不再增加。這是由于重組菌株誘導培養時間過長時,培養基中的營養物質耗盡,菌株合成代謝和酶的表達停止。因此,誘導時間選擇12 h。
2.3 重組海藻糖酶酶學性質研究
2.3.1 重組海藻糖酶底物特異性
重組海藻糖酶催化不同底物水解產生葡萄糖的研究結果如圖6所示。
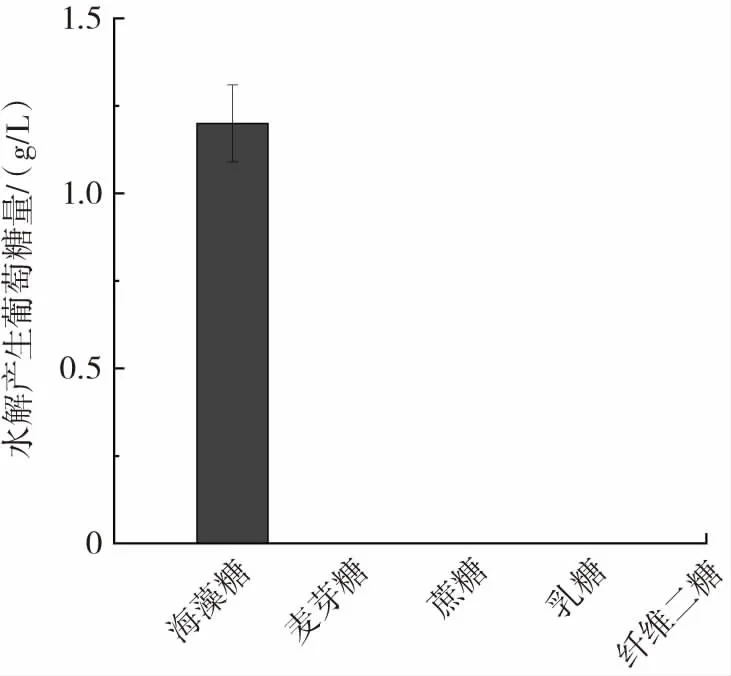
圖6 重組海藻糖酶底物特異性Fig.6 The substrate specificity of recombinant trehalase
由圖6可知,相同條件下,重組海藻糖酶不能催化麥芽糖、蔗糖、乳糖、纖維二糖水解產生葡萄糖。因此,重組海藻糖酶具有較好的底物特異性。較好的底物特異性能夠為重組海藻糖酶的特殊應用奠定基礎,如應用于海藻糖的檢測[11],可避免受到其他糖類的干擾。
2.3.2 反應溫度對重組海藻糖酶活力的影響
反應溫度對重組海藻糖酶活力的影響如圖7所示。
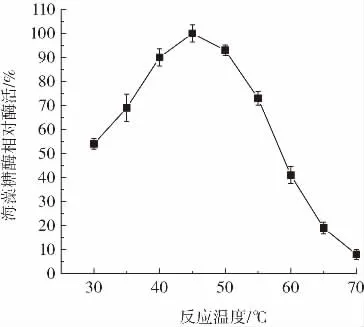
圖7 反應溫度對重組海藻糖酶活力的影響Fig.7 The effect of temperature on recombinant trehalase activity
由圖7可知,45℃重組海藻糖酶活力最高,海藻糖酶活力隨溫度降低而逐漸降低,30℃條件下海藻糖酶活力降低約50%。反應溫度高于45℃時,隨溫度升高海藻糖酶活力逐漸降低,70℃下海藻糖酶基本失去活力。
2.3.3 重組海藻糖酶溫度穩定性
重組海藻糖酶溫度穩定性如圖8和圖9所示。
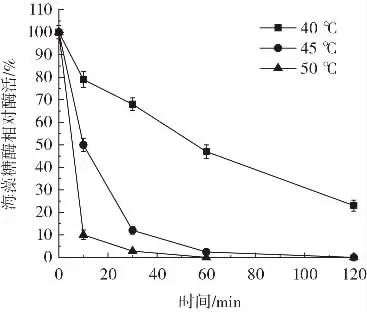
圖8 高溫條件下重組海藻糖酶溫度穩定性Fig.8 The temperature stability of recombinant trehalase under high temperature conditions
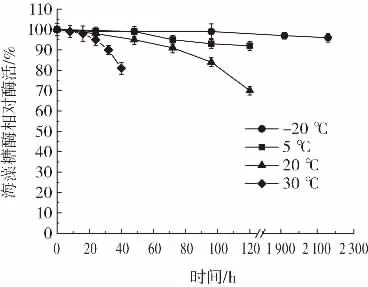
圖9 低溫條件下重組海藻糖酶溫度穩定性Fig.9 The temperature stability of recombinant trehalase under low temperature conditions
由圖8和圖9可知,重組海藻糖酶在40℃下半衰期為1 h,在45℃下半衰期為10 min,在50℃下保存10 min后酶活降低90%。結果表明,高溫(40℃~50℃)條件下重組海藻糖酶穩定性較差容易變性失活,這與E.coli str.K-12 substr.MG1655來源的海藻糖酶性質相近[16]。酶液中加入10%體積的甘油后,-20℃冷凍保存90 d酶活無明顯降低,5℃冷藏保存5 d、20℃存放3 d、30℃存放32 h酶活均維持在90%以上。該結果表明,未經純化的重組海藻糖酶低溫(-20℃~30℃)條件下穩定性較好,可長時間保存。這應該是由于C.glutamicum蛋白水解酶活性低,有利于重組海藻糖酶長時間保存[23]。
2.3.4 pH值對重組海藻糖酶活力的影響
反應體系pH值對重組海藻糖酶活力的影響如圖10所示。
由圖10可知,重組海藻糖酶最適作用pH值為6.6。pH值小于6.6時,海藻糖酶活力隨pH值降低而逐漸降低。pH值高于6.6時,海藻糖酶活力隨pH值升高而逐漸降低。說明偏酸性條件有利于海藻糖酶催化反應。
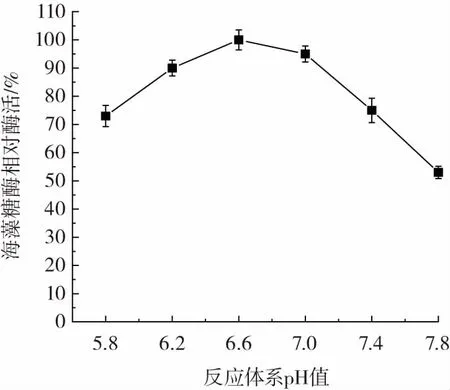
圖10 pH對重組海藻糖酶活力的影響Fig.10 The effect of pH on recombinant trehalase activity
2.3.5 重組海藻糖酶海藻糖水解率
重組海藻糖酶海藻糖水解率如圖11所示。

圖11 重組海藻糖酶海藻糖水解率Fig.11 The trehalose hydrolysis ratio of recombinant trehalase
由圖11可知,重組海藻糖酶催化海藻糖水解反應5 min后海藻糖水解率均達到96%以上。在分析重組海藻糖酶海藻糖水解率過程中,反應體系中海藻糖濃度分別為 0.125、0.25、0.5、1、2 g/L,反應體系中海藻糖酶活力為4 000 U/L。反應體系中的海藻糖酶理論上每分鐘可水解 4000 μmol/L(1.37 g/L)海藻糖產生8 000 μmol/L(1.44 g/L)葡萄糖。該結果表明,當海藻糖濃度在0.125 g/L~2 g/L時,重組海藻糖酶能夠在較短時間較徹底地分解反應體系中的海藻糖。該催化特性能夠為利用重組海藻糖酶快速檢測較低濃度海藻糖奠定基礎[11]。對于較高濃度海藻糖的檢測,可以將樣品適當稀釋后再利用該重組海藻糖酶進行分析測定。同時,針對乙醇和谷氨酸等發酵生產過程中海藻糖積累和殘留問題[6,10],該重組海藻糖酶較高的海藻糖水解率有利于徹底水解生產過程中剩余海藻糖,在提高底物利用率和目標產品產率方面具有很大應用潛力。
3 結論
本文利用GRAS菌株C.glutamicum ATCC13032表達E.coli BL21來源海藻糖酶,對海藻糖酶表達條件和重組海藻糖酶酶學性質進行了研究。重組海藻糖酶最適表達條件:誘導劑IPTG添加量為0.5 mmol/L,誘導溫度為22℃,誘導時間為12 h。在最適表達條件下重組海藻糖酶酶活為9.1 U/mL。后期工作中,可對重組菌株培養基進行優化并采用補料發酵模式以進一步提高重組海藻糖酶酶活。未經純化的重組海藻糖酶具有較好的底物特異性,能專一性水解海藻糖,海藻糖水解率在96%以上,低溫條件下穩定性較好能夠長時間低溫保存,最適作用溫度為45℃,最適作用pH值為6.6。該重組海藻糖酶在海藻糖快速檢測和海藻糖降解利用方面具有良好的應用前景。由于C.glutamicum是GRAS生物安全菌株,利用C.glutamicum ATCC13032表達獲得的重組海藻糖酶具有良好的安全性,可用于食品行業。同時,重組海藻糖酶不用經過純化即可應用,有利于降低酶的生產和應用成本。

