電針耳迷走神經對斷奶前母本隔離模型小鼠焦慮、抑郁樣行為的影響
吳 楠,王 強,2,3,李永豐,2,3,吳宇蔚,2,3,喬海法,2,3,李國徽,4*,袁 偉,2,3*
1 陜西中醫藥大學針灸推拿學院,陜西 咸陽 712046;
2 陜西省針藥結合重點實驗室,陜西 咸陽 712046;
3 咸陽市神經生物學(針灸)重點實驗室,陜西 咸陽 712046;
4 寧夏醫科大學附屬銀川市中醫醫院,寧夏 銀川 750010
抑郁癥是以持續的情緒低落、興趣減退、失眠等為主要臨床表現的疾病[1]。世界衛生組織調查數據顯示,近年來抑郁癥的患病率呈上升趨勢,抑郁癥已經成為危害人類健康的主要疾病之一[2]。有研究發現,抑郁癥在發病年齡上呈現出年輕化趨勢,青少年抑郁癥的患病率為5%~8%[3],成為威脅青少年身心健康的主要疾病之一,其高患病率給患者及其家庭、社會都帶來了巨大的影響。由于兒童或青少年正處于生長發育的特殊階段,傳統單胺神經遞質類藥物以及選擇性5-羥色胺(5-hydroxytryptamine,5-HT)再攝取抑制劑類藥物的療效欠佳且具有一定的局限性。研究顯示,電針治療抑郁癥具有良好療效[4],且具有安全、經濟、毒副作用小等優勢,在情志類疾病的治療中應用較為廣泛。迷走神經耳支主要分布于耳甲區,治療抑郁癥時常將其作為針刺部位[5],但其具體作用機制尚不完全清楚。
有研究表明,5-HT和抑郁癥關系密切[6],而色氨酸羥化酶(tryptophan hydroxylase,TPH)是合成神經遞質5-HT過程中重要的酶,其中TPH2主要表達于腦干中縫神經元和腸道肌腸層神經元,是5-HT神經元的特異性標志物之一。中縫背核(dorsal raphe nucleus,DRN)中有大量5-HT神經元的表達[7],其活性水平降低會影響5-HT系統的穩定性,導致個體情緒的異常[8]。此外,壓力能顯著影響前額葉皮層(prefrontal cortex,PFC)的神經元活性,特別是早期生活壓力能顯著影響個體的行為及神經發育,嚴重影響其情緒,甚至可能誘發抑郁癥[9-10]。但是,電針耳迷走神經是否能改變DRN、PFC的腦區活性和DRN腦區的5-HT神經元數量,從而緩解焦慮、抑郁樣行為尚不清楚。本研究采取斷奶前母本隔離(preweaning maternal separation,PMS)C57BL/6小鼠模型模擬兒童抑郁癥,觀察電針耳迷走神經對PMS誘發的焦慮、抑郁樣行為的影響及其可能的作用機制,為電針耳迷走神經治療青少年抑郁癥提供理論依據。
1 材料與方法
1.1 實驗動物
本實驗采用SPF級C57BL/6小鼠的繁殖子代鼠,繁殖鼠購自西安交通大學醫學院動物中心,鼠齡7~8周,體質量(20±2)g,實驗動物生產許可證號:SCXK(陜)2018-001。飼養環境均為恒定濕度(50±10)%,恒定溫度(22±2) ℃,12 h晝夜交替照明(光照時間8:00—20:00),自由獲取食物和水。實驗過程嚴格按照科技部《關于善待實驗動物的指導性意見》《陜西省實驗動物管理辦法》執行。
1.2 主要試劑與設備
原癌基因蛋白(c-fos)抗體(美國Cell Signaling Technology公 司,生 產批 號:2250S);TPH2抗 體(美國Cell Signaling Technology公司,生產批號:33113ES60);Alexa Fluor 647山羊抗兔熒光二抗(上海翊圣生物科技有限公司,生產批號:33113ES60);多聚甲醛(國藥集團化學試劑有限公司,生產批號:30625-89);曠場實驗箱、高架十字迷宮、懸尾測試箱(深圳市瑞沃德生命科技有限公司);行為學記錄分析系統(荷蘭Noldus公司,型號:EthoVision);韓氏電針儀(南京濟生醫療科技有限公司,型號:HANS-200A);冰凍切片機(美國Thermo Scientific公司,型號:HM525NX);熒光顯微鏡(德國徠卡公司,型號:
S220)。
1.3 實驗動物分組和模型制備
將3只成年C57BL/6雄鼠與9只成年C57BL/6雌鼠隨機合籠(雄雌比1∶3),待雌鼠受孕后采用隨機數字表法分為對照組和母本隔離組,對照組常規飼養,正常提供食物和飲水。母本隔離組在造模完成后,其子代采用隨機數字表法分為模型組和電針組,每組10只。母本隔離組的母鼠生產后,母本正常照顧至出生第13天,從第14天開始每天將母鼠移出居住籠4 h,留幼仔單獨居住,4 h后將母鼠移回居住籠,直至21 d斷奶,通過曠場、高架十字迷宮測試來確定母本隔離模型制備是否成功[11]。
1.4 干預方法
模型建立后,電針組在異氟烷麻醉下進行電針干預。采用0.25 mm×13 mm不銹鋼針灸針進行針刺,平刺2 mm,針刺穴位參照《常用實驗動物針灸穴位圖譜及穴位》取雙側耳甲區,電針過程采用連續波,頻率2 Hz,強度1 mA,1次/d,10 min/次,6 d/療程,共干預2個療程。對照組、模型組參照電針組進行麻醉束縛,但不進行電針干預。
1.5 觀察指標
1.5.1行為學檢測 干預完成后采用曠場測試、高架十字迷宮測試、懸尾測試等方法對各組小鼠進行行為學測試。
1.5.1.1曠場測試 在曠場測試前2 h將小鼠放在行為測試房中適應環境,此后,將小鼠置于曠場實驗箱(40 cm×40 cm×40 cm)中進行曠場測試。小鼠頭部固定朝向同1個方向,自由活動10 min并記錄小鼠總移動距離及中心區域時間百分比。
1.5.1.2高架十字迷宮測試 在高架十字迷宮測試前2 h將小鼠放在行為測試房中適應環境,此后,將小鼠置于高架十字迷宮[2條開臂(30 cm×8 cm)、2條閉臂(30 cm×6 cm×15 cm)、中心區域(8 cm×8 cm)、距地面高度55 cm]中進行高架十字迷宮測試。小鼠頭部正對一側開臂方向,自由活動10 min,記錄小鼠在開臂花費時間、開臂總移動距離及進入開臂次數。
1.5.1.3懸尾測試 在懸尾測試前2 h將小鼠放在行為測試房中適應環境,此后,將小鼠置于懸尾實驗箱(30 cm×30 cm×50 cm)進行懸尾測試。將醫用膠帶粘貼在距離小鼠尾尖1 cm處并將小鼠懸掛在懸尾支架上,使小鼠鼻尖與設備臺面距離約35 cm。使用攝像機記錄小鼠6 min活動情況,對每只小鼠的活動時間進行統計分析。
每只小鼠完成以上3項測試后,均噴灑30%酒精去除小鼠在活動箱遺留的氣味,防止對下1只小鼠實驗結果造成干擾。
1.5.2腦組織c-fos及5-HT表達水平檢測 在行為學測試結束后,將小鼠單獨置于安靜環境90 min后取材。通過腹腔注射過量烏來糖致小鼠安樂死,使用0.9% NaCl溶液對小鼠心臟進行灌注,灌注至肝臟和四肢發白,右心耳無血液流出,將輸液管與4%多聚甲醛溶液連接。灌注完成后迅速將腦組織取出,置于4 %多聚甲醛溶液中固定24 h。將固定好的腦組織取出依次放入20%、30%蔗糖溶液中脫水,隨后將腦組織放入包埋盒中,滴入包埋劑用冰凍切片機連續切片(40 μm),收集 PFC、DRN腦區備用。切片用磷酸鹽緩沖液(phosphate buffered saline,PBS)洗3次,每次10 min。使用含3‰ triton X-100的山羊血清封閉1 h,滴加c-fos(1∶1 000)和TPH2(1∶1 000)一抗4 ℃冰箱孵育過夜,孵育完成后使用PBS溶液洗3次,10 min/次,滴加Alexa Fluor 647熒光二抗(1∶400)室溫孵育2 h,孵育完畢后使用PBS洗3次,10 min/次。4',6-二脒基-2-苯基吲哚(4',6-diamidino-2-phenylindole,DAPI)中孵育10 min,使用抗熒光淬滅封片劑封片,用熒光顯微鏡觀察PFC、DRN腦區c-fos和DRN腦區5-HT的表達,并在相應腦區選擇相同位置的典型區域(200 μm×200 μm)進行細胞數量統計。
1.6 統計學方法
采用SPSS 22.0統計軟件進行數據分析。計量資料符合正態分布者,數據以(xˉ±s)表示;組間比較采用單因素方差分析,組間兩兩比較采用Turky法。P<0.05表示差異具有統計學意義。
2 結 果
2.1 3組小鼠行為學指標比較
2.1.13組曠場實驗行為比較 3組總移動距離和中心區域時間百分比比較,差異均具有統計學意義(P<0.05);與對照組比較,模型組總移動距離和中心區域時間百分比均明顯降低,差異均具有統計學意義(P<0.05);與模型組比較,電針組總移動距離和中心區域時間百分比均明顯更高,差異均具有統計學意義(P<0.05)。見圖1、表1。

圖 1 3組小鼠曠場活動軌跡圖Figure 1 Representative tracing of movement in the open field in three groups

表1 3組曠場測試檢測指標比較(xˉ±s)Table 1 Comparison of detection indicators in open field in three groups (xˉ±s)
2.1.23組高架十字迷宮行為比較 3組開臂花費時間、開臂總移動距離及進入開臂次數比較,差異均具有統計學意義(P<0.05);與對照組比較,模型組開臂花費時間、開臂總移動距離及進入開臂次數均明顯降低,差異均具有統計學意義(P<0.05);與模型組比較,電針組開臂花費時間、開臂總移動距離及進入開臂次數均明顯更高,差異均具有統計學意義(P<0.05)。見圖2、表2。

表2 3組高架測試檢測指標比較(xˉ±s)Table 2 Comparison of test indexes in the elevated maze in three groups (xˉ±s)

圖2 3組高架十字迷宮活動軌跡圖Figure 2 Representative tracing of movement in the elevated maze in three groups
2.1.33組懸尾測試行為比較 3組小鼠懸尾靜止時間比較,差異具有統計學意義(P<0.05);與對照組比較,模型組懸尾靜止時間明顯增加,差異具有統計學意義(P<0.05);與模型組比較,電針組懸尾靜止時間明顯更低,差異具有統計學意義(P<0.05)。見圖3、表3。

圖 3 3組懸尾測試熱區圖Figure 3 Heat maps in the tail suspension test in three groups

表3 3組懸尾測試指標比較(xˉ±s)Table 3 Comparison of suspension tail test indexes in three groups (xˉ±s)
2.2 3組DRN、PFC腦區c-fos表達水平比較
3組DRN、PFC腦區c-fos陽性神經元數量比較,差異均具有統計學意義(P<0.05);與對照組比較,模型組DRN、PFC腦區c-fos神經元數量均明顯降低,差異均具有統計學意義(P<0.05);與模型組比較,電針組DRN、PFC腦區c-fos神經元數量均明顯更高,差異均具有統計學意義(P<0.05)。見表4、圖4~5。

圖4 3組小鼠DRN腦區c-fos表達(×20)Figure 4 Expression of c-fos in the DRN in three groups (×20)

表4 3組DRN、PFC腦區c-fos陽性細胞數量比較(xˉ±s)Table 4 Comparison of the number of c-fos positive cells in the DRN,PFC in three groups (xˉ±s)
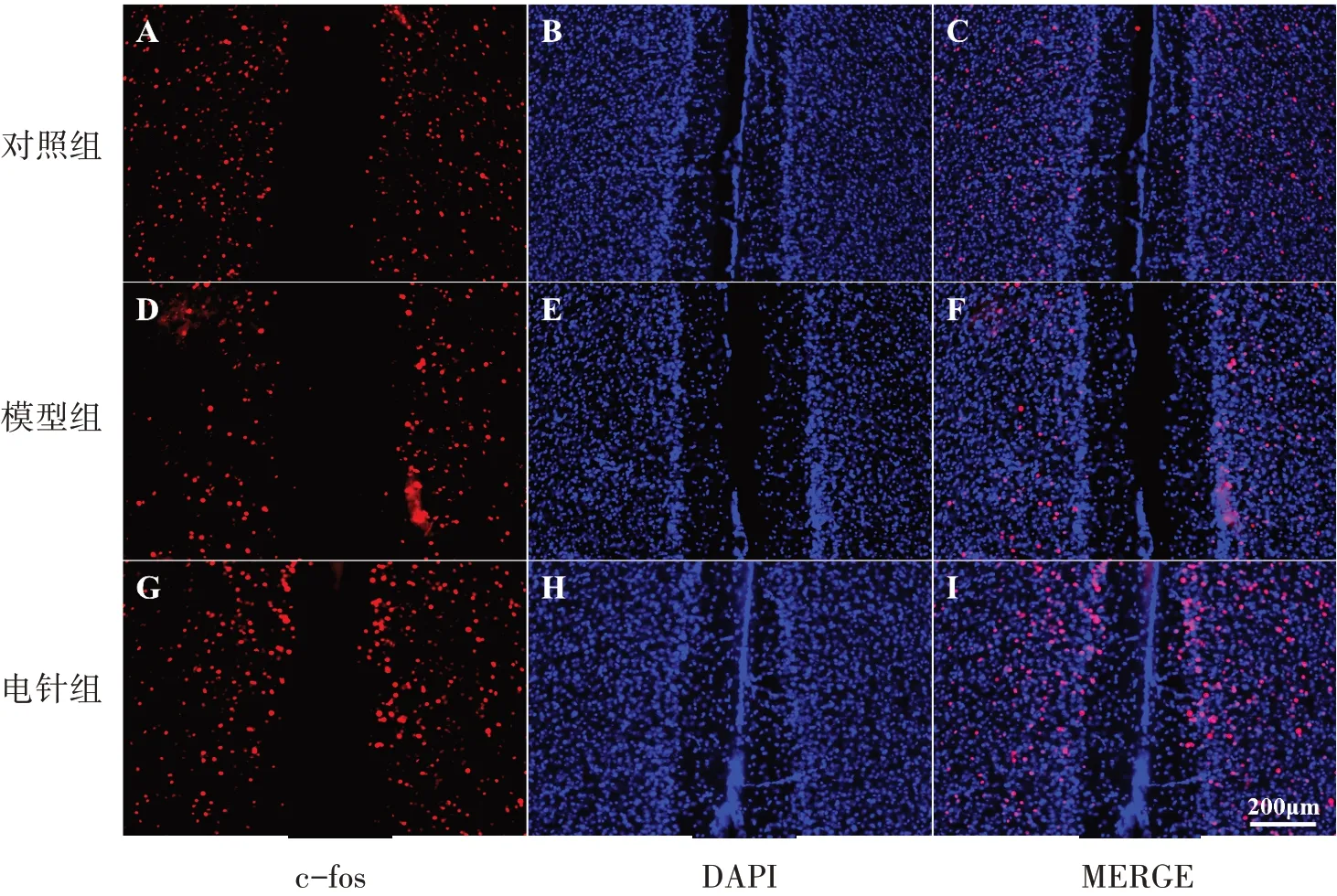
圖5 3組小鼠PFC腦區c-fos表達(×20)Figure 5 Expression of c-fos in the PFC in three groups (×20)
2.3 3組5-HT神經元數量比較
3組小鼠DRN腦區5-HT陽性神經元數量比較(P<0.05);與對照組比較,模型組DRN腦區5-HT神經元數量明顯降低(P<0.05);與模型組比較,電針組DRN腦區5-HT神經元數量明顯更高,差異具有統計學意義(P<0.05)。見圖6、表5。

圖6 3組DRN腦區5-HT神經元表達(×20)Figure 6 Expression of 5-HT neurons in the DRN in three groups (×20)

表5 3組DRN腦區5-HT神經元數比較(xˉ±s)Table 5 Comparison of the number of 5-HT neurons in DRN in three groups(xˉ±s)
3 討 論
3.1 電針耳迷走神經可改善PMS模型小鼠焦慮、抑郁樣行為
通過曠場和高架十字迷宮測試可以檢測小鼠的焦慮樣行為[12],懸尾測試反映小鼠的抑郁樣行為[13]。本研究結果顯示,PMS可以減少C57BL/6小鼠在曠場測試中總移動距離、中心區域時間百分比;減少高架十字迷宮測試中開臂花費時間、開臂總移動距離及進入開臂次數;增加懸尾測試中懸尾靜止時間。通過電針耳迷走神經干預后,電針組中心區域時間百分比和開臂花費時間均高于模型組,懸尾靜止時間低于模型組,這提示電針迷走神經干預可改善PMS所致小鼠焦慮、抑郁樣行為。這可能與以下因素有關:① 早期的生活經歷與個體的行為及神經發育密切相關[14],PMS可引起個體焦慮及抑郁樣行為的發生,其作為一種慢性應激壓力,誘發了小鼠焦慮、抑郁樣行為的產生。抑郁癥在中醫學中屬于“郁證”的范疇,情思憂慮會導致氣行不暢,進而導致抑郁癥的出現[15]。耳穴中心、神門穴等位于耳甲區,刺激以上穴位分區可改善氣機郁滯,調整相應的臟腑功能。② 耳甲區分布著豐富的迷走神經,電針刺激耳甲區迷走神經,可影響迷走神經所屬的副交感神經系統,令其與交感神經系統共同調節機體內分泌系統的功能,從而改善個體情志狀態。
3.2 電針耳迷走神經改善PMS所致焦慮、抑郁樣行為可能與調節c-fos及5-HT的表達有關
本研究結果顯示,PMS可使小鼠PFC、DRN腦區的c-fos表達水平降低,DRN腦區5-HT神經元數量明顯降低。電針耳迷走神經后,電針組PFC、DRN腦區c-fos表達水平明顯上升,DRN腦區5-HT神經元數量明顯升高,這提示電針耳迷走神經改善PMS所致焦慮、抑郁樣行為可能與調節c-fos和5-HT的表達有關。這可能與以下因素有關:① 親本照顧缺失作為一種早期生活壓力對PFC、DRN腦區可產生持續性影響[16-17],PMS小鼠PFC腦區活性、體積和厚度均明顯減少[18]。電針刺激耳甲區可激活PFC腦區,促進神經元c-fos的表達,有利于受損神經元的修復,從而改善PMS小鼠抑郁樣行為。這與FUCHIKAMI等[19-21]研究結果一致。② PMS小鼠DRN腦區5-HT神經元數量明顯減少[22-24],DRN腦區5-HT神經元可投射到前腦邊緣區及大腦皮層,其神經元功能低下是抑郁癥的病理、生理基礎[25-26]。電針耳迷走神經干預后,TPH2的神經元表達水平提高,這提示電針刺激耳迷走神經使PMS小鼠5-HT神經元數量明顯增加,DRN腦區5-HT系統趨于穩定,從而改善其焦慮、抑郁樣情緒,這一改善可能依賴于調整5-HT相關受體的功能。其中,5-HT1A型受體(serotonin1Areceptor,5-HT1AR)是與抑郁癥關系最密切的受體之一,在PFC腦區大量表達[27-28]。但其是否通過調控5-HT1A型受體以改善PMS誘發的焦慮、抑郁樣行為尚不清楚,還需要下一步繼續深入研究。
4 小 結
電針耳迷走神經可以改善PMS小鼠焦慮、抑郁樣行為,其作用機制可能與改善c-fos表達水平,增加DRN腦區5-HT神經元的數量相關。

