囊腔液mtDNA水平對0PN來源囊胚發育速度的影響
趙海靜,袁萍,黃佳,邱綺,張清學,王文軍
(中山大學孫逸仙紀念醫院生殖中心,廣州 510120)
在常規體外受精(IVF)過程中,原核觀察是目前評估受精與否的常用方法。通常在授精后16~20 h于倒置顯微鏡下觀察,正常受精卵有兩個清晰原核(2PN),不具有2PN的均為異常受精。在光學顯微鏡下,異常受精的表現形式主要有:零原核(0PN)、單原核(1PN)和多原核(多PN)受精卵。IVF過程中約30%的卵母細胞表現為0PN受精,其原因可能是卵母細胞受精失敗,也可能是雌雄原核過早融合,導致原核消失[1]。如未觀察到原核的受精卵在后續發育中其卵裂速度及卵裂球形態與觀察到2PN的受精卵發育而來的胚胎沒有差異,稱之為0PN來源胚胎[1]。依據歐洲人類生殖與胚胎學會實驗室指南,不建議移植0PN來源胚胎[2]。然而大量的細胞遺傳學分析結果顯示,部分0PN來源胚胎為二倍體胚胎,并且有4.4%~37.2%的0PN來源胚胎能夠發育為優質囊胚[3-5]。這些研究表明0PN來源胚胎仍具有一定的臨床應用價值。因此,我中心對于0PN來源胚胎(本文中所提及的0PN來源胚胎特指0PN來源卵裂期胚胎)的處理是,如果第3天(D3)發育到4細胞及以上,則進行囊胚培養,如D5或D6形成評分3CC以上囊胚者視為可利用囊胚,進行冷凍保存。
近期的一項薈萃分析顯示,無論是新鮮周期還是凍融周期,D5囊胚移植的種植率、臨床妊娠率及出生率均顯著優于D6囊胚[6]。此外,僅對于整倍體囊胚移植的研究也表明,D5囊胚的移植結局顯著優于D6囊胚[7-8]。這些結論提示我們,除了內膜和染色體因素,還有其他重要因子影響著D6囊胚的潛能和發育。最近,滋養層細胞中線粒體DNA(mtDNA)數量被認為是胚胎選擇的另一個潛在標記物。Wu等[9]的研究結果表明,相同倍性D5囊胚中滋養層細胞mtDNA數量顯著多于D6囊胚(P<0.05);在妊娠結局相同的情況下,移植的D5囊胚中滋養層細胞mtDNA數量也顯著多于移植的D6囊胚(P<0.05),因此他們認為mtDNA數量可能是影響囊胚發育速度的一個關鍵因素。有趣的是,發育速度快的D5囊胚中mtDNA數量顯著多于發育速度慢的D5囊胚(P<0.05),D6囊胚中mtDNA數量亦呈現同樣的趨勢[10-11],這進一步體現了mtDNA數量在囊胚發育速度中的作用。但目前關于IVF中0PN來源囊胚的mtDNA數量與其發育速度之間的關系尚未見報導。
近年來,基于滋養層細胞活檢的植入前遺傳學檢測(PGT)廣泛用于胚胎非整倍體篩查。然而,滋養層細胞活檢的局限性在于:(1)對胚胎的有創活檢可能會降低其發育潛能;(2)要求胚胎學家具有豐富經驗和嫻熟技術;(3)活檢操作過程復雜;(4)由于內細胞團未經過檢測,嵌合體容易導致假陰性或假陽性結果;(5)活檢的長期生物安全性尚未評估[12-16]。而基于廢棄囊胚培養液的無創PGT也存在一些缺點,因為廢棄囊胚培養液比囊腔液具有更高的母源污染(顆粒細胞)風險,尤其是囊胚階段的廢棄培養液中會檢測到更高水平的母源核DNA[17-18]。在滋養層細胞連接處進行激光打孔以釋放囊腔液或使用注射針抽吸來獲取囊腔液[19-20],并以囊腔液為樣本進行mtDNA數量檢測的方法創傷小、操作簡易,還能有效避免母源顆粒細胞污染。因此,本研究首次以囊腔液為樣本,對IVF中0PN來源囊胚的mtDNA水平進行檢測及綜合分析,并進一步探索0PN來源囊胚中mtDNA水平與其發育速度之間的關系。
資料與方法
一、研究對象
回顧性分析2019年11月至2021年8月在本中心行常規IVF助孕治療的66對夫婦的臨床資料。納入標準:(1)D1原核觀察為0PN;(2)D5或D6囊胚評級為3CC級以上;(3)D5或D6囊胚留取囊腔液行整倍體檢測及mtDNA水平檢測;(4)男女雙方相關檢測及資料完整。排除標準:(1)D1的原核觀察為1PN、2PN、3PN或多PN;(2)D1卵母細胞形態學觀察為MI、GV期、出現退化或空透明帶;(3)D5或D6囊胚評級為3CC級及以下。本研究中所有樣本的使用均進行了充分地知情告知,并簽署知情同意書,且研究的開展獲得了醫院倫理委員會的審批通過。
本研究共納入66個助孕治療周期中的109枚0PN來源囊胚。根據囊胚發育速度不同進行分組,分為D5-0PN囊胚組(0PN來源胚胎在D5發育為可冷凍囊胚者,n=87)、D6-0PN囊胚組(0PN來源胚胎在D6發育為可冷凍囊胚者,n=22)。
二、研究方法
1.控制性促排卵(COH)及取卵:入組患者采用長方案或拮抗劑方案進行促排卵。陰道B超監測卵泡生長情況,當B超監測有1~2個卵泡直徑≥18 mm時給予肌肉注射HCG(珠海麗珠)10 000 U,注射后36~38 h在陰道B超引導下穿刺取卵。在體視顯微鏡下收集卵泡液中卵丘-卵母細胞復合物,并置于G-IVF液(Vitrolife,瑞典)中培養。
2.精液收集及處理:取卵當天男方以手淫法采集精液。待精液液化后,通過密度梯度離心及上游法處理,并調至統一的受精濃度(本中心所用濃度為0.3×106/ml)。
3.體外授精及原核觀察:卵母細胞經體外培養4~6 h進行IVF人工授精。授精16~20 h后進行原核觀察,未見原核者記錄為0PN,可見兩個原核者為2PN。
4.胚胎培養及發育評估:D1拆除顆粒細胞后,將胚胎轉移至G1-plus(Vitrolife,瑞典)培養液中,置于37℃、6%CO2、5%O2培養箱中培養。D3將胚胎轉移至G2-plus(Vitrolife,瑞典)培養液中進行囊胚培養。D5和D6分別評估囊胚發育,依據Gardner和Schoolcraft的評分系統[21],綜合囊胚擴張狀態、內細胞團和滋養層細胞的發育對囊胚質量進行全面評估。根據囊胚腔的大小和是否孵出將囊胚發育分為6個時期:1期:早期有腔室囊胚,囊胚腔體積小于胚胎總體積的1/2;2期:囊胚腔體積大于或等于胚胎總體積的1/2;3期:擴張囊胚,囊胚腔完全占據了胚胎的總體積;4期:囊胚腔完全充滿胚胎,胚胎總體積變大,透明帶變薄;5期:正在孵出,囊胚的一部分從透明帶中逸出;6期:孵出囊胚,囊胚全部從透明帶中逸出。處于3~6期的囊胚,還需對內細胞團和滋養層細胞進行質量分級。其中,內細胞團分級:A級:細胞數目多,排列緊密;B級:細胞數目少,排列松散;C級:細胞數目很少。滋養層細胞分級:A級:上皮細胞層由較多的細胞組成,結構致密;B級:上皮細胞層由不多的細胞組成,結構松散;C級:上皮細胞層由稀疏的細胞組成,細胞很少。本中心可利用囊胚的定義為:透明帶擴張程度≥3且內細胞團和滋養層細胞評分為CC以上;優質囊胚的定義為:透明帶擴張程度≥3且內細胞團和滋養層細胞評分為BB及以上。
5.囊腔液收集:為了避免母源顆粒細胞污染,將D3的0PN來源胚胎轉移到不同的G2-plus液滴(預平衡)中潤洗多次以除去透明帶上的顆粒細胞,再移入新的G2-plus液滴中進行囊胚培養。D5或D6丟棄最初用于囊胚培養的液滴,將0PN來源囊胚轉移到不同的新鮮G2-plus液滴(預平衡)中潤洗3次以再次完全除去透明帶上松散的顆粒細胞,隨后把0PN來源囊胚轉移到另一個新鮮的15 μl G2-plus液滴中,用200 μs激光脈沖(LYKOS,Hamilton Thorne,美國)在滋養層細胞連接處打孔以釋放囊腔液。激光打孔4~6 h后,將0PN來源囊胚進行玻璃化冷凍,收集囊腔液與G2-plus液滴的混合液裝入含有5 μl磷酸鹽緩沖液(PBS)的無RNAse/DNAse小管中(江蘇億康基因)(具體收集方法參考Jiao等[19]的方法),做好樣本標記后置于-80℃冰箱保存,之后將冷凍樣本交由江蘇億康基因公司進行后續檢測。使用未經胚胎培養的G2-plus液滴作為陰性對照。
6.0PN來源囊胚染色體整倍體及mtDNA含量檢測:使用基于單細胞的多次退火環狀循環擴增技術(簡稱MALBAC)對囊腔液樣本進行全基因組擴增(江蘇億康基因)。通過NextSeq550測序儀(Illumina,美國)進行第二代測序分析,用于全面染色體篩查。以常染色體擴增拷貝為基礎,根據測序比對的序列數和區域數來分析單核基因組下線粒體的拷貝。線粒體含量以拷貝數/核基因組的形式進行量化。對比對到線粒體基因組的測序讀取序列進行計數,并通過比對到常染色體的讀取序列計數進行均一化,參考前期文獻[22]公式計算每個核基因組的線粒體拷貝數。
7.觀察指標:記錄兩組患者的年齡、不孕年限、體質量指數(BMI)、基礎生殖激素(FSH、LH、E2)水平、抗苗勒管激素(AMH)、基礎竇卵泡計數(AFC)、Gn總量、獲卵數、精子正常形態率、頂體酶活性、囊胚整倍體率、優質囊胚率及囊腔液mtDNA數量。
三、統計學分析

結 果
一、患者一般資料分析
比較D5-0PN囊胚組與D6-0PN囊胚組患者的基本信息和臨床資料,結果顯示D5-0PN囊胚組的女方年齡和Gn總量均顯著低于D6-0PN囊胚組(P<0.05),D5-0PN囊胚組的男方年齡極顯著低于D6-0PN囊胚組(P<0.01)。兩組患者的不孕年限、BMI、基礎生殖激素(FSH、LH、E2)水平等均無統計學差異(P>0.05)(表1)。
二、D5-0PN囊胚與D6-0PN囊胚整倍體率、優質囊胚率及女方高齡率比較
D5-0PN囊胚和D6-0PN囊胚的整倍體率比較無顯著性差異(P>0.05);D5-0PN囊胚組的優質囊胚率極顯著高于D6-0PN囊胚組(P<0.01)。為了排除女方高齡對mtDNA水平的影響,參照之前的文獻[9,23]選擇40歲作為本研究中高齡女性的界限,比較兩組間來自高齡女性(≥40歲)的囊胚比例,結果無顯著性差異(P>0.05)(表2)。
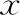
表1 兩組患者一般資料比較(-±s)

表2 D5-0PN囊胚與D6-0PN囊胚的整倍體率、優質囊胚率及高齡率比較(%)
三、不同分層下D5-0PN囊胚與D6-0PN囊胚mtDNA水平比較
比較整倍體囊胚與非整倍體囊胚、<40歲與≥40歲女性、優質囊胚與非優質囊胚中mtDNA的水平。D5-0PN囊胚中整倍體囊胚35枚,D6-0PN囊胚中整倍體囊胚11枚;在相同倍性(均為整倍體或均為非整倍體)情況下,D5-0PN囊胚的mtDNA水平均略高于D6-0PN囊胚,但尚無顯著性差異(P>0.05)。D5-0PN囊胚中來源于<40歲女性者85枚,D6-0PN囊胚中來源于<40歲女性者20枚;在相同的囊胚發育時期,<40歲女性與≥40歲女性的0PN來源囊胚中mtDNA數量無顯著性差異(P>0.05);但無論<40歲或≥40歲女性,其D5-0PN囊胚中mtDNA水平均略高于D6-0PN囊胚(P>0.05)。D5-0PN囊胚中優質囊胚(評級≥3BB)58枚,D6-0PN囊胚中優質囊胚6枚;在相同發育時期,優質0PN來源囊胚中mtDNA水平略高于非優質0PN來源囊胚,但尚無顯著性差異(P>0.05);且無論囊胚質量如何,D5-0PN囊胚中mtDNA水平均略高于D6-0PN囊胚(P>0.05)(表3)。
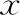
表3 不同分層下D5-0PN囊胚與D6-0PN囊胚mtDNA水平比較(-±s)
討 論
0PN來源胚胎的臨床應用價值一直存在爭議,因為無法確定0PN來源胚胎源自于正常受精或異常受精[24]。我們中心的常規策略是將0PN來源胚胎進行囊胚培養,若形成可利用囊胚則冷凍保存。在患者無2PN來源囊胚可移植的情況下,移植0PN來源囊胚以增加妊娠機會。考慮到0PN可能為異常受精,所以0PN來源胚胎的移植應該盡可能地結合PGT[5]。目前廣泛應用的PGT方法是對囊胚滋養層細胞進行活檢,然而這種方法存在活檢工作量大、耗費成本較高、有創、取樣有偏倚(只檢測滋養層細胞而沒有檢測內細胞團)等缺點[25]。廢棄囊胚培養液是無創PGT的首選材料,但具有較高的母源顆粒細胞污染風險,并且會檢測到更高水平的母源核DNA[17-18]。因此本研究選擇以囊腔液為樣本來分析0PN來源囊胚的染色體狀態。
滋養層細胞或培養液中mtDNA數量被認為是胚胎選擇的另一個潛在標記物[9,26]。早期胚胎中mtDNA數量的差異很可能起源于相應的卵母細胞[22]。有研究表明,卵母細胞質量與其所含有的mtDNA數量有著內在聯系。卵巢功能下降或高齡女性的卵母細胞中mtDNA數量顯著低于卵巢功能正常或年輕女性[27-29]。此外,未受精卵母細胞中mtDNA拷貝數也顯著低于受精卵母細胞[30-32],退化卵母細胞則含有更少的mtDNA[32]。mtDNA數量較多的卵母細胞具有更高的發育潛能[33],卵母細胞中線粒體儲備下降將引起植入前胚胎能量不足,進而導致胚胎發育阻滯[34]。充足的mtDNA水平提示卵母細胞質量好,這不僅有益于成功受精,而且對后期的胚胎發育至關重要。在胚胎發育過程中,線粒體平均分布于每個卵裂球,但是在囊胚階段之前,線粒體總數相對穩定[35],同樣線粒體的活性也相對穩定[34]。當胚胎發育到囊胚階段時,mtDNA大量復制,表明線粒體已完成從靜止到激活的轉變[36-37]。因此,我們推測囊胚期mtDNA數量也許有著某種重要的意義,同時啟發我們關注囊腔液中mtDNA水平。
Ho等[38]研究認為,從活檢的每個滋養層細胞中獲得的mtDNA拷貝數與從整個胚胎獲得的mtDNA拷貝數相當。這一研究證實了我們以囊腔液為樣本對0PN來源囊胚中mtDNA數量進行檢測及綜合分析的可行性。在Wu等[9]的報道中,調整了胚胎倍性、移植結局、女方年齡和囊胚質量這些混雜因素后,D5囊胚中mtDNA數量仍顯著高于D6囊胚(P<0.05)。我們的研究結果表現出了相似的趨勢:在相同倍性、女方年齡、囊胚質量的情況下,D5-0PN來源囊胚中mtDNA水平均有高于D6-0PN來源囊胚的趨勢,雖然尚無顯著性差異(P>0.05)。
有研究表明,囊腔液中游離DNA含量與胚胎等級呈正相關[39],而游離DNA由核DNA(nDNA)和mtDNA組成[40]。此外,Stigliani等[26]對人類胚胎的研究顯示,D3培養液中較高的mtDNA/nDNA比例提示較高的胚胎發育潛能。因此我們推測囊腔液中mtDNA含量可能與胚胎質量呈正相關。本研究中我們的數據顯示,D5-0PN來源囊胚中mtDNA水平略高于D6-0PN來源囊胚,同時D5-0PN囊胚組的優質囊胚率極顯著高于D6-0PN囊胚組(P<0.01);無論D5或D6,優質0PN來源囊胚的mtDNA水平均略高于非優質0PN來源囊胚;這些結果與我們的推測相符。
Wu等[9]認為影響囊胚發育速度的關鍵機制之一是卵母細胞中含有的最初mtDNA數量。那些含有充足mtDNA的卵母細胞將會“及時”形成囊胚,而那些mtDNA數量相對少的卵母細胞則需要額外時間以完成囊胚的發育過程。因此他們推測D6囊胚最初來源于mtDNA數量相對少的卵母細胞,由于能量不充足,所以需要額外1 d的時間去形成囊胚。這同樣適用于解釋0PN來源囊胚中mtDNA水平與其囊胚發育速度之間的關系。
綜上,本研究首次全面分析了囊腔液mtDNA水平與IVF中0PN來源囊胚發育速度之間的關系。綜合考慮胚胎倍性、女方年齡和囊胚質量等因素后,D5-0PN來源囊胚中mtDNA水平有高于D6-0PN來源囊胚的趨勢,提示mtDNA數量可能是影響0PN來源囊胚發育速度的一個關鍵因素,較低的mtDNA水平可能與0PN來源囊胚發育延遲相關。本研究的局限性在于樣本量較少,將來需要開展更大樣本量的研究以驗證本文的結論,從而更加深入地闡述0PN來源囊胚中mtDNA水平與其發育速度之間的關系。

