基于miR-146a/Sirt6 信號介導的自噬探討右美托咪定抗腸缺血再灌注的作用
周 瑜賈 靜王 璐周 敏
(西南醫科大學附屬醫院麻醉科,四川 瀘州 646000)
缺血再灌注(ischemia reperfusion,I/R)損傷是與高發病率和死亡率相關的常見病理過程,常繼發于多種嚴重疾病[1]。 I/R 損傷的發病機制是多因素的,包括過度的炎性細胞因子釋放、氧化應激和細胞凋亡[2-3]。 腸道I/R 可能導致腸道屏障功能受損,腸道通透性增加和腸道菌群易位,導致嚴重的局部和全身炎癥和多器官功能障礙綜合征[4]。 右美托咪定(dexmedetomidine,DEX)是一種具有鎮靜和鎮痛特性的α2-腎上腺素受體激動劑。 最近,DEX 已被鑒定為對多個器官的I/R 損傷具有保護潛力[5-6]。 研究發現,DEX 可以保持腸道結構完整性并賦予腸道保護免受I/R 損傷[7]。 然而,關于其潛在的機制仍然很大程度上未知。 microRNA(miRNA)作為一種小的非編碼RNA,通過抑制靶mRNA 的翻譯或穩定來調節轉錄后翻譯[8]。 最近,一項研究報道miR-146a 通過與IRAK1 的3’UTR 結合,可以抑制炎癥細胞浸潤,從而保護腎組織免受I/R 損傷[9]。 在腸道I/R 損傷方面,miR-146a 可通過調節自噬抑制腸上皮細胞凋亡,減輕I/R 過程中的腸道損傷[10]。 值得注意的是,最近兩項研究報道了DEX 通過靶向miR-146a 參與肺部和心臟保護[11-12]。 因此我們假設在腸道中,miR-146a 也可能在DEX 對I/R 損傷的保護功能中發揮作用,并旨在通過體內和體外研究評估它們之間的關系。
1 材料和方法
1.1 實驗材料
1.1.1 實驗動物
24 只SPF 級雄性SD 大鼠(體重200~220 g)購自北京華阜康生物科技股份有限公司[SCXK(京)2019-0004]。 大鼠喂養于西南醫科大學實驗動物中心[SYXK(川)2018-0003],實驗前2 周使大鼠適應實驗室條件((23±2)℃、12 h/12 h 光照/黑暗、(50±5)%濕度、隨意獲取食物和水)。 每籠飼養一只大鼠,實驗前禁食12 h。 動物實驗經西南醫科大學附屬醫院動物實驗倫理委員會審核批準(XNYKLY-2021-016),并嚴格遵循實驗動物使用的3R 原則。
IEC-6 細胞(大鼠小腸隱窩上皮細胞)獲自上海生命科學研究院,接種在含有5%胎牛血清(fetal bovine serum,FBS)和1%非必需氨基的Dulbecco’s Modified Eagle’s Medium(DMEM,美國Gibco 公司)中培養。 每2~3 d 更換1 次培養基,培養物保持在37℃含有5% CO2的飽和濕度環境中。
1.2 主要試劑與儀器
Hanks 平衡鹽溶液購自美國Gibco 公司;MTT試劑、Sirt6、HRP 偶聯的二抗購自美國Abcam 公司;TUNEL 染色檢測試劑盒購自德國Roche 公司;兔抗LC3 單克隆抗體購自武漢Proteintech 公司;TRIzol、lipofectamine 試劑購自美國 Invitrogen 公司;TransStart Top Green qPCR SuperMix 購自北京全式金生物技術有限公司;SYBRTMSelect Master Mix 購自美國Thermo 公司;PVDF 膜購自美國Millipore 公司;β-actin 購自美國CST 公司;miR-146a 抑制劑Opti-MEM 購自美國Ambion 公司。
DM4000B 光學顯微鏡購自德國Leica 公司,熒光顯微鏡購自日本Olympus 公司;RS232C 核酸測定儀購自德國Eppendorf 公司;7500 快速實時熒光定量PCR 系統購自美國Applied Biosystems 公司;ChemiDoc XRS 購自美國Bio-Rad 公司。
1.3 實驗方法
1.3.1 細胞氧-葡萄糖剝奪/復氧(oxygen-glucose deprivation/reoxygenation,OGD/R)模型和藥物治療
將IEC-6 細胞(每毫升5×103個)接種在96 孔板中,當80%匯合時,細胞加入DEX(0.5、1、2 μmol/L)處理1 h。 之后,將細胞培養基更換為不含葡萄糖的Hanks 平衡鹽溶液,并在37℃的加濕培養箱(1% O2、94% N2和5% CO2)中孵育4 h 模擬缺氧條件。 4 h 后,將培養基換回標準DMEM 培養基并在常氧環境下再維持2 h 來模擬復氧期[13]。 在沒有藥物處理的標準條件下培養的細胞用作對照。
為了考察miR-146a 抑制對DEX 保護作用的影響,將細胞實驗分為:Con 組、OGD/R 組、OGD/R+DEX 組、OGD/R+miR-146a 抑制劑組和OGD/R+DEX+miR-146a 抑制劑組。 除Con 組外,其他組建立OGD/R 模型。 OGD/R+miR-146a 抑制劑組和OGD/R+DEX+miR-146a 抑制劑組在建立OGD/R模型前,加入miR-146a 抑制劑處理24 h。
1.3.2 細胞活力測定
建立健全科學的施工責任制度是保證工程建設順利性的重要基礎。在實際建設時要建立起來相應的施工責任制度,這樣能夠有效提升施工安全管理水平。施工責任制度就是企業當中各個崗位責任制度之中的重要內容,它的有效落實能夠推動建筑行業的有序發展。具體來說就是要求施工現場的每一個人員都要明確自身的責任,使彼此之間能夠相互配合、協調工作,確保安全管理工作能夠落實到位。圖1是施工現場安全管理組織流程圖。
使用3-(4,5-二甲基-2-噻唑)-2,5-二苯基溴化四氮唑噻唑藍(3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide,MTT)測定法評估細胞活力。 在不同的時間點將MTT 試劑添加到每個孔中。 在37℃下用MTT 溶劑處理細胞3 h,并在OD 590 nm 處測量吸光度。
1.3.3 動物分組治療
動物被隨機分配到3 組,包括假手術組(Sham)、I/R 組和DEX 組,每組8 只大鼠。 I/R 組和DEX 組大鼠參照文獻方法[14]建立大鼠腸道I/R模型,具體操作為大鼠用異氟醚吸入麻醉。 中線剖腹探查后,夾住腸系膜上動脈并在1 h 后再灌注。DEX 組大鼠在缺血前30 min 以腹腔注射25 μg/kg DEX 藥物治療[14],和I/R 組注射0.9%生理鹽水治療。 Sham 組接受相同的麻醉和中線剖腹手術,但不夾住腸系膜上動脈。 再灌注后6 h 處死所有動物,取出腸組織進行生化分析。
1.3.4 組織病理學檢查大鼠腸組織用4%多聚甲醛固定,石蠟切片用蘇木精-伊紅(HE)溶液染色。 最后,通過DM4000B光學顯微鏡獲得染色圖像。 根據Chiu’s 評分[14]評估不同組的相對腸損傷程度。
1.3.5 TdT 介導的dUTP 缺口末端標記(TdTmediated dUTP Nick-End Labeling,TUNEL)分析
采用TUNEL 染色檢測試劑盒進行TUNEL 分析。 收集對數期的IEC-6 細胞并以每毫升1×105個細胞的密度接種在24 孔板中。 將濃度為2 μmol/L的DEX 加入細胞中預處理12 h。 OGD/R 損傷后,用PBS 清洗細胞,在12 孔板中加入10%甲醛固定20 min。 然后用PBS 沖洗3 次,用0.5% Triton-100滲透細胞10 min。 此外,為了檢測體內細胞凋亡,石蠟組織切片用二甲苯和不同梯度的乙醇脫蠟至水合。 PBS 沖洗3 次后,將細胞或組織切片加入100 μL(10 μL TdT + 95 μL 熒光素標記的dUTP 溶液)TUNEL 混合液中,在37℃濕暗箱中孵育1 h。陰性對照(Con)組加入100 μL 熒光素標記的dUTP溶液。 最后,使用熒光顯微鏡以200 倍放大倍率捕獲圖像。
1.3.6 免疫熒光測定
將腸組織切片水合并在檸檬酸鹽緩沖液中孵育,用于脫蠟后的抗原修復。 然后將樣品在室溫下用3% BSA 非特異性封閉2 h,在4℃濕暗箱中用兔抗LC3 單克隆抗體(稀釋比1 ∶100)孵育過夜。 用PBS 清洗3 次后,將切片與Alexa 熒光素標記的二抗孵育1 h,然后在37℃下用DAPI 溶液(5 μg/mL)染色10 min。 最后,通過熒光顯微鏡以200 倍放大率獲得免疫熒光圖像。 對于細胞分析,將IEC-6 細胞(每毫升1×105個細胞)接種在24 孔板中,然后用2 μmol/L 的DEX 預處理12 h。 接下來,細胞用4%多聚甲醛固定20 min,OGD/R 損傷后用0.5%Triton-100 沖洗10 min。 最后,將細胞與兔抗LC3 一起孵育,其余步驟與大鼠樣品相同。
1.3.7 定量實時PCR 檢測
使用TRIzol 試劑從IEC-6 細胞和大鼠腸組織中分離總RNA,并使用RS232C 核酸測定儀測定總RNA 的濃度。 然后使用TransStart Top Green qPCR SuperMix 將總共1000 ng RNA 被逆轉錄為cDNA,并使用SYBRTMSelect Master Mix 在7500 型實時熒光定量PCR 系統上進行實時定量分析。 本研究中基因的引物序列如下:U6:5’-UGAGAACUGAAUUCC AUGGGUU-3’; miR-146a-5p: 5’-UGAGAACUGAA UUCCAUGGGUU-3’。
1.3.8 蛋白質印跡法
使用適當的冷裂解緩沖液從IEC-6 細胞和腸組織中提取總蛋白,并使用BCA 蛋白試劑盒測定蛋白濃度。 然后將樣品加載到SDS-PAGE(8%~12%)上,并轉移到PVDF 膜。 將膜在5%脫脂牛奶中封閉1 h,與靶向β-actin(1 ∶2000),Sirt6(1 ∶1200 稀釋)和LC3(1 ∶1000 稀釋)的一抗在4℃下孵育過夜,后與HRP 偶聯的二抗(1 ∶5000)在室溫下孵育1 h。通過增強化學發光法和ChemiDoc XRS 獲取蛋白質條帶圖像。 使用Image J 軟件計算條帶強度,并將其歸一化為GAPDH 的條帶強度。
1.3.9 體外抑制劑轉染miR-146a
IEC-6 細胞每毫升5×103個細胞接種在24 孔板中。 將50 μL 含miR-146a 抑制劑(25 nmol/L,終濃度)Opti-MEM 與含1 μL lipofectamine 的50 μL Opti-MEM 混合,并轉染IEC-6 細胞6 h。 然后用原始培養基再培養24 h,用DEX 預處理并建立OGD/R 模型。 等濃度的抑制劑陰性對照用作實驗中非序列特異性效應的對照。 最后,測定細胞凋亡、miR-146a 表達水平以及與信號相關的蛋白表達水平。
1.4 統計學方法
2 結果
2.1 DEX 在體內外對I/R 和OGD/R 損傷的保護作用
HE 染色顯示,假手術組大鼠的腸粘膜上皮細胞完好無損,杯狀細胞清晰可見。 與假手術組相比,I/R 組大鼠腸黏膜上皮出現明顯的腸道形態改變、大量炎性細胞浸潤、固有層消化崩解、出血、潰瘍形成。 DEX 組的腸道形態學改變顯著改善,其特征是腸道組織學損傷評分(Chiu’s score)降低。 組織病理學分析表明DEX 處理對I/R 誘導的腸上皮損傷具有保護作用(圖1)。 為了模擬腸I/R,對IEC-6 細胞進行4 h 的氧-葡萄糖剝奪,然后進行復氧(OGD/R)。 與對照組相比,在OGD/R 暴露后觀察到細胞活力大大降低。 相反,DEX 治療以劑量依賴性方式恢復細胞增殖并促進細胞存活。 此外,由于DEX 在2 μmol/L 時表現出最佳保護性能,存活率約為90%(圖2),因此選擇該濃度用于后續分析。
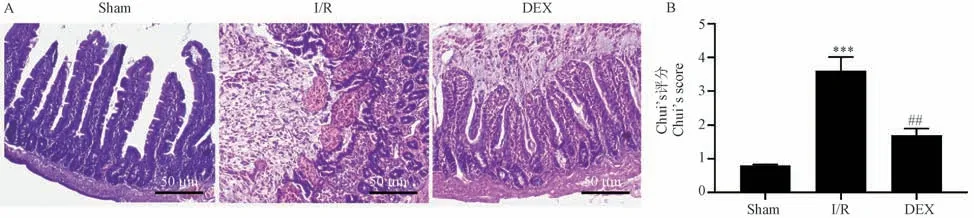
圖1 DEX 在體內對I/R 損傷的保護作用(HE 染色,n=8)Note. A, HE staining results of the rat intestinal mucosa. B, Chui’s score. Compared with the Sham group,***P<0.001. Compared with the I/R group,##P<0.01.Figure 1 Protective effect of DEX against I/R injury in vivo (HE staining)
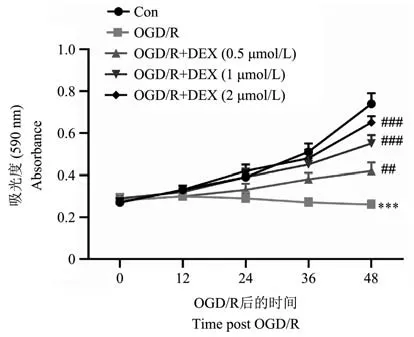
圖2 OGD/R 損傷和DEX 處理對腸細胞增殖的影響Note. Compared with Con group,***P<0.001. Compared with OGD/R group,##P<0.01,###P<0.001.Figure 2 Effects of OGD/R injury and DEX treatment on intestinal cell proliferation
2.2 DEX 在體內和體外對I/R 和OGD/R 損傷后細胞凋亡的抑制作用
與Sham 組相比,I/R 組大鼠腸道細胞凋亡顯著增加(P<0.001)。 DEX 組細胞凋亡顯著低于I/R組(P<0.01)(圖3)。 與體內結果一致,體外研究發現DEX 顯著減輕OGD/R 誘導的IEC-6 細胞凋亡(P<0.01)(圖4)。

圖3 DEX 在體內對I/R 損傷后細胞凋亡的抑制作用(TUNEL 染色,n=8)Note. A, TUNEL staining results of rat intestinal mucosa. B, Quantitative analysis of TUNEL positive cells. Compared with the Sham group,***P<0.001. Compared with the I/R group, ##P<0.01.Figure 3 Inhibitory effect of DEX on apoptosis after I/R injury in vivo (TUNEL staining)
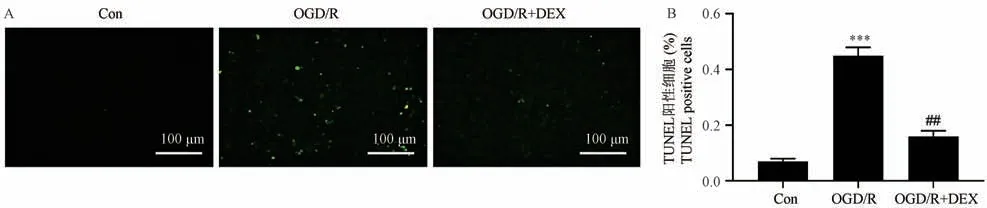
圖4 DEX 在體外對OGD/R 損傷后細胞凋亡的抑制作用(TUNEL 染色,n=3)Note. A, TUNEL staining results of IEC-6 cells. B, Quantitative analysis of TUNEL-positive cells. Compared with Con group,***P<0.001.Compared with OGD/R group,##P<0.01.Figure 4 TUNEL staining analysis of the effect of DEX on OGD/R injury-induced apoptosis of intestinal epithelial cells(TUNEL staining)
2.3 DEX 對體外和體內miR-146a/Sirt6 信號和LC3 水平的影響
先前研究報道了DEX 通過靶向miR-146a/Sirt6信號參與肺部保護[11],為考察DEX 是否通過靶向miR-146a/Sirt6 信號在對I/R 損傷的保護功能中發揮作用,研究考察DEX 對體外和體內miR-146a/Sirt6 信號的影響。 與Sham 組相比,I/R 組miR-146a、Sirt6 在大鼠腸道組織中表達顯著下調(P<0.001)。 DEX 治療顯著增加了I/R 大鼠腸道組織中miR-146a、Sirt6 表達(P<0.01)(圖5、圖6)。 與體內結果一致,體外研究發現DEX 顯著增加了OGD/R 誘導的IEC-6 細胞中miR-146a 表達下調(P<0.01)(圖5)。 此外,蛋白質印跡和免疫熒光測定用于檢測體內和體外LC3 的表達水平。 如圖6所示,與Sham 組或對照組相比,I/R 組和OGD/R 組LC3 Ⅱ的表達水平降低,DEX 增加了LC3 Ⅱ水平。免疫熒光證實了蛋白質印跡結果,DEX 顯著增加了I/R 大鼠腸組織和OGD/R 處理的IEC-6 細胞中LC3 水平(圖7)。
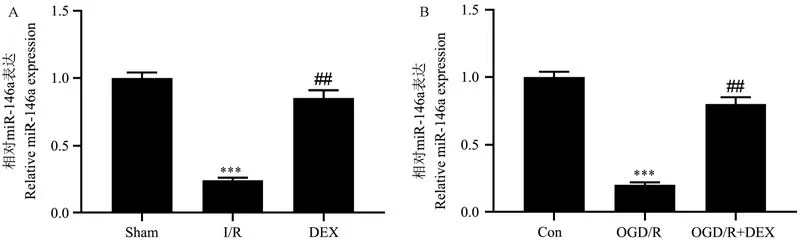
圖5 DEX對體外和體內miR-146a水平的影響Note. A, Effect of DEX on the expression levelofmiR-146ainintestinaltissueofratswithI/Rinjury.B, Effect of miR-146a expression level in OGD/R injury-induced intestinal epithelial cells. Compared with Sham group or Con group,***P<0.001. Compared with I/R group or OGD/R group,##P<0.01.Figure 5 Effects of DEX on miR-146a levels in vitro and in vivo
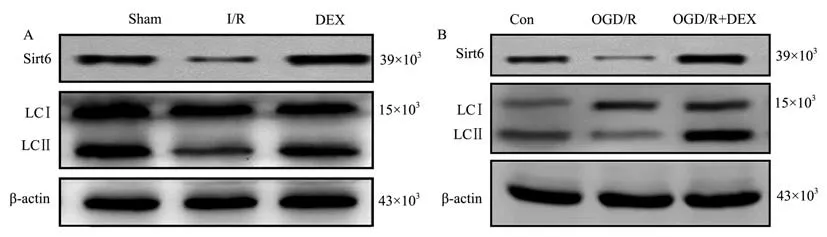
圖6 DEX 對體外和體內Sirt6 和LC3 水平的影響Note. A, Effect of DEX on the expression levels of Sirt6 and LC3 in the intestinal tissue of I/R injured rats. B, Effect of the expression levels of Sirt6 and LC3 in the intestinal epithelial cells induced by OGD/R injury.Figure 6 Effects of DEX on Sirt6 and LC3 levels in vitro and in vivo
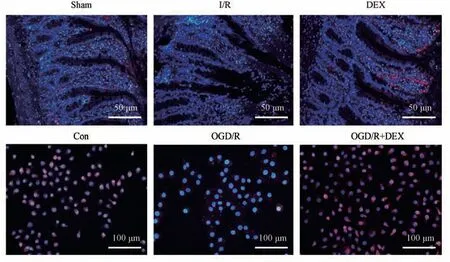
圖7 DEX 對體外和體內Sirt6、LC3 水平的影響(免疫熒光染色)Note. A, Effect of DEX on the expression level of LC3 in the intestinal tissue of I/R injured rats. B, Effect of the LC3 expression level in the intestinal epithelial cells induced by OGD/R injury.Figure 7 Effect of DEX on Sirt6 and LC3 levels in vitro and in vivo (Immunofluorescence staining)
2.4 在體外阻斷miR-146a 后DEX 對細胞凋亡的影響
用miR-146a 抑制劑轉染IEC-6 細胞,然后在OGD/R 損傷前用DEX 預處理。 如圖8 所示,miR-146a 抑制劑降低了DEX 治療誘導的miR-146a 上調(P<0.01)。 與OGD/R 組相比,miR-146a 抑制劑顯著增加了凋亡細胞的數量,并減少了Sirt6、LC3 Ⅱ的表達水平。 此外,與OGD/R+DEX 組相比,OGD/R+DEX+miR-146a 抑制劑組凋亡細胞的數量顯著增加(P<0.05),和Sirt6、LC3 Ⅱ的表達水平顯著減少(P<0.01)(圖9~圖11)。
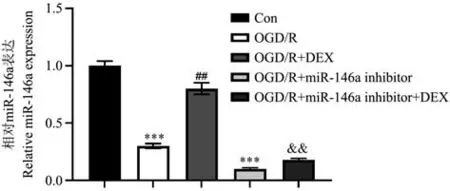
圖8 轉染miR-146a 抑制劑影響DEX 對IEC-6細胞中miR-146a 表達Figure 8 Transfection of miR-146a inhibitor affects the expression of miR-146a in IEC-6 cells by DEX
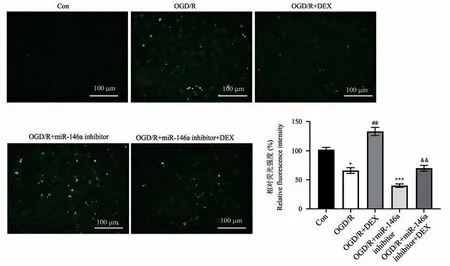
圖9 轉染miR-146a 抑制劑影響DEX 對IEC-6 細胞凋亡的保護(TUNEL 染色,n=3)Note. Compared with Con group,*P<0.05,***P<0.001. Compared with OGD/R group,##P<0.01. Compared with OGD/R+DEX group,&&P<0.01.Figure 9 Transfection of miR-146a inhibitor affects the protection of DEX against apoptosis of IEC-6 cells (TUNEL staining)
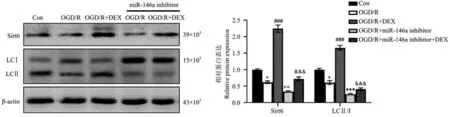
圖10 轉染miR-146a 抑制劑影響DEX 對IEC-6 細胞中Sirt6、LC3 Ⅱ蛋白表達影響Note. Compared with Con group,*P<0.05,**P<0.01,***P<0.001. Compared with OGD/R group,###P<0.001. Compared with OGD/R+DEX group,&&&P<0.01.Figure 10 Transfection of miR-146a inhibitor affects the effect of DEX on the expression of Sirt6 and LC3Ⅱ proteins in IEC-6 cells

圖11 轉染miR-146a 抑制劑影響DEX 對IEC-6 細胞中LC3 蛋白表達(免疫熒光染色,n=3)Note. Compared with Con group,*P<0.05,***P<0.001. Compared with OGD/R group,##P<0.01. Compared with OGD/R+DEX group,&&P<0.01.Figure 11 Transfection of miR-146a inhibitor affected the expression of LC3 protein in IEC-6 cells by DEX(Immunofluorescence staining)
3 討論
腸道I/R 損傷作為臨床常見的嚴重疾病,威脅患者生命。 腸道黏膜是腸道菌群與其內毒素之間的屏障[6]。 I/R 損傷引起的粘膜破壞可出現腸道細菌轉移到體循環系統,并導致組織壞死、嚴重代謝紊亂和全身炎癥反應綜合征的快速進展[6]。 DEX是一種成熟的治療藥物,先前研究發現DEX 通過抑制炎癥和細胞凋亡對肝、腎、腦和胃I/R 損傷具有保護作用[15-16]。 然而,DEX 影響腸道I/R 損傷的分子機制仍不清楚。 本研究的結果表明,DEX 預處理顯著改善了OGD/R 誘導的IEC-6 細胞活力下降,并且DEX 可改善腸道I/R 誘導的組織病理學損傷并降低Chiu 評分,這是腸黏膜損傷的重要指標[6]。 此外,DEX 顯著降低了凋亡細胞的數量,提示DEX 對I/R 損傷的保護作用可能與抑制細胞凋亡有關。
自噬作為細胞穩態的關鍵調節劑,在自噬性細胞死亡中起重要作用,并作為信號平臺促進不同細胞死亡途徑的激活和整合,選擇性降解自噬相關因子[17]。 例如,增加的自噬活性有助于緩解腸道I/R誘導的炎癥反應[2]。 此外,自噬通過降解哺乳動物細胞中的抗凋亡因子或受損分子和細胞器先于細胞凋亡[18]。 目前認為,自噬在缺血性疾病中發揮有益還是有害作用取決于環境壓力因素,包括氧氣可用性的變化、I/R 損傷的嚴重程度,以及不同器官對缺血的耐受性,可能導致受影響器官中自噬通量的變化[19]。 本研究表明,DEX 預處理上調了腸道I/R損傷中的自噬活性,其特征是在體內和體外均增加了LC3Ⅱ水平。 由于自噬是一個高度動態和多步驟的過程,自噬標記蛋白LC3 水平的增加可能是自噬活性增加或自噬體-溶酶體融合受阻的結果[20]。 因此,我們的研究結果表明,DEX 通過增強自噬活性來減輕腸道I/R 損傷。
越來越多的證據表明miRNA 分子可以作為各種疾病的靶向治療劑。 先前的研究發現,miR-146a可以緩解I/R 損傷,例如腎I/R 和心肌I/R 損傷[9,21]。 至于腸道I/R 損傷,之前的研究表明miR-146a 在I/R 和OGD/R 期間的表達降低,并且在OGD/R 期間抑制miR-146a 表達進一步抑制自噬并加重細胞死亡,而miR-146a 過表達通過上調Sirt6增加體外自噬激活來減輕OGD/R 損傷。 提示miR-146a/Sirt6 信號通過調節自噬作用于OGD/R[10,22]。此外,先前研究已經證實了miR-146a 可以通過靶向Sirt6 來調節炎癥、氧化應激、纖維化等病理過程[23]。本研究發現,DEX 在體內和體外均增加了miR-146a/Sirt6 信號水平。 Sirt6 介導的自噬在控制凋亡信號傳導中起關鍵作用。 為了進一步研究DEX 對miR-146a/Sirt6 信號的影響,我們在體外進行了miR-146a 抑制劑測試,并發現miR-146a 抑制劑削弱DEX 誘導的改善作用,還通過下調Sirt6 表達抑制自噬激活。 這些發現表明,DEX 通過激活OGD/R 受損的自噬通量來減輕OGD/R 損傷。
此外,DEX 對I/R 損傷的保護作用很可能還涉及除miR-146a/Sirt6 級聯之外的許多細胞功能。 據報道,DEX 上調HIF-1α 以抑制I/R 誘導的神經元自噬[24]。 ERK 和Akt 信號通路參與DEX 介導的腎I/R 損傷中氧化應激和炎癥的減弱[15]。 此外,也有報道稱DEX 通過PPARγ/STAT3 信號通路調節巨噬細胞M2 的活化來減輕肝的I/R 損傷[6]。 這與我們模型中觀察到的細胞凋亡減少一致,表明在I/R損傷和DEX 治療期間存在復雜的細胞間通訊。 總體而言,所有這些發現都確定了DEX 賦予保護功能的復雜性,而對潛在機制的更嚴格探索不僅需要擴大我們對I/R 的了解,而且還需要提供針對I/R 損傷的新預防策略。

