海產品中砷的形態及其毒性研究進展
鐘映雄,陳佳佳,汪思鈞,陳建平,李瑞,賈學靜,劉曉菲,宋兵兵,鐘賽意,3,4*
1(廣東海洋大學食品科技學院,廣東省水產品加工與安全重點實驗室,廣東省海洋生物制品工程實驗室,廣東省海洋食品工程技術研究中心,廣東 湛江, 524088)2(深圳市筍崗海關,廣東 深圳, 518000)3(廣東海洋大學 深圳研究院,廣東 深圳,518108)4(海洋食品精深加工關鍵技術省部共建協同創新中心(大連工業大學),遼寧 大連,116034)
砷是一種有毒類金屬,因具有致癌、致畸等特性,被國際癌癥研究中心(International Center for Cancer Research,IARC)歸為I類致癌物。砷毒性不僅與總量有關,更與其化學形態密切相關。砷分為有機砷和無機砷,無機砷主要有亞砷酸鹽(iAsⅢ)和砷酸鹽(iAsⅤ),有機砷主要有一甲基砷(monomethyl arsenic,MMA)、二甲基砷(dimethyl arsenic,DMA)、三甲基砷(trimethyl arsenic, TMA)、砷甜菜堿(arsenic betaine,AsB)、砷膽堿(arsenic choline,AsC)、砷糖(arsenic sugar,AsS)和砷脂(arsenic lipid,AsL)等。一般認為無機砷毒性遠大于有機砷,若以半數致死量(half lethal dose,LD50)計,則砷化合物的毒性依次為:iAsⅢ>iAsV>MMA>DMA>TMA>AsS>AsC>AsB, 而AsL被認為毒性極低[1]。食用無機砷含量超標的海產品會導致砷中毒,誘發的疾病包括但不限于皮膚癌、肺癌和膀胱癌、心血管疾病、糖尿病、生殖和發育障礙以及神經和認知功能障礙[2]。因此,分析海產品中不同砷形態具有重要意義。
砷普遍存在于海洋環境中,且海產品容易富集砷,并以有機砷為主要形式。因為海洋魚類和貝類等生物可將吸收的無機砷通過食物鏈被生物體轉化合成AsB等有機砷,而有機砷比無機砷具有更強的食物鏈傳遞能力,最終在海產品中富集更高濃度的砷[3]。其中,AsS是海藻類主要的砷形態,AsB是魚類和甲殼類主要的砷形態,AsS和AsB均是貝類的主要砷形態[4]。人體內約90%的砷來源于海產品,其中海產品中85%~94%砷以低毒或者無毒的AsB等有機砷形式存在[5]。但近年來,研究發現有機砷MMAIII(三價一甲基砷)和DMAⅢ(三價二甲基砷)毒性均比iAsⅢ強[6]。但目前對攝入海產品后不同砷形態在體內代謝途徑的研究不夠深入,且砷毒性效應的細胞靶點以及分子靶點仍不明確,以及新型砷化合物的檢出與結構鑒定仍需進一步改進與完善。
文章對海產品中砷的形態、分布特征、毒性以及對人類健康風險評估進行了論述,并對未來多學科交叉發展下,海產品中砷形態分析、毒性研究及預測防控的發展趨勢提出展望。旨在為砷形態毒性和安全性分析的研究提供借鑒與參考。
1 海產品中砷的形態
海產品中砷有無機砷和有機砷2種形態。之前的文獻報道中,均未在海產品中檢測出砷單質。表1列舉了海產品中砷的存在形式。
海產品中無機砷受國家標準限量監控。同時,IARC將砷和無機砷列為I類致癌物,其中,無機砷(iAsⅢ和iAsⅤ)被公認為致癌物,有機砷MMA和DMA也被列為明確的致癌物。不同烹調方式也會影響砷的毒性和含量[9],潛在的健康風險需引起重視。

表1 海產品中砷的存在形式Table 1 Arsenic species in marine
2 海產品中砷的分布特征
2.1 海產品中砷的含量與形態
海產品中總砷含量和砷形態的分布如表2所示。海產品中總砷含量依次為:底棲貝類>底層魚類>中上層魚類>甲殼類,其中貝類總砷含量比中上層魚類高5~7倍[10]。與TAYLOR等[11]的實驗結果一致,并發現海洋食物網中海藻的總砷含量最高。海產品中無機砷含量依次為:貝類>甲殼類>魚類[12]。海藻中,羊棲菜的總砷和無機砷較高[3],其中紫菜總砷平均值達到17.0 mg/kg[12],羊棲菜無機砷含量較高[ω(AsⅤ)>60 mg/kg][8],但海藻中主要的砷形態為AsS[4]。貝類中,縊蟶的總砷和無機砷均高于其他貝類[13],以藻類和浮游植物為食物的象拔蚌(底棲貝類)其砷含量是鮭魚(中上層魚類)的6~10倍[4]。經魚類中砷形態分析發現海水魚中砷含量明顯高于淡水魚,魚體內重金屬富集的次序為:肉食性魚類>雜食性魚類>植物食性魚類[14]。一般認為魚類中主要砷形態為AsB,但日本學者發現[15],沙丁魚中DMA濃度高于AsB,占砷總量的16%~24%。甲殼類中,野生捕蝦的總砷含量幾乎是養殖蝦的100倍[4],同時陸奕娜等[16]研究顯示,養殖蝦的AsB含量明顯高于非養殖蝦,但AsC含量卻呈現相反結果[16]。總結發現海產品中砷形態以AsB為主,約占總砷85%~94%;砷形態的含量次序為ω(AsB)>ω(DMA)>ω(iAsⅤ)>ω(iAsⅢ)>ω(MMA)[10],無機砷約占10%[17]。
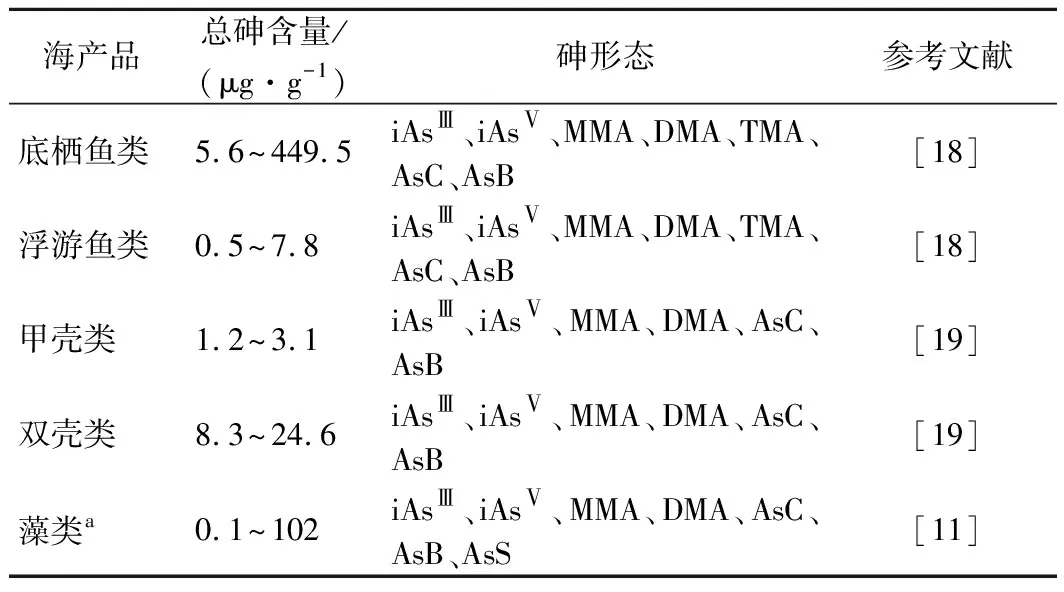
表2 海產品中總砷含量和所檢出砷形態(以干重計)Table 2 Total arsenic content and speciation of arsenic in seafood (on dry basis)
2.2 不同組織中砷的分布
海產品不同組織中總砷和形態砷的富集研究發現砷累積量與初始暴露期(約0~10 d)呈正相關;達到穩定期后,砷在組織中積累順序為:胃腸道>肝臟>鰓>肌肉[20]。同時,90%的砷在魚體內轉化為有機形式,且AsB是砷代謝的最終產物[20]。有機砷在不同組織中的分布為:肌肉>鰓>肝臟>胃腸道,且占總砷95.5%~99.5%[21]。魚類研究發現尼羅羅非魚中無機砷的積累順序為:肝臟>胃>鰓>肌肉[22];從北波斯灣采集的魚類,除了杜氏真鯊外,其他魚類肝臟組織的砷含量明顯高于肌肉[23]。魚類的生物蓄積表明,肝臟和胃對砷的吸收和蓄積起著重要作用[22]。甲殼類動物中,巨型紅蝦肌肉的砷含量[(16.3±0.8) mg/kg干重]是頭胸[(32.7±1.1) mg/kg干重]的一半[24]。調查中國主要產區螃蟹中重金屬(含砷)發現,雌性褐蟹肉的飲食風險高于雄性可食組織[25];海蟹中性腺(雌)組織的總砷含量同樣高于其他可食用部分,可見性腺組織是積累砷的主要組織[26]。貝類中砷積累順序為:貝類組織鰓>性腺>足部肌肉>套膜[27]。綜合魚類、甲殼類和貝類組織中砷富集情況,發現內臟相比肌肉組織更容易富集砷。
2.3 不同海域中砷的分布
收集不同海域海產品砷含量數據見表3,并根據meta分析,發現我國軟體動物中砷含量由北向南呈下降趨勢[28]。北波斯灣的海產品砷含量均高于地中海和歐洲大西洋,其中軟體動物砷含量分別為歐洲大西洋、地中海的12和6倍。我國從北至南不同魚種的砷含量變化范圍較廣(2.09~134 μg/g)[29],青島地區存在相對偏高的現象[13]。我國貝類中,深圳市近江牡蠣砷較高,As含量(按濕重算)為2.24~95.5 mg/kg[17]。砷水平存在地理差異,這可能是由微量元素生物累積量以及工業和農業污染情況差異造成的[29]。
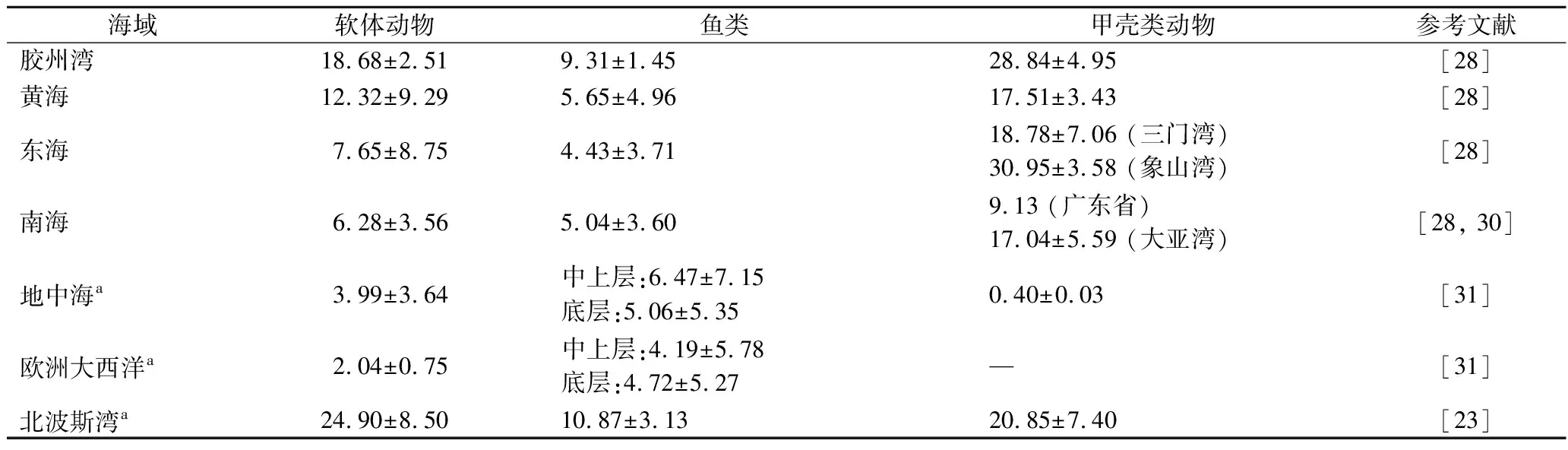
表3 不同海域海產品中砷含量 單位:mg/kg
3 海產品中砷的毒性
海產品是砷暴露的主要途徑,大量存在于海產品中的AsB無需代謝可直接隨尿液排出,其他砷化合物如AsS、AsL和iAs的尿液代謝物為DMA。然而,最近的研究顯示,某些有機砷及其中間代謝產物具有細胞毒性[11],說明需要對有機砷的代謝途徑和毒性進行下一步研究。圖1顯示海產品中砷形態在人體內的代謝情況[8]。
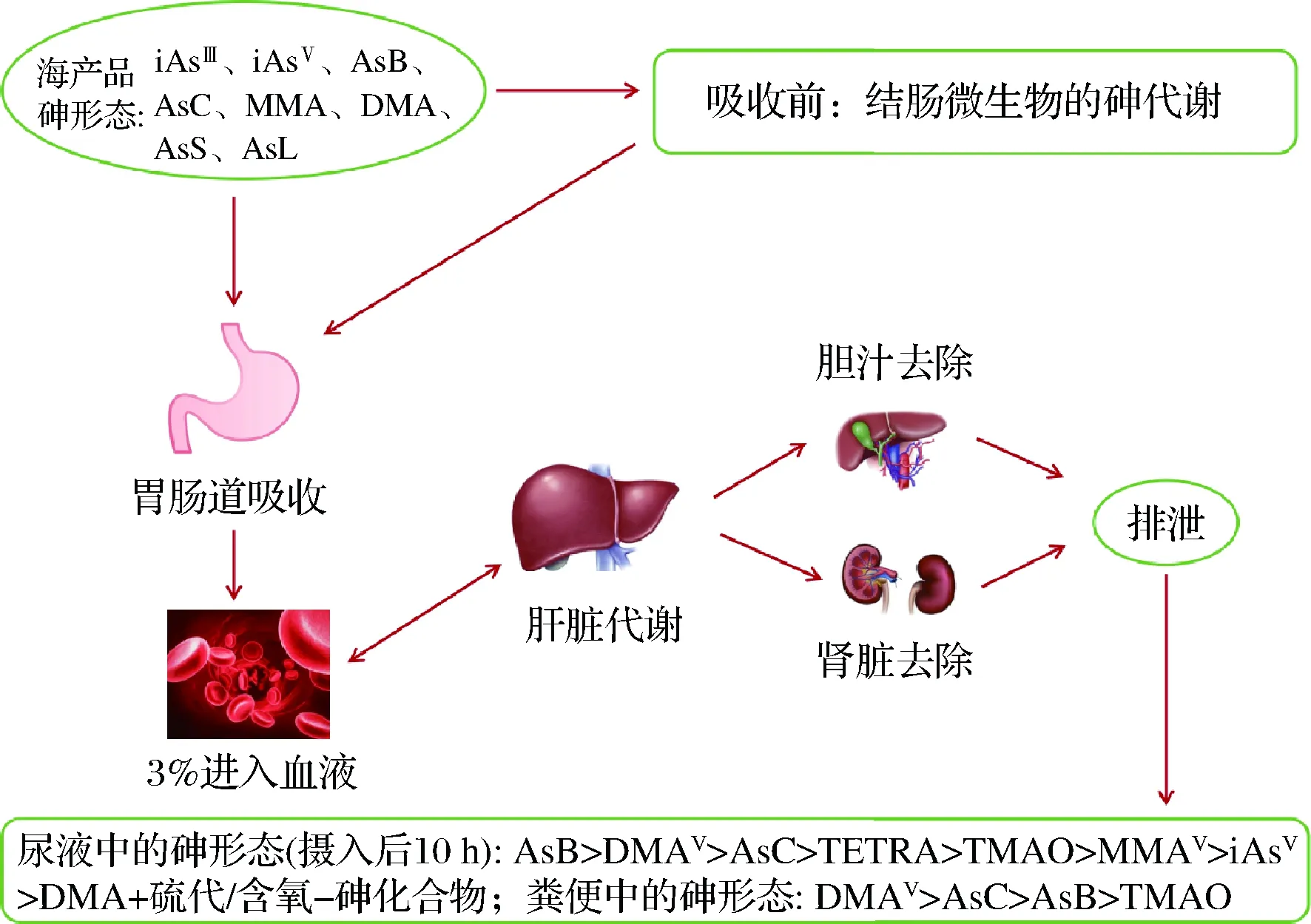
圖1 海產品中不同形態砷在人體內的代謝Fig.1 Metabolism of arsenic species from seafood in humans
3.1 致癌性
有學者提出,隨著砷暴露時間的增加或累積,會導致細胞生長、凋亡行為和基因組信號通路的改變,從而引發癌癥[32]。關于劑量-反應關系,暴露在等于或低于參考劑量的砷濃度下均會致癌[33]。懷孕小鼠砷暴露后,會增加其子代的癌癥易感性[34]。流行病學研究已證實,砷暴露在200 μg/L或更高水平時,膀胱癌、肺癌和皮膚癌的風險增加[35]。砷誘發的不是癌癥,而是多種毒性,如砷中毒、皮膚病變、支氣管炎或尿路上皮毒性,這些毒性導致再生性增殖,最終間接誘發癌癥[2]。砷的致癌機制與miRNA失調有關,但誘發癌癥病因中的機制和確切作用仍不明確[32]。無機砷癌變是通過幾種表觀遺傳機制:DNA甲基化、組蛋白翻譯后修飾、組蛋白變體和miRNA[36]。有機砷(MMA和DMA)可以抑制線粒體呼吸,導致氧活性物質的形成,從而DNA發生突變,誘發癌癥和細胞死亡[22]。其中MMAⅢ和DMAⅢ均可誘導試驗鼠發生腫瘤[37]。在動物研究中,DMAV可促進膀胱、腎臟、肝臟和甲狀腺致癌[12]。圖2為攝入無機砷后,砷在體內的代謝情況。

SAM:S-腺苷甲硫氨酸合成酶;SAHC:S-腺苷同型半胱氨酸圖2 無機砷在人體內的代謝Fig.2 Metabolism of inorganic arsenic
3.2 致畸性
動物實驗表明,iAsⅤ對斑點蠑螈胚胎發育有致畸作用,表現為腹部水腫、尾部扭結、鰓和面部畸形以及異常彎曲,其嚴重程度隨著砷(iAsⅤ)濃度的增加而增加[38]。研究斑馬魚胚胎暴露在0.8 mmol/L砷的致畸性,結果為卵凝固、發育遲緩、水腫形成、孵化成功、脊柱側凸[39]。
3.3 生殖毒性
砷和無機砷對生殖系統有毒性作用。As2O3處理的小鼠中,睪酮生物合成顯著降低,精子運動性、活力、膜完整性也出現異常[40]。研究發現砷可通過抑制睪酮、黃體生成素(luteinizing hormone,LH)、卵泡刺激素(follicle-stimulating hormone, FSH)的合成來抑制精子的發生和成熟[40]。OMMATI等[41]研究發現,氧化應激誘導的線粒體損傷和自噬細胞死亡,通過AMPK/TSC/mTOR和LC3相關途徑誘導生殖系統毒性。
3.4 神經毒性
長期接觸砷會損害中樞神經系統和外周神經系統。較高的砷暴露[1 mg As/(kg·d)或更多]通常會導致腦病,并伴有幻覺、癲癇、精神混亂、嗜睡、頭痛,有時還會昏迷[34]。在兒童發育階段接觸砷會改變他們的神經發育。例如,兒童砷暴露與低智商和神經認知功能有關[42]。對體外血腦屏障模型的研究中發現,含砷碳氫化合物(arsenic hydrocarbons,AsHCs)對完全分化的人腦細胞具有潛在的神經毒性[43]。吸入砷還會導致人類的神經系統產生缺陷,如感覺和運動神經元的周圍神經病變,導致反射喪失和肌肉無力[32]。
3.5 細胞毒性
砷通過不同途徑誘導活性氧,激活蛋白JNK產生細胞毒性,JNK是有絲分裂活化蛋白激酶的相關亞組之一,具有介導細胞凋亡、分化和增殖等細胞功能,并刺激JNK腫瘤壞死因子[34]。細胞毒性的順序為DMAⅢ、DMMTAV>iAsⅢ、iAsV>MMMTAⅤ(一甲基單硫砷酸)>MMAⅤ、DMAV[42]。有研究發現小鼠食用海產品后,在其尿液和糞便中發現一種有毒的代謝物DMMTAV(硫代砷酸),該物質對人肺和膀胱癌細胞的細胞毒性作用比iAsⅢ更明顯[6]。比較iAsⅢ或MMAⅢ在人腦細胞中的細胞毒性,結果發現MMAⅢ對神經元的毒性顯著高于iAsⅢ[44]。砷脂中,AsHC發揮了最強的細胞毒性作用,其毒性比iAsⅢ高出5倍;其中AsHC 360的毒性最高[43]。
3.6 遺傳毒性
砷的本質上是非誘變的,但可通過DNA損傷、染色體畸變、姐妹染色單體交換和人體系統微核形成引起顯著的細胞遺傳學損傷[34]。長期暴露于細胞中的砷可通過細胞中S-腺苷蛋氨酸缺失、導致基因組不穩定的DNA低甲基化和DNA甲基化的整體丟失而誘發遺傳毒性[45]。經胎盤砷暴露會導致男性胎兒肝臟DNA甲基化變化和基因表達異常,且可改變胎兒肝臟的miRNA表達[34]。DMAⅤ對培養的哺乳動物細胞具有遺傳毒性作用[8]。
綜述毒性研究中,均未發現食用海產品導致急性毒性的跡象,但長期低劑量暴露于砷,會引起多器官衰竭、癌癥、皮膚色素沉著、角化亢進、生殖并發癥、神經和行為障礙[2]。砷化合物氧化數越低,毒性越高,甲基化越高,毒性就越低[4]。無機砷甲基化過程中的中間產物MMAⅢ和DMAⅢ,比無機砷表現出更強的細胞毒性、遺傳毒性和酶抑制力[6]。
4 人類健康風險評估
海產品中砷通過食物鏈進入人體,從而對人類健康構成危害。此外,砷在代謝過程中會產生其他未知形態的中間產物[46],因此,海產品中砷形態的分析和毒性研究對健康風險評估起重要作用。
目前主要采用目標危害商數(target hazard quotient,THQ)和致癌風險(cancer risk,CR)進行健康風險評估。表4列舉了不同海域的風險評估數據。其中,北波斯灣的THQ和CR均超于安全閾值,給人體健康帶來風險,其中成人食用貝類的THQ高達8.50。貝類是濾食性動物,易從棲息地攝取和積累重金屬,對人體健康構成潛在威脅,是研究重金屬污染的重點對象。有研究表明,食用南海海灣扇貝、櫛孔扇貝對兒童構成非致癌風險,并提示食用該地區近江牡蠣、方斑東風螺、竹蟶極大可能存在健康風險,建議該沿海居民減少貝類的攝入[47]。一般而言,食用商業魚類和甲殼類海產品的CR在可接受的范圍內,不構成重大的健康風險[48]。但在相同的暴露劑量下,兒童比成人面臨更高的風險。這可能是由于兒童的體重相對較低,對非致癌和致癌健康影響更敏感。
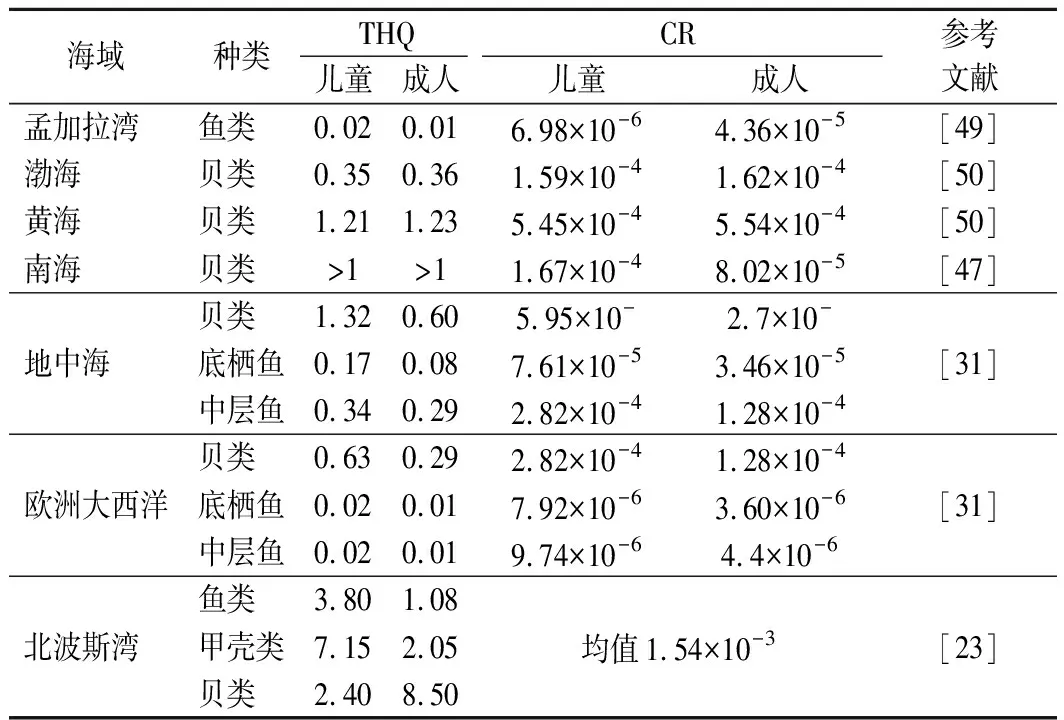
表4 不同海域海產品的THQ和CRTable 4 THQ and CR of seafood in different sea areas
風險評估結果表明,幼童、孕婦或備孕女性等特殊人群應避免一次性大量或長期食用無機砷含量較高的海產品,應采取有效措施減少有害元素向海洋環境的排放。
5 結語
海產品是人體攝入砷的主要來源之一。目前國內外對海產品中無機砷的分析趨于成熟,但對有機砷形態的分析方法仍未建立標準。GB 5009.11—2014《食品安全國家標準 食品中總砷及無機砷的測定》中只提及食品中總砷及無機砷的測定,同時,缺少應用于海產品中不同砷形態的標準品。在砷化合物的毒性研究中,有機砷的毒性作用機制未明確。
因此,對海產品中砷的形態分析和毒性研究,不應只停留于其含量,還應在以下幾方面深入研究:在原有檢測技術上結合分子生物學等技術,對砷進行長期追蹤,為海產品中砷形態轉化及污染情況提供數據支撐;探究不同砷形態在人體內的毒作用機制和代謝途徑,例如砷毒性效應的細胞靶點以及分子靶點;結合預防醫學相關知識,建立預測風險模型,為科學指導海產品的攝入和砷中毒的防控提供依據。相信在不同學科碰撞下,海產品中砷形態及其毒性的研究更深入、更全面,并對人類健康風險提供科學依據。

