兒童急性白血病合并膿毒性休克病原菌及臨床分析
劉婷華 雷嘉穎 麥友剛
近年來,血液腫瘤患兒的治愈率顯著增加,在發達國家,急性淋巴細胞白血病(ALL)5 年生存率已超過90%,急性髓系白血病(AML)的長期生存率也達到70%[1-2]。然而,由于疾病本身和反復化學治療導致免疫抑制和皮膚黏膜屏障破壞、住院時間長,感染和膿毒癥已成為血液腫瘤患者的主要并發癥[3]。粒細胞缺乏伴發熱和患兒膿毒性休克的發生率為6%~7%,病死率高達37.5%[4-5]。該類患兒發生感染時病灶多不明確,盡管早期接受預防性抗感染治療,血流感染仍然是化學治療過程中的主要感染形式,且病情進展迅猛,嚴重威脅著患兒的生命。本研究旨在探討兒童急性白血病合并膿毒性休克血培養的病原菌情況及臨床特點,為臨床決策提供參考。
對象與方法
一、研究對象
選取中山大學孫逸仙紀念醫院兒科2012 年3月至2021 年3 月收治的急性白血病合并膿毒性休克患兒中血培養陽性者為研究對象,回顧性分析其病原菌構成及臨床特征。納入標準:①28 d <年齡< 18 歲,被確診為ALL 或AML;②合并膿毒性休克時,雙側或單側血培養陽性。排除標準:病歷資料不齊全。本研究獲得中山大學孫逸仙紀念醫院倫理委員會批準(批件號:SYSEC-KYKS-2021-163),豁免患者知情同意。
二、臨床資料收集
收集患兒的以下資料:性別、年齡、基礎疾病、治療階段、膿毒性休克發生前住院時間、粒細胞缺乏時間、發熱持續時間、抗菌藥物暴露時間、原發感染灶、膿毒性休克發生時生命體征、發生24 h 內病情嚴重程度、感染指標及病原學結果、主要治療、臨床結局等。
三、診斷標準及檢測/評分項目
膿毒性休克指嚴重感染導致的心血管功能障礙(包括低血壓,需要血管活性藥物治療或灌注受損)[6]。粒細胞缺乏指外周血中性粒細胞<0.5×109/L 或預計在接下來48 h 內降至<0.5×109/L。發熱指單次測定腋溫 ≥38.0 ℃或腋溫 ≥37.7 ℃持續超過1 h。對于住院期間反復發熱者,休克前發熱持續時間指上次體溫正常72 h 后再次出現發熱至休克發生的時間。對以下項目進行檢測/評分:多重耐藥菌(MDRO)、兒童序貫器官衰竭評分(pSOFA)、小兒危重病例評分(PCIS)、血管活性藥物評分(VIS)[7-10]。膿毒性休克發生24 h 內進行過多次檢測/評估時,取檢測/評估的最差值進行統計。
四、血培養
血培養采用雙側雙瓶法,在第1 次靜脈應用抗菌藥物或者重新調整抗菌藥物前,同時通過中心靜脈導管和對側外周靜脈采集血標本5 mL 進行需氧菌和厭氧菌培養。
五、統計學處理
應用SPSS 22.0 進行數據處理,正態分布定量資料采用 表示,組間比較采用t 檢驗;非正態分布定量資料用M(Q1,Q3)表示,組間比較采用Wilcoxon 秩和檢驗;定性資料以率(%)表示,組間比較采用Fisher 確切概率法。單因素分析中P <0.05 的變量,采用逐步向前法(引入標準為0.05,剔除標準為0.10),建立logistic回歸模型,計算研究因素與死亡的OR 及其95%CI。P <0.05為差異有統計學意義。
結 果
一、一般情況
共70 例急性白血病患兒發生膿毒性休克,其中44 例(62.9%)被納入本研究,年齡為(7.0±4.0)歲,包括男24 例、女20 例,ALL 35 例、AML 9 例。除3 例患兒接受造血干細胞移植術外,其余均接受強化學治療,膿毒性休克主要發生于誘導緩解階段(27/41,65.9%)。42 例(95.5%)存在粒細胞缺乏,粒細胞缺乏持續時間為(13.7±11.1)d。無放棄治療或自動出院者。
二、病原菌構成及其耐藥性
44 例中39 例為單一細菌、3 例同時合并2 種細菌、2 例為真菌感染。共培養出細菌45 株,包括革蘭陰性菌(G-菌)33 株、革蘭陽性菌(G+菌)12 株,見表1。除3 例枯草芽孢桿菌、1 例產黑素普雷沃菌因美國臨床和實驗室標準協會(CLSI)抗菌藥物敏感性試驗執行標準中沒有相應藥物標準 外,MDRO 占48.9% (22/45)。2012 年3 月 至2017 年3 月,21 株細菌中G-菌占76.2%(16/21),總體耐藥率為52.4%(11/21)。最常見G-菌為銅綠假單胞菌(5/16,31.3%),其次為肺炎克雷伯菌(3/16,18.8%)、大腸埃希菌(2/16,12.5%)及嗜麥芽寡養單胞菌(2/16,12.5%)。2017 年4 月至2021 年3 月,病原菌同樣以G-菌為主(17/24,70.8%),總體耐藥率為45.8%(11/24)。G-菌以大腸埃希菌(4/17,23.5%)、銅綠假單胞菌(3/17,17.6%)、嗜麥芽寡養單胞菌(3/17,17.6%)、肺炎克雷伯菌(1/17,5.9%)常見。分析比較不同研究年限的病原菌耐藥率及其構成,比較差異均無統計學意義(P 均> 0.05)。主要G-菌和G+菌的耐藥性分別見表2、3。
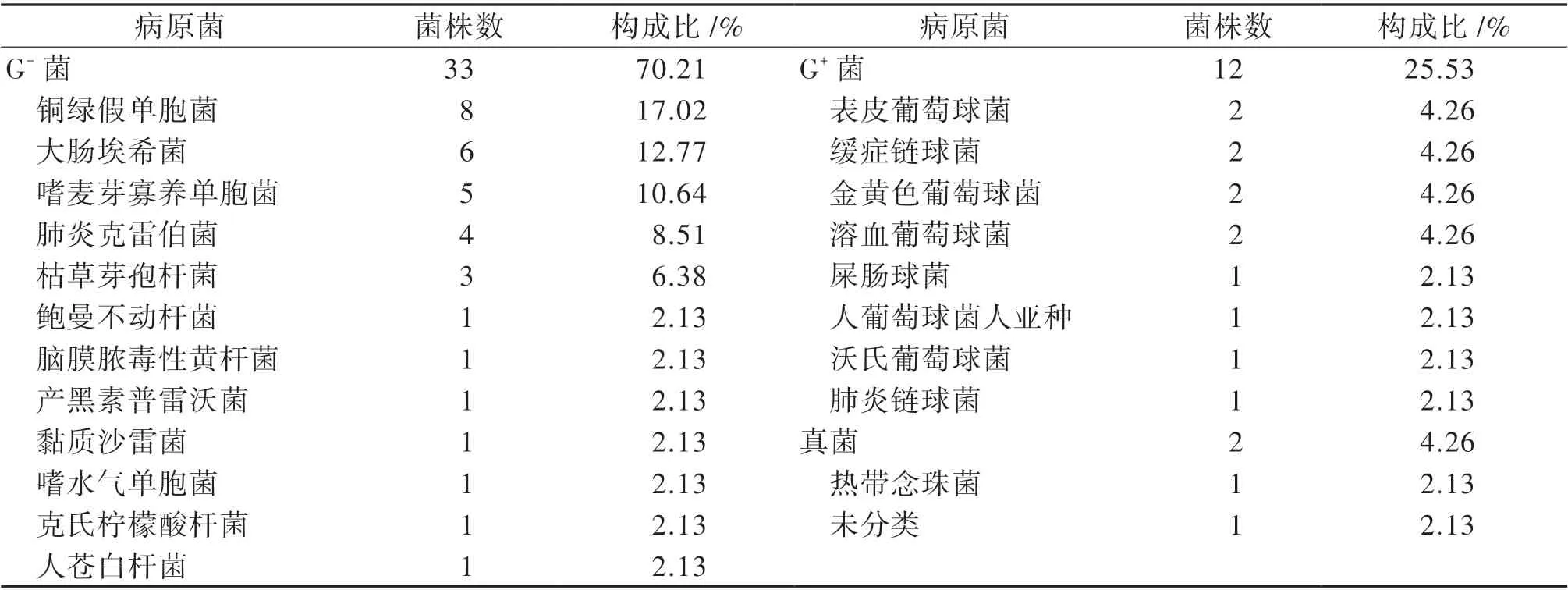
表1 急性白血病合并膿毒性休克患兒病原菌構成情況
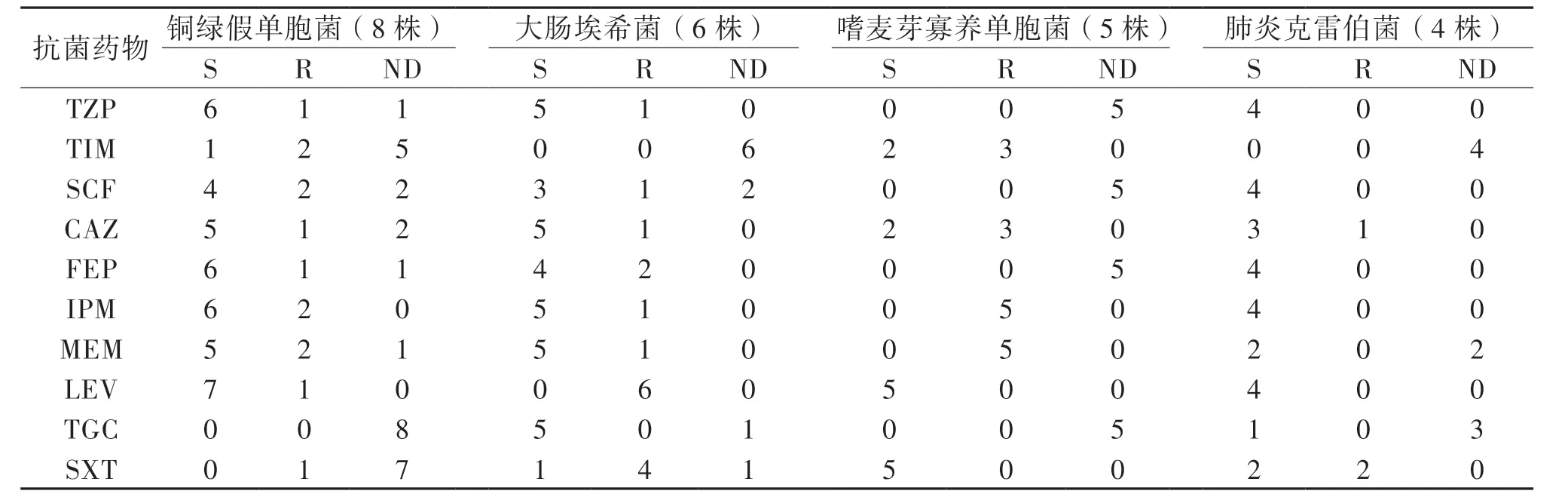
表2 急性白血病合并膿毒性休克患兒主要G-菌對抗菌藥物的耐藥性
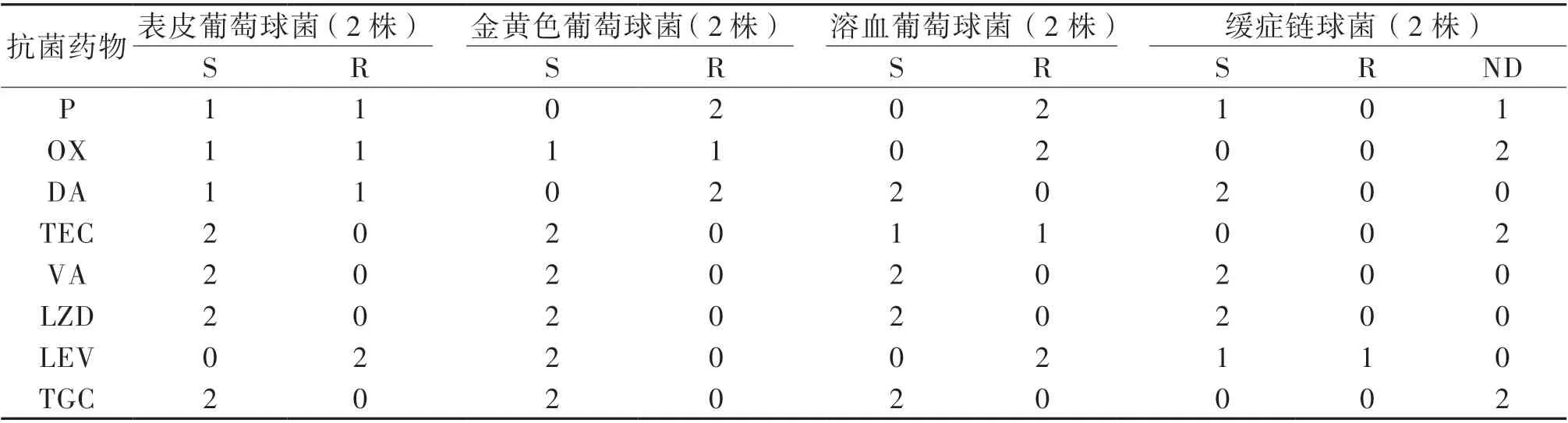
表3 急性白血病合并膿毒性休克患兒主要G+菌對抗菌藥物的耐藥性
三、感染部位及藥物使用情況
41 例(93.2%)為醫院獲得性感染,原發感染灶最常見為肺部(27/44,61.4%),其次為消化系統(13/44,29.5%)和皮膚黏膜(6/44,13.6%)。化學治療后的骨髓抑制期,常規予口服慶大霉素、阿昔洛韋及氟康唑預防感染,當出現發熱等感染表現時,則根據臨床經驗及《中國中性粒細胞缺乏伴發熱患者抗菌藥物臨床應用指南》靜脈用藥[11]。膿毒性休克發生前,40 例(90.9%)患兒已靜脈使用抗菌藥物,抗菌藥物暴露時間為5.5( 1.0,16.3) d。休克發生后,所有病例1 h 內均接受初始經驗性抗菌藥物治療,后期根據病原菌培養及藥物敏感性試驗結果調整治療方案,見圖1。
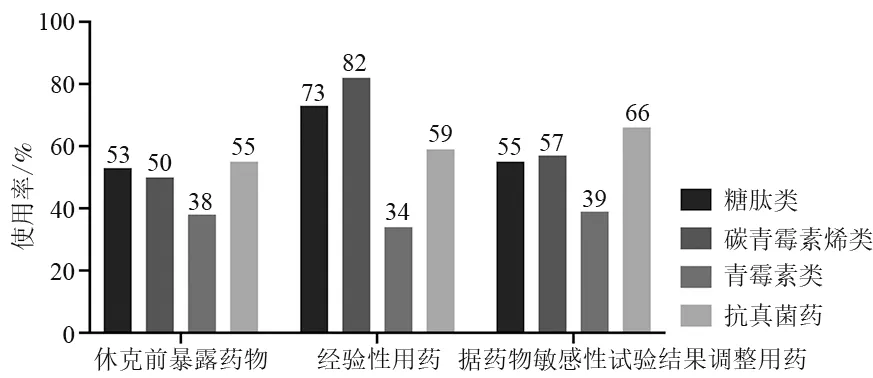
圖1 急性白血病患兒膿毒性休克發生前后主要抗菌藥物使用情況
四、G-菌與G+菌感染患兒臨床特征比較
剔除3 例同時感染2 種細菌及2 例真菌感染的患兒,比較39 例單一細菌感染患兒的臨床特征,結果顯示:G-菌組(29 例)較G+菌組(10 例)膿毒性休克前抗菌藥物暴露時間更長(Z = -1.988,P = 0.047)。膿毒性休克發生前住院時間、粒細胞缺乏時間及發熱持續時間、原發感染灶、休克發生時生命體征、感染指標、24 h 內病情嚴重程度(包括pSOFA、PCIS、VIS 評分)、兒童重癥監護室(PICU)住院時間、主要治療、28 d 內死亡率等方面2 組比較差異均無統計學意義(P 均> 0.05),見表4。
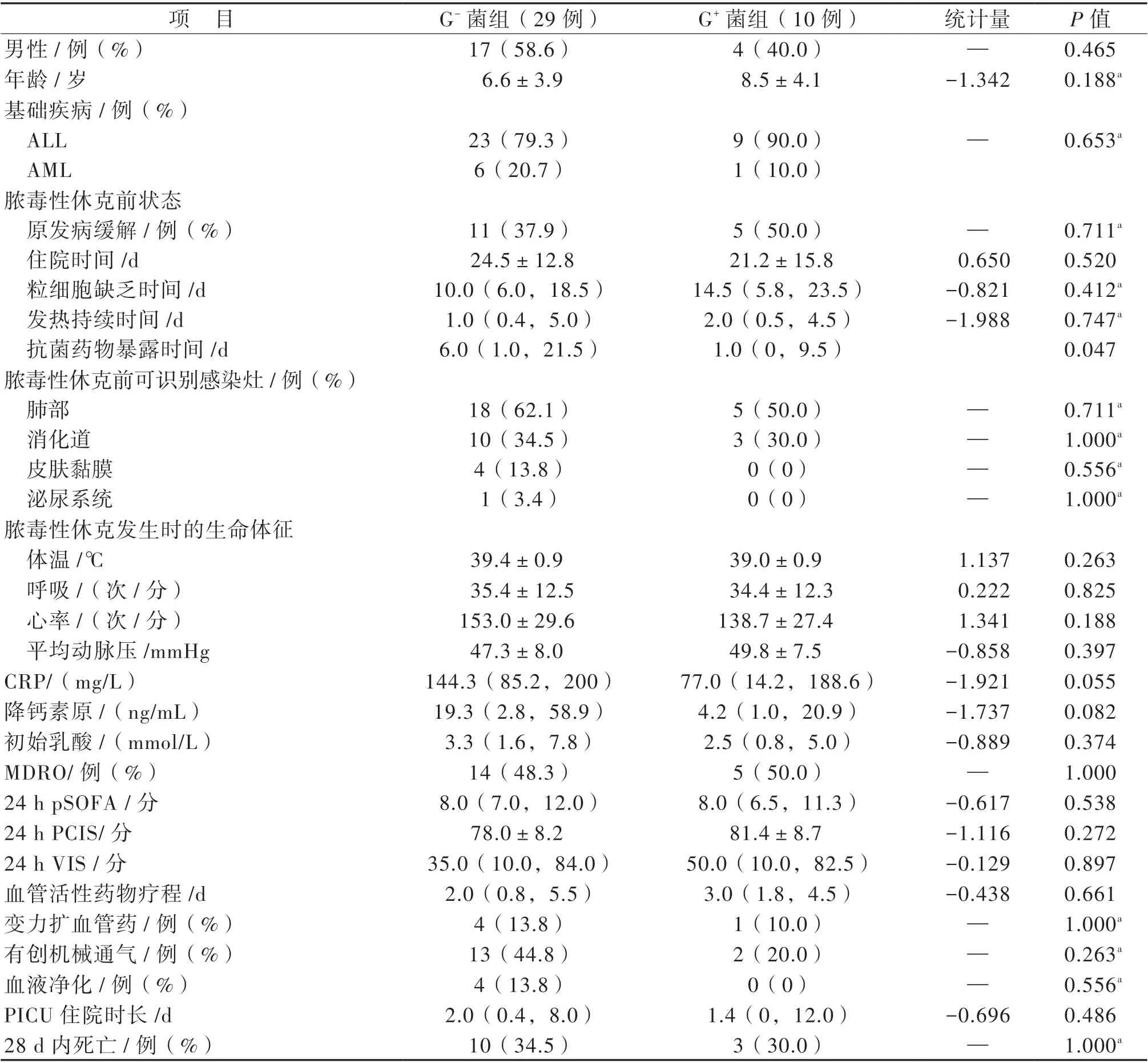
表4 G-菌與G+菌感染患兒臨床特征比較
五、MDRO 感染高危因素
39 例單一細菌感染患兒中3 例枯草芽孢桿菌未行藥物敏感性試驗,其余36 例中有19 例為MDRO 感染。比較MDRO(19 例)與非MDRO(17 例)患兒資料,前者發生休克前住院時間及抗菌藥物使用時間更長(t = -2.203,P = 0.035;Z = -2.099,P = 0.036)見表5。進一步行多因素logistic 回歸分析示休克前住院時間是患兒發生MDRO 感染的獨立危險因素(P = 0.045,OR =1.059,95%CI:1.001~1.121)。
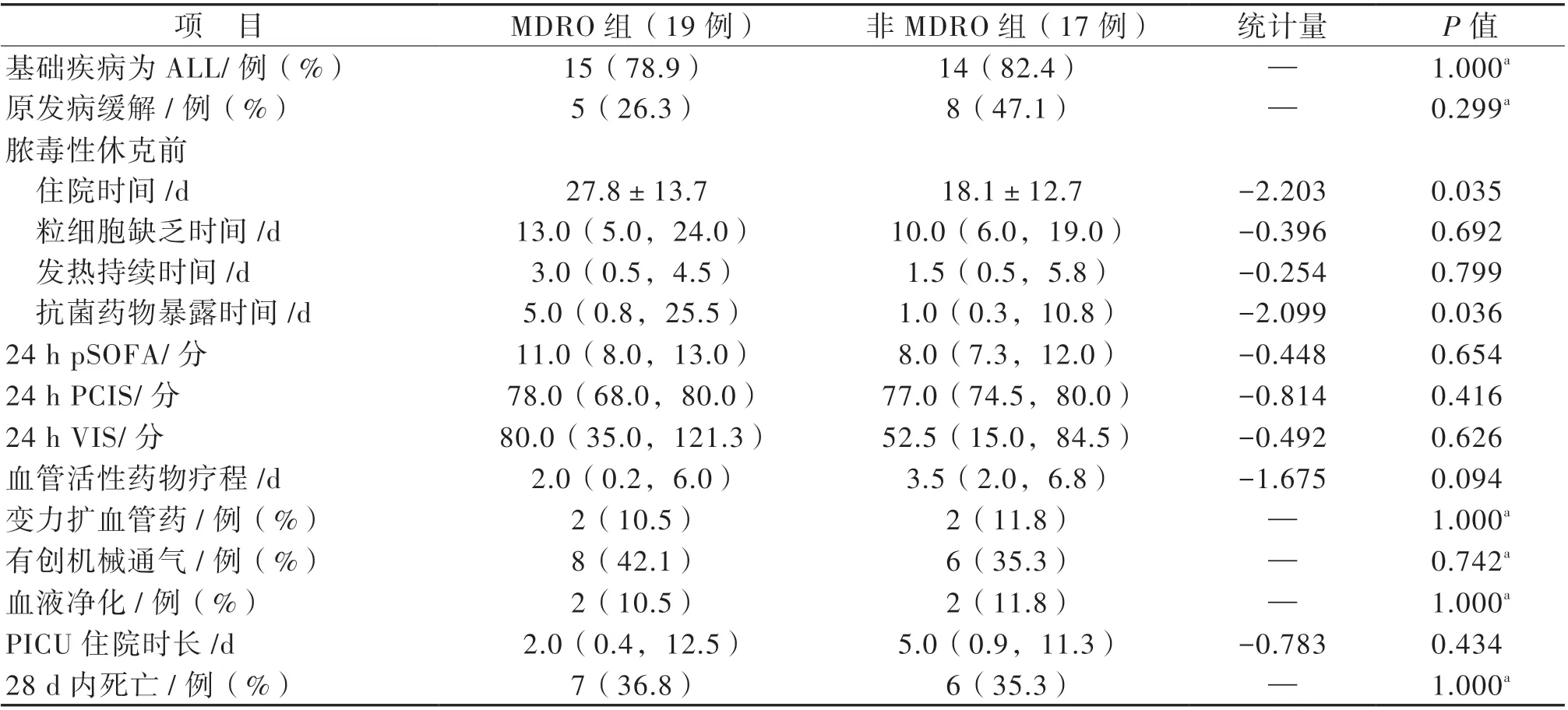
表5 MDRO 感染與非MDRO 感染患兒主要臨床特征比較
討 論
兒童血液腫瘤預后的顯著改善得益于診療技術的飛速發展。然而由于原發病本身及強化學治療、留置中心靜脈導管、長期住院等因素,血液腫瘤患兒是發生血流感染和膿毒性休克的高危人群,其病死率顯著高于無基礎疾病者[5]。因此對急性白血病合并膿毒性休克患兒的血培養病原體監測及分析具有重要意義。
本研究結果顯示,急性白血病合并膿毒性休克患兒的主要病原菌為G-菌,且以銅綠假單胞菌、大腸埃希菌、嗜麥芽寡養單胞菌等條件致病菌多見,與既往研究結論一致[12]。然而近年來G+菌感染率也呈進行性升高趨勢[13]。病原菌分布差異可能與地域、研究年限、抗菌藥物選擇習慣等因素有關,也受基礎疾病、粒細胞缺乏嚴重程度影響[5,14]。G-菌與G+菌生理特性不同,決定了彼此致病機制的差異。傳統觀念認為,G-菌感染引起的膿毒性休克發生較早,且多表現為低排高阻性休克。然而本研究顯示,G-菌與G+菌引起的膿毒性休克,其臨床表現在急性白血病患兒這個特殊群體中的差異并不明顯,因此在發生膿毒性休克時臨床醫師難以根據臨床特征直接判斷病原菌種類,決策難度大。
據文獻報道,病原體種類因住院時間長短而異,A 組鏈球菌、腦膜炎奈瑟菌和肺炎鏈球菌的中位發病時間均為入院后2 d,而大腸埃希菌和銅綠假單胞菌則超過15 d、肺炎克雷伯菌超過30 d[15]。相較于敏感菌,發生耐藥的金黃色葡萄球菌、凝血酶陰性葡萄球菌血流感染時中位住院時間更長。可見,住院時間越長,發生條件致病菌和MDRO感染可能性越大。本研究中93.2%為醫院獲得性感染,且膿毒性休克主要發生于誘導緩解等化學治療階段,休克前住院時長是急性白血病患兒發生MDRO 感染的獨立危險因素,住院時間越長,發生MDRO 的風險越高。此外,近90 d 內是否接受過3 種及以上抗菌藥物治療、既往有無MDRO定植或感染史等,也可能是MDRO 感染的影響因素,本研究還有待于納入更多臨床相關指標以得出更為確切的結論。MDRO 感染與非MDRO 感染患兒的臨床結局無差異,可能與樣本量少,病原菌及藥物敏感性試驗結果回報前均采用了早期、強效、聯合的初始經驗性治療等因素有關。
早期不恰當的經驗性抗菌藥物治療也是導致感染MDRO 的重要因素[16]。朱國慶等[17]認為,G-菌與G+菌比例大致相同,常用的碳青霉烯類、糖肽類以及哌拉西林鈉/他唑巴坦鈉等酶抑制劑復合物類藥物仍具有較好效果。在本中心,無論是骨髓抑制期靜脈抗菌藥物暴露,還是膿毒性休克發生時的經驗性抗感染治療,都是以聯合用藥為主,其中碳青霉烯類及糖肽類的應用率最高。在初始經驗性治療前,需進行耐藥性危險因素評估,包括患兒有無耐藥病原菌定植或感染病史、是否接觸過廣譜抗菌藥物等。初始經驗性治療后,應根據病情嚴重程度、確診的病原菌以及患兒對初始治療的反應等綜合判斷,及時調整抗菌藥物。當病原菌不明且病情惡化時,需重新診斷再評估,同時還應考慮耐藥G-菌、耐藥G+菌以及真菌、病毒等病原體感染可能,并根據相應指南調整治療方案[11,18-19]。
綜上所述,急性白血病合并膿毒性休克患兒血培養病原菌以G-菌為主,臨床特征與G+菌無明顯差異,住院時間越長,發生MDRO 感染風險越高。本研究的局限性在于:①單中心回顧性研究易產生選擇偏倚及回憶偏倚;②樣本量少,不能更加客觀、準確地反映病原菌構成及耐藥性變遷情況。如何監測細菌流行病學、有效合理選用抗生素尚需要擴大樣本量,開展更多的多中心、前瞻性臨床研究。

