能譜CT術前診斷胃腺癌周圍神經侵犯
李 靖,王 藝,魏瑩瑩,趙衛杰,廖秋霞,黎海亮*
[1.鄭州大學附屬腫瘤醫院(河南省腫瘤醫院)放射科,2.病理科,3.普外科,河南 鄭州 450008]
胃癌發病率及病死率均較高[1-2],多數患者就診時已處于局部進展期,常伴淋巴結轉移和神經侵犯[2-3]。周圍神經侵犯(perineural invasion, PNI)是腫瘤細胞擴散的重要途徑,與腫瘤轉移和復發密切相關并影響預后[3-4]。目前術前診斷PNI的方法多基于有創活檢,存在取樣偏倚等不足[5-6]。作為功能影像學技術,能譜CT可提供定量參數和多能級信息,用于胃癌術前分期和評估療效具有較高價值[7-8]。本研究觀察能譜CT術前診斷胃腺癌PNI的價值。
1 資料與方法
1.1 一般資料 前瞻性連續收集2021年1月—12月鄭州大學附屬腫瘤醫院收治的270例胃腺癌患者,男183例、女87例,年齡20~85歲、平均(59.7±11.5)歲。納入標準:①經內鏡活檢病理證實為單發胃腺癌;②術前常規影像學評估未見遠處轉移及周圍器官侵犯(臨床分期為cT1~3,N0~1,M0期);③擬接受手術治療,且于術前1周內接受能譜CT三期增強掃描;④術后病理診斷明確。排除標準:①術前接受放射、化學或其他抗腫瘤治療;②圖像質量較差。本研究通過院醫學倫理委員會審批(批準號:2021-KY-0021),患者均簽署知情同意書。
1.2 儀器與方法 囑患者檢查前禁食6~12 h;檢查前10 min飲溫開水1 000 ml,并肌肉注射20 mg山莨菪堿注射液(10 mg/ml)。采用GE Revolution CT機、GSI模式行腹部掃描,管電壓140 kVp和80 kVp間隔0.5 ms瞬時切換,管電流400 mA,螺距0.992∶1,旋轉時間0.8 s,探測器寬度80 mm,準直0.625 mm,矩陣512×512,FOV 38 cm×38 cm,層厚5 mm。采用高壓注射器經肘靜脈以流率3 ml/s注射碘海醇(350 mgI/ml)1.2~1.5 ml/kg體質量,采用追蹤觸發掃描技術,監測點為腹主動脈,于注射對比劑15 s后開始監測,達到觸發閾值100 HU后觸發動脈期掃描,而后間隔25 s采集靜脈期,再間隔40 s獲得延遲期圖像。采用標準算法重建圖像,層厚、層間距均為1.25 mm。以多模型自適應統計迭代重建算法(adaptive statistical iterative reconstruction Veo, ASiR-V)對圖像進行降噪。
1.3 圖像分析 將圖像傳輸至GE AW 4.7工作站,以GSI Viewer軟件進行分析。由2名分別具有7年和8年工作經驗的影像科主治醫師獨立閱片,評估以下各項,產生分歧時由第3名副主任醫師最終判定:①腫瘤厚度[9],即軸位CT所示腫瘤最大層面上腫瘤與其長軸垂直的最大短徑;②碘濃度(iodine concentration, IC)[10],于軸位碘圖上避開壞死和血管選擇腫瘤最大層面,沿腫瘤輪廓手動勾畫ROI,自動獲得IC;于同層面腹主動脈內避開動脈壁斑塊放置類圓形ROI,使其面積≥2/3腹主動脈,分別獲得動脈期IC(IC at arterial phase, ICAP)、靜脈期IC(IC at venous phase, ICVP)及延遲期IC(IC at delay phase, ICDP);根據公式計算標準化IC(normalized IC, nIC):nIC=病灶IC/腹主動脈IC,獲得nICAP、nICVP及nICDP;對每個病灶均重復測量3次,取平均值;③淋巴結狀態,發現淋巴結短徑>10 mm、不均勻強化及簇狀分布等時判定為陽性淋巴結[7];④Borrmann分型[7,11],根據腫瘤形態、范圍及有無潰瘍分為4型,Ⅰ為腫塊型,Ⅱ為局限潰瘍型,Ⅲ為潰瘍浸潤型,Ⅳ為彌漫浸潤型。
1.4 病理學分析 依據國際抗癌聯盟和美國癌癥聯合委員會聯合制定的第8版胃癌TNM分期標準[11]進行術后病理診斷,并判斷是否存在PNI。
1.5 統計學分析 采用SPSS 22.0和Medcalc 15.2統計分析軟件。以±s表示符合正態分布的計量資料,行studentt檢驗;以χ2檢驗或Fisher精確概率法比較計數資料。采用組內相關系數(intra-class correlation coefficient, ICC)評價觀察者間測量IC的一致性:ICC<0.40為一致性差,0.40~0.59為中等,0.60~0.74為好,0.75~1為非常好。以多因素logistic回歸分析篩選胃腺癌PNI的獨立影響因素。采用受試者工作特征(receiver operating characteristic, ROC)曲線分析IC參數診斷PNI的效能,以DeLong檢驗比較曲線下面積(area under the curve, AUC)。采用Hosmer-Lemeshow檢驗判斷獨立影響因素診斷PNI發生概率與實際PNI發生概率的擬合度(P>0.1為擬合度較好)。P<0.05為差異有統計學意義。
2 結果
2.1 患者基本資料及腫瘤病理特點 270例中,術后病理證實123例(123/270,45.56%)PNI(PNI組)、 147例無PNI(無PNI組);組間腫瘤厚度、Borrmann分型、術前臨床T分期(clinical tumor staging, cT)、CT報告淋巴結狀態、病理T分期(pathological tumor staging, pT)及病理N分期(pathological node staging, pN)差異均有統計學意義(P均<0.05),詳見表1及圖1、2。
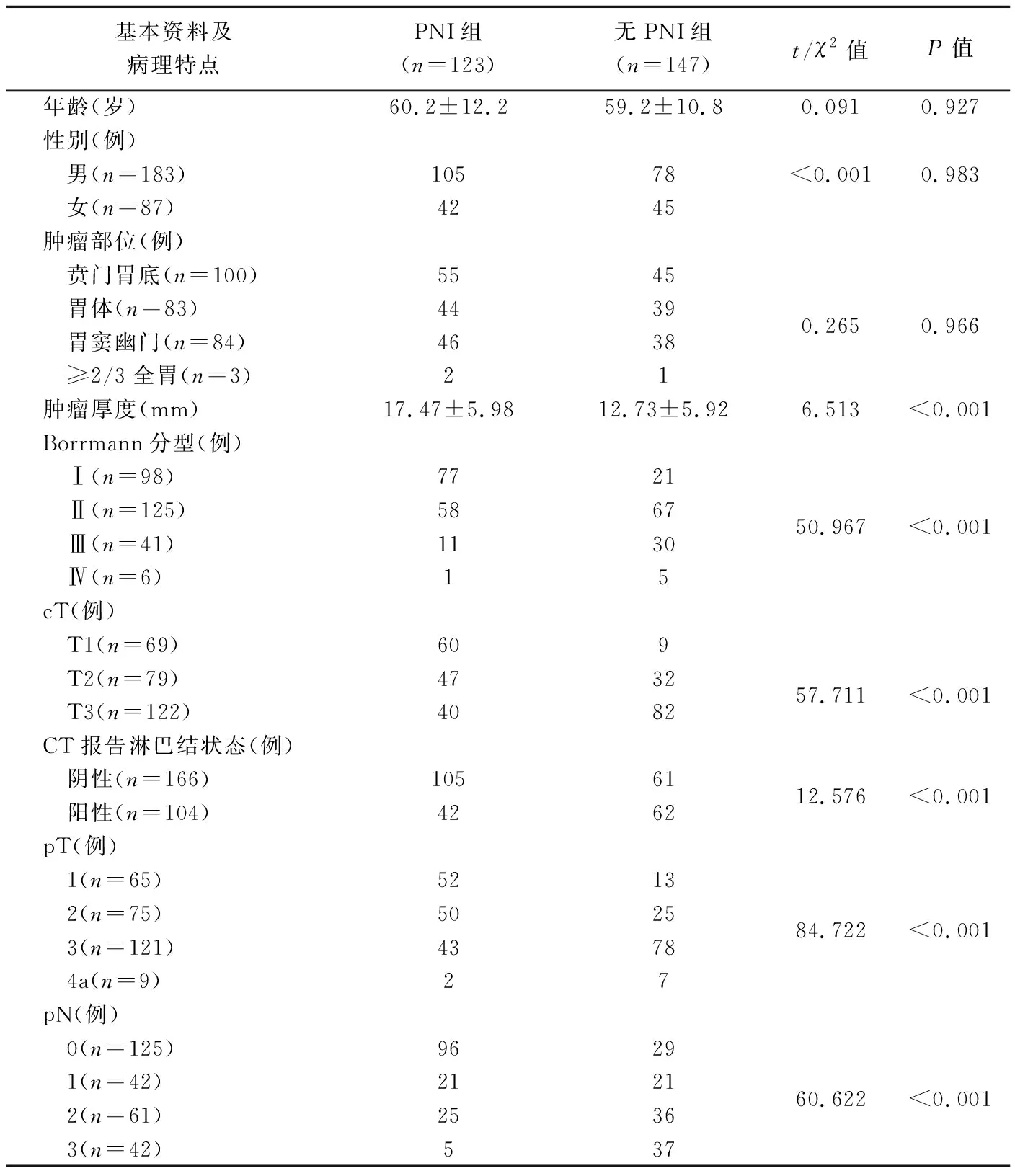
表1 有、無PNI胃腺癌患者基本資料及腫瘤病理特點比較

圖1 PNI組患者,男,55歲,低分化胃腺癌,術后病理分期pT3N1M0 A~C.分別為術前腹部動脈期、靜脈期及延遲期能譜CT碘圖,IC分別為30.19(100 μg/ml)、31.46(100 μg/ml)、32.09(100 μg/ml); D.術后病理圖(HE,×200)示胃壁深肌層見腺癌細胞包繞神經束

圖2 無PNI組患者,男,52歲,中分化胃腺癌,術后病理分期pT2N0M0 A~C.分別為術前腹部動脈期、靜脈期及延遲期能譜CT碘圖,IC分別為19.48(100μg/ml)、21.49(100μg/ml)、26.45(100μg/ml); D.術后病理圖(HE,×200)示病灶周圍胃壁周圍神經束完整,未見癌細胞
2.2 IC 觀察者間測量病灶ICAP、ICVP、ICDP、nICAP、nICVP及nICDP的一致性均非常好,ICC分別為0.926[95%CI(0.899,0.953)]、0.987[95%CI(0.983,0.997)]、0.985[95%CI(0.976,0.995)]、0.913[95%CI(0.897,0.953)]、0.927[95%CI(0.907,0.951)]及0.936[95%CI(0.905,0.962)]。
PNI組病灶ICVP、ICDP、nICVP及nICDP均高于無PNI組(P均<0.001);組間ICAP及nICAP差異均無統計學意義(P均>0.05),見表2。
表2 有、無PNI胃腺癌病灶IC參數比較(±s)

表2 有、無PNI胃腺癌病灶IC參數比較(±s)
組別ICAP(100 μg/ml)ICVP(100 μg/ml)ICDP(100 μg/ml)nICAPnICVPnICDPPNI組(n=123)21.25±6.4929.41±8.5529.00±8.580.19±0.060.53±0.120.65±0.14無PNI組(n=147)20.08±6.6925.16±7.0724.01±6.440.18±0.060.46±0.110.54±0.11t值1.4464.4545.4611.3925.0307.358P值0.149<0.001<0.0010.165<0.001<0.001
2.3 診斷效能 多因素logistic回歸分析顯示,cT(OR=3.114,95%CI(2.106,4.606),P<0.001]和nICDP[(OR=693.732,95%CI(54.925,8 762.259),P<0.001]是胃腺癌PNI的獨立影響因素。
ROC曲線分析顯示,cT、ICVP、ICDP、nICVP及nICDP診斷PNI的AUC分別為0.731、0.674、0.676、0.678及0.735;聯合cT和nICDP的AUC為0.832,優于上述單一參數(Z=4.673、4.915、5.325、3.765、5.001,P均<0.001),且nICDP的AUC高于ICDP、ICVP及nICVP(Z=1.978、2.543、2.401,P=0.048、0.011、0.016)。見表3、圖3。
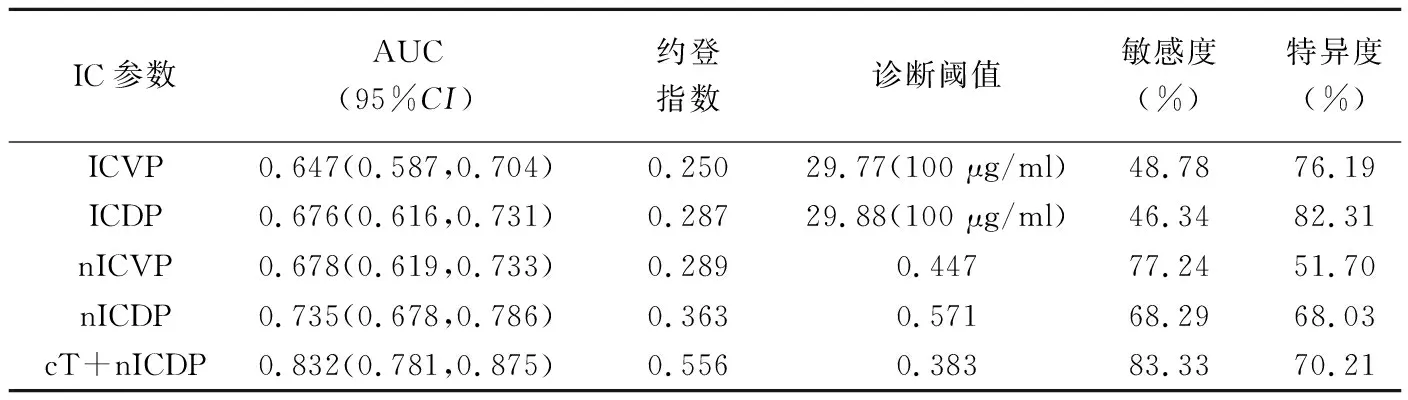
表3 胃腺癌IC參數診斷PNI的效能
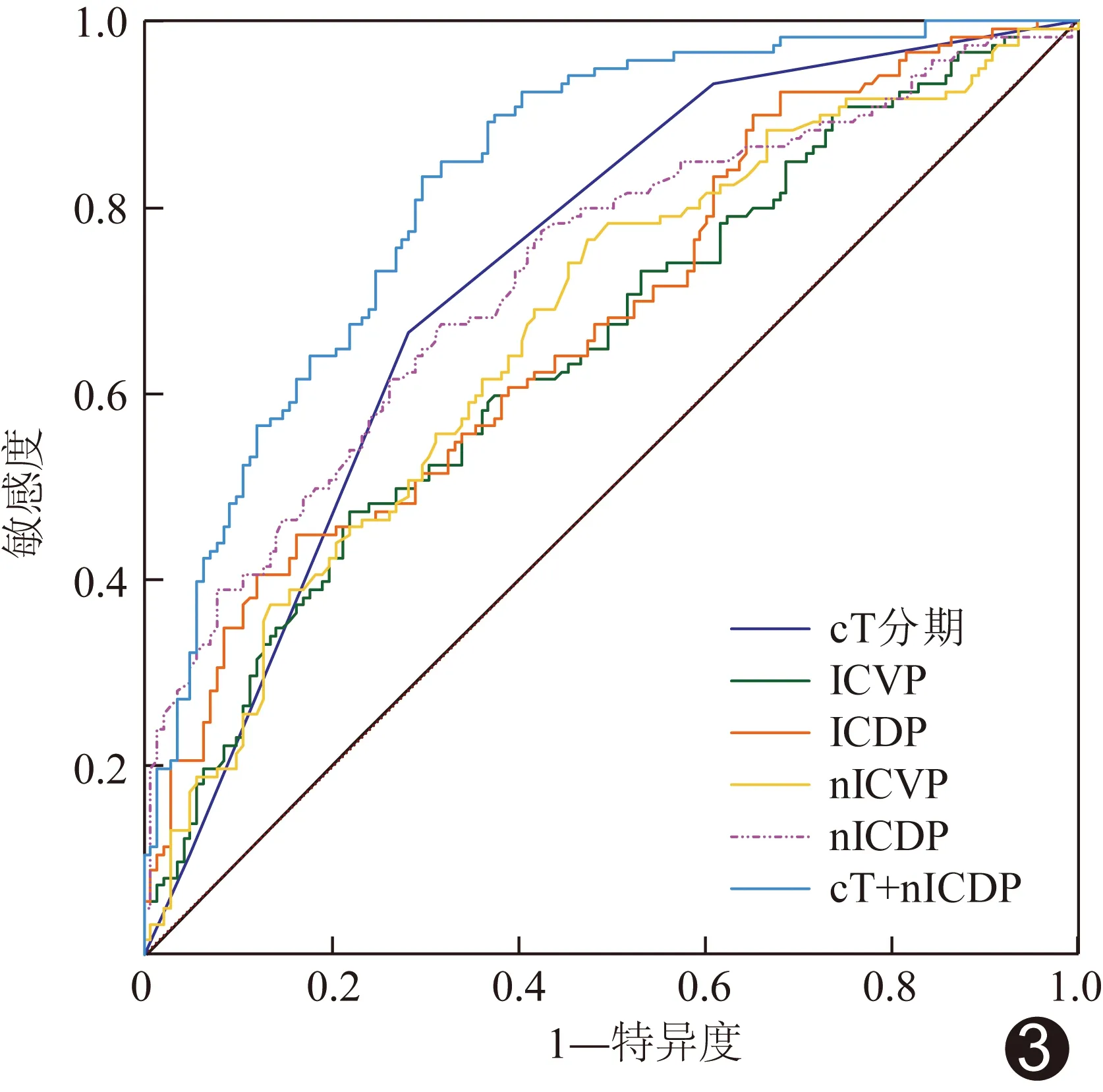
圖3 能譜CT相關IC參數單一及與cT聯合(cT+nICDP)診斷胃腺癌PNI的ROC曲線
Hosmer-Lemeshow檢驗顯示,聯合cT和nICDP診斷PNI發生概率與實際PNI發生概率的擬合度較好(χ2=11.871,P=0.157)。
3 討論
PNI是腫瘤復發和轉移的危險因素[12]。本研究納入270例胃腺癌患者,術后病理確診其中123例(123/270,45.56%)存在PNI,PNI發生率與國外報道(45.6%)[4]相當而低于國內報道(47.6%~62.45%)[5-6],可能與研究對象存在個體差異有關。胃周組織主要受迷走神經支配,且迷走神經主要分布于賁門[12]。但既往研究[3-6]和本研究結果均顯示PNI發生與腫瘤部位無關,提示神經分布位置并非影響PNI的關鍵因素。劉祥等[13]以增強CT相對強化值診斷PNI的AUC>0.7,但該研究為回顧性分析,樣本量少(48例),結果的可重復性和泛化性需進一步驗證;且常規CT缺少定量指標,所能反映的組織特征有限。血管生成是腫瘤侵襲性生長的基礎[11]。既往研究[8,10]證實,IC與微血管密度和血管內皮細胞生長因子水平呈正相關。能譜CT可定量檢測組織IC,進而可無創、量化腫瘤血管生成而有效檢出PNI。
胃癌以靜脈期顯著強化為其典型特點,其基礎在于胃癌間質纖維豐富,導致對比劑流出延緩并在瘤內滯積[8,14]。ICVP和ICDP代表對比劑在胃癌病灶間質滯留的平衡狀態[15],可反映胃癌血供情況。PNI使癌組織攝碘增多,本研究PNI組病灶ICVP和ICDP高于無PNI組。理論上,nIC可去除個體循環差異的影響,其客觀性及穩定性均高[7-8]。本研究發現PNI組nICVP及nICDP均高于無PNI組,且二者均能有效診斷PNI;多因素logistic回歸分析顯示,cT和nICDP是胃腺癌PNI的獨立影響因素,二者聯合診斷PNI的效能優于各單項指標。
本研究存在以下局限性:①僅納入胃腺癌,未包含其他類型胃癌;②僅針對單一層面所示腫瘤實性成分勾畫ROI并進行分析,可能無法充分反映腫瘤的異質性;③基于基線期胃癌能譜CT表現進行分析,未考慮病理指標如分化程度、Lauren分型等對IC的潛在影響。
綜上所述,能譜CT能有效診斷胃腺癌PNI,尤其nICDP;與cT聯合可進一步提高診斷效能。

