大動脈轉位的外科治療:單中心的臨床治療經驗
姜愛萍,李星寰
(云南省阜外心血管病醫院/昆明醫科大學附屬心血管病醫院 麻醉科,云南 昆明 650102)
大動脈轉位(transposition of the great arteries,TGA)包括完全型大動脈轉位(dextrotransposition of the great arteries,D-TGA)與矯正型大動脈轉位(congenitally corrected TGA,CC-TGA);D-TGA發病率約為每10 000個活產嬰兒中2例[1],CC-TGA發病率約為每33 000個活產嬰兒中1例[2]。目前,D-TGA的標準外科治療方法為大動脈調轉術(arterial switch operation,ASO);CC-TGA由于合并多種心臟畸形,病理生理改變復雜,臨床癥狀多樣,需要接受個體化外科治療。本院自2017年9月-2022年7月共收治TGA患者10例,其中D-TGA患者4例,均為兒童,CC-TGA患者6例,3例為兒童,3例為成人,現將治療經驗總結報告如下。
1 資料與方法
1.1 臨床資料
本研究為回顧性研究,納入2017年9月-2022年7月在云南省阜外心血管病醫院接受外科治療的TGA患者共10例,其中D-TGA患者4例,CC-TGA患者6例,患者術前基本資料見表1。
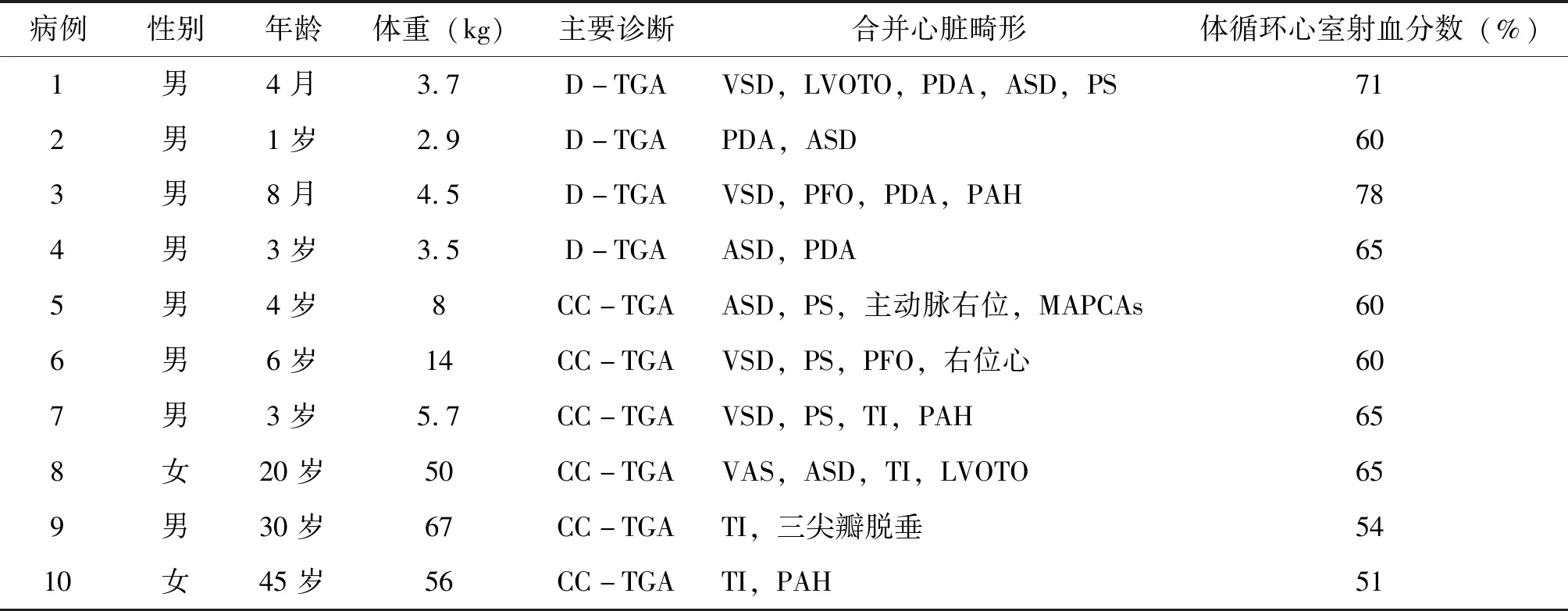
表1 接受外科治療的大動脈轉位患者術前臨床資料
1.2 外科手術方法
4例D-TGA患者均接受ASO手術。
6例CC-TGA患者中,3例為兒童,2例患兒一期行肺動脈環縮術,以期在緩解癥狀的同時鍛煉左心室功能,再擇期完成雙心室解剖矯治;其中1例患兒由于肺動脈環縮術后脈搏氧飽和度難以維持在75%以上,同期行雙向Glenn手術(上腔靜脈與肺動脈端側吻合連接手術)。另外1例患兒由于就醫年齡較大,左心室退化明顯且已失去心肌重塑性,無雙心室矯治可能,本次入院一期行雙向Glenn手術,將最終完成全腔靜脈肺動脈連接術(單心室矯治)。另外3例患者為成人,均接受了解剖三尖瓣(功能二尖瓣)置換手術。
1.3 術后隨訪
記錄患者住院死亡率、早期死亡率(術后30 d內死亡)、術后并發癥、再次手術干預等情況。所有患者出院后1、3、6和12個月常規回院復查,之后每年復查一次,復查時評估一般情況和超聲心動圖。
2 結果
患者無住院死亡與早期死亡。2例患者術后接受再次手術干預,其中1例D-TGA患兒術后第一天夜間由于循環難以維持,床旁超聲提示疑似左心房血塊壓迫,急診行開胸血腫清除術,其后臨床過程平穩;1例CC-TGA患兒行肺動脈環縮術加雙向Glenn手術,術后第一天夜間缺氧癥狀加重,考慮肺動脈環縮帶過緊導致肺血流過少,急診行肺動脈環縮擴大術并拆除雙向Glenn手術,其后臨床過程平穩。患者術中術后信息見表2,所有患者出院后在隨訪期間內尚未出現手術相關并發癥。
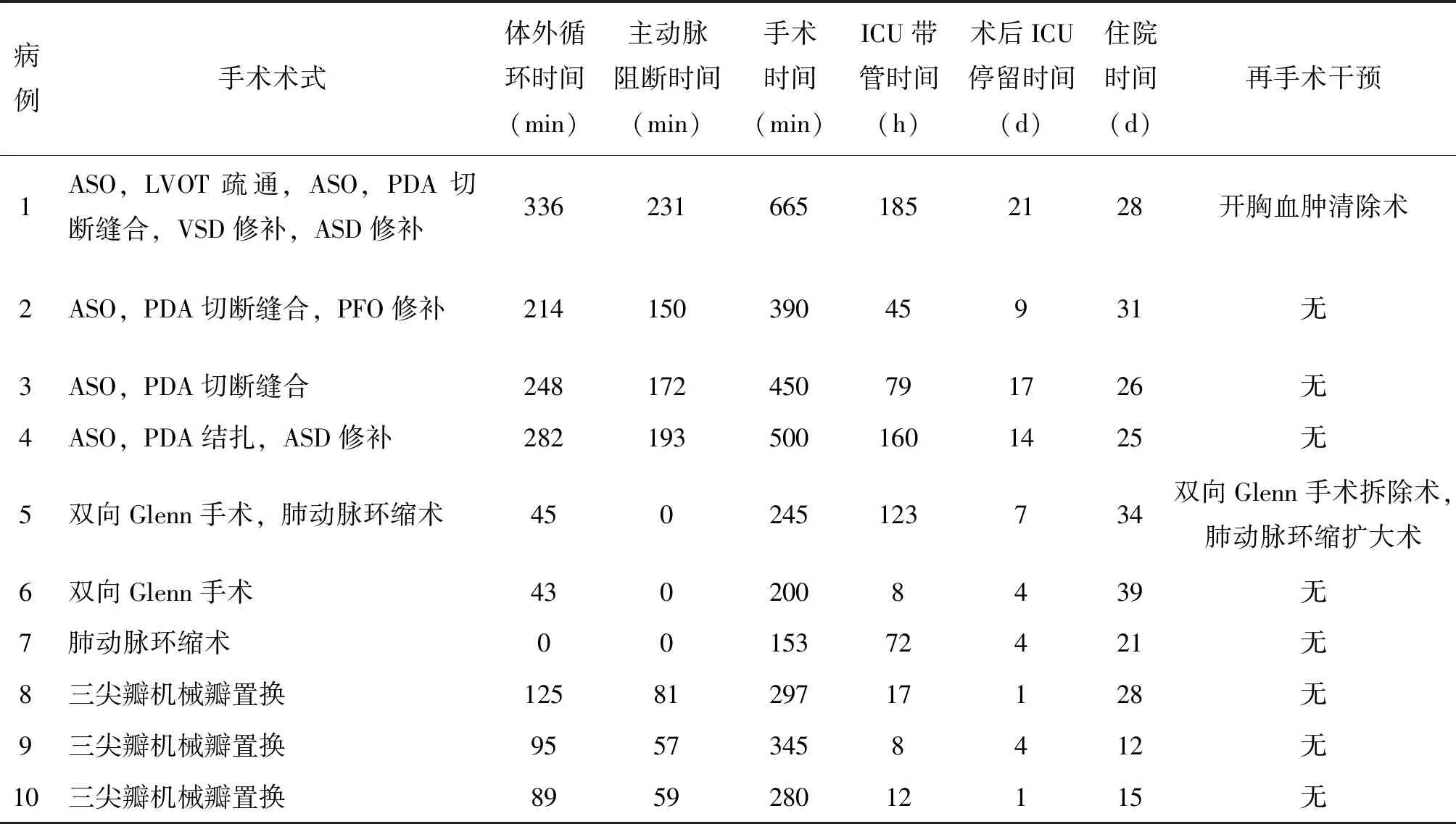
表2 接受外科治療的大動脈轉位患者術中術后臨床資料
3 討論
3.1 D-TGA的外科治療
D-TGA的特征為心室-大動脈連接不一致:左室發出肺動脈,右室發出主動脈;如果沒有合并額外的心臟畸形,為室間隔完整的(TGA-intact ventricular septum,TGA-IVS),如果合并其它的心內心外畸形,則是復雜D-TGA,包括合并室間隔缺損(TGA-VSD,約占病例總數的45%)、合并左室流出道狹窄(約占病例總數的25%)、合并主動脈弓縮窄(約占病例總數的5%)[3]。ASO通過解剖學矯治重建心室-大動脈連接的一致性,已成為TGA-IVS 與TGA-VSD的標準外科治療術式,心房調轉術(Mustard術或Senning術)作為一種歷史性的治療方式僅用于非常有限的患者。
3.1.1 D-TGA外科治療的手術時機
TGA-IVS最佳手術時機為出生后3周內,否則隨著肺循環阻力下降不可避免的發生左心室退化。在患兒出生后第1周的末期就可考慮擇期ASO,對于出生后嚴重紫紺的患兒,為避免球囊房間隔造口術甚至可以在出生后幾小時內接受ASO[3]。患兒最晚應該在出生后2個月內接受ASO,大于2個月的患兒建議一期行左心室訓練,待左心室心肌質量大于(35±5)g/m3的安全閾值后二期再行ASO。對于錯過最佳手術年齡的患兒,若術中測肺動脈收縮壓不足主動脈的1/2,一期采用肺動脈環縮術同時擴大房間隔缺損,將主肺動脈近心端收縮壓提升至主動脈收縮壓的70%左右,以此鍛煉左心室,為保證吸入氧濃度FiO260%~70%時患兒脈搏氧飽和度達到75%以上,必要時可同期加行體肺分流術增加肺循環供血[4]。隨著外科技術發展與嬰幼兒ECMO技術不斷成熟,國外經驗認為在有ECMO支持的背景下,可以把TGA-IVS一期ASO的治療時間窗延長到出生后6個月[5]。對于TGA-VSD,由于合并室間隔缺損存在心內分流,患兒不容易發生左心室退化,但當不合并肺動脈瓣狹窄時,肺循環血量過多最終導致肺動脈高壓。TGA-VSD患兒的最佳手術時機為出生后6個月,合并重度肺動脈高壓將嚴重影響手術預后甚至成為手術禁忌癥。對于大于6個月的患兒,可先通過藥物治療(如內皮素受體拮抗劑和西地那非等)或行肺動脈環縮術限制肺血后,二期行ASO。本院收治的4名D-TGA患兒均一期完成ASO,目前預后良好,其中:2例TGA-IVS患兒入院時已錯過最佳手術時機,但術中測肺動脈收縮壓為主動脈根部壓力的1/2~2/3,充分評估后認為患兒左室功能尚且保留,可耐受一期ASO,手術過程順利;2例TGA-VSD患兒,1例符合一期ASO指征,另1例入院時已合并中度肺動脈高壓,術前接受規律藥物治療后右心導管檢查提示吸氧后肺循環阻力明顯下降,故一期行ASO治療,目前恢復良好。
3.1.2 ASO的預后
ASO手術在我國開展了20多年,相關大樣本量長期隨訪的臨床研究較為有限。2017年青島阜外心血管病醫院報道了2006年6月-2012年12月在該院接受ASO手術患者的隨訪,結果顯示,納入的156例TGA患兒均在新生兒期接受ASO手術,術中無死亡病例,92例(58.97%)由于心肌水腫延遲關胸,21例(13.46%)發生術后感染,8例(5.13%)發生新建肺動脈狹窄,18例(11.54%)發生低心排綜合征,17例(10.90%)發生呼吸道異常,13例(8.33%)發生心律失常,10例(6.41%)發生吻合口出血,其他并發癥9例(5.77%);術后5年死亡率18.59%,再手術率12.82%;冠狀動脈異常、低心排綜合征是導致患者不良預后的獨立影響因素[6]。2020年廣東省心血管病研究所通過雙向隊列研究,納入了1997年至2016年接受ASO的患者共571例,報道的術后總死亡率和住院死亡率分別為 16.3%和15.1%,5年、10年和15年的累積生存率分別為83.3%、82.8%和82.8%[7]。國外開展ASO手術早于我國近20年,目前國外大型醫療中心報道的ASO早期術后死亡率約3%,若合并室間隔缺損,住院期間死亡率可能達到6.4%;10年生存率為88%~94%,10年內無需二次手術患者約占82%,其中96.7%的患者可繼續存活至術后25年,期間二次干預率為3.8%;患者成年后主要面臨的術后晚期并發癥包括:冠狀動脈阻塞,進行性的新建主動脈的擴張,進行性的新建肺動脈的狹窄和右室流出道梗阻[8]。歐洲一項最近發表的回顧性研究納入了490名ASO術后患者并進行了43年的隨訪。該研究發現,對于順利出院的ASO患者,10年總體生存率為97.9%,20年為94.5%,30年和40年均為94.5%,總體預后良好[9]。隨著我國復雜先心病早期篩查與診療體系的穩步完善,越來越多的患兒將在手術時間窗內就診,ASO手術預后將逐漸達到國際水平。
3.2 CC-TGA的外科治療
CC-TGA 的特征為心房心室連接不一致,且心室大動脈連接不一致,呈現為右心房-左心室-肺動脈連接,左心房-右心室-主動脈連接。約80%的CC-TGA患者合并其它心臟畸形,包括室間隔缺損(60%~80%)、左室流出道狹窄(25%~50%)、主動脈縮窄與弓發育不良(約10%)、三尖瓣Ebstein 樣畸形(約30%)、右位心和中位心(20%~25%)、心臟傳導系統異常(15%~50%)、內臟反位(5%~8%)[10,11]。不合并室間隔缺損與左室流出道狹窄的CC-TGA患者可生存至成年而無須任何治療,在疾病后期由于形態學右心室功能減退與解剖三尖瓣(功能二尖瓣)反流,需行解剖三尖瓣(功能二尖瓣)置換手術。本院完成3例成人CC-TGA患者解剖三尖瓣(功能二尖瓣)置換手術,一般認為該類手術應運用在心室射血分數保留(至少>40%)的患者[12]。對于兒童時期已經出現功能障礙與中度以上三尖瓣反流的患者,如果就診時年齡較大,心室失去重塑性,一般認為此類患者已經失去手術矯治的機會,可按照心力衰竭的處理策略治療,必要時考慮心臟移植。對于有機會接受外科矯治的患者,根據合并心臟畸形不同、形態學右心室與形態學左心室功能不同、年齡不同,需選擇個體化外科治療方案,包括肺動脈環縮術,和解剖矯治手術包括雙心室矯治、“一個半”心室矯治、單心室矯治。肺動脈環縮術除作為一期手術進行限制肺血或左心室功能鍛煉外,還是一種緩解性治療方法,它通過增加左心室壓力以減少室間隔左移,可以減輕三尖瓣反流并穩定右心室、室間隔、左心室和瓣下結構的正常解剖位置。解剖矯治手術術式的選擇一般根據各醫療中心臨床經驗決定,可行雙調轉手術(心房調轉+ASO)、心房調轉+雙動脈根部調轉手術、心房調轉+Rastelli手術(內隧道外管道手術,建立室間隔至主動脈內隧道與右心室外管道至肺動脈連接)、 心房調轉+Rastelli+雙向Glenn手術(“一個半”心室矯治術),Fontan手術(單心室矯治手術)。2021年中國醫學科學院阜外醫院回顧了2004年8月-2019年5月在該院完成解剖矯治手術的120例CC-TGA患兒,其中:49例單純CC-TGA接受雙調轉手術;33例合并限制性室間隔缺損/左心室流出道狹窄/異位心或右心室功能不良,接受Mustard+Rastelli+雙向Glenn手術;24例合并非限制性室間隔缺損及左心室流出道狹窄,接受Senning+Rastelli手術;14例合并遠離性室間隔缺損及左心室流出道狹窄,接受Senning+雙動脈根部調轉手術[13]。北美地區一項最新發表的研究通過收集The Society of Thoracic Surgeons Congenital Heart Surgery Database(STS-CHSD)系統數據,分析了985例CC-TGA患者外科治療手術類型與相關死亡率及術后并發癥[14]。研究結果顯示,患者主要接受了Fontan手術、雙調轉手術、心房調轉+Rastelli手術、三尖瓣置換或成形、室間隔缺損修補術和心臟移植;其中心房調轉+Rastelli手術死亡率、術后并發癥發生率、嚴重并發癥發生率均最高,分別為8.4%、71.4%、38.2%,雙調轉手術為5.7%、61.8%、31.7%,Fontan手術為2.6%、51.6%、24.1%。總之,CC-TGA的外科治療策略仍在探索中,需要更多的臨床證據支持。
綜上所述,TGA患者外科治療策略的制定充滿挑戰。對于D-TGA患者,ASO是外科治療標準術式,但手術時機仍存在爭議,還需更多臨床循證證據的累積。而對于CC-TGA患者,目前尚無外科治療標準,個體化治療策略多根據各個醫療中心臨床經驗決定,這也是先天性心臟病外科治療團隊技術水平的體現,更是亟待攻克的難關。

