原核生物轉錄調控研究技術及進展
陳臣 黃芝陽 于海燕 袁海彬 田懷香
(上海應用技術大學香料香精技術與工程學院,上海 201418)
繼Francois Jacob和Jacques Monod在操縱子學說中提出基因轉錄調控的概念之后,科學家開始意識到轉錄調控在原核生物調控中的重要性。1995年實現了第一個原核生物的全基因組測序[1],隨著測序技術不斷地進步,大量完整的基因組序列快速出現[2-3],尤其是人類基因組計劃的順利進行,使得研究的焦點由結構基因組學過渡為功能基因組學[4],而基因轉錄調控正是功能基因組學的一個重要內容。
基因的調控可在多個層次上進行,包括基因水平、轉錄水平、轉錄后水平、翻譯水平和翻譯后水平的調控。與真核生物相比,原核生物的調控主要發生在轉錄水平,根據調控機制的不同可分為負轉錄調控和正轉錄調控。由于調控的關鍵步驟主要是在啟動子的轉錄階段,所以對啟動子和轉錄進行研究具有重要的意義。啟動子附近存在一段特定序列能夠結合稱為轉錄因子(transcription factors,TFs)的蛋白質,結合RNA聚合酶并由此起始基因轉錄[5],轉錄因子在調節細菌中的基因表達方面起核心作用,它通過與位于啟動子區的結合位點(transcription factor binding sites,TFBSs)相結合,從而激活或抑制相應基因的轉錄。歷史上,研究最多的轉錄因子之一是大腸桿菌(Escherichia coli)的乳糖阻遏蛋白[6]。近年來,在解析微生物生理功能或某些功能成分生物合成研究中的轉錄因子不斷被挖掘,轉錄因子與結合位點及其調控方式已經成為研究的熱點。大量研究表明,找到這些特定的片段和位點對于研究基因的轉錄調控有重要的意義,有助于進一步揭開蛋白質與核酸相互作用的規律,了解原核生物的基因轉錄調控機制。隨著分子生物學及相關技術研究不斷發展與完善,一些新的方法應運而生,為闡明原核生物的基因調控提供了有力的工具。通過改造原核生物的轉錄調控網絡,調整代謝流向構建高效的細胞工廠,更好發揮原核生物作為生產宿主的優勢,對于突破傳統代謝工程方法改變細胞表型及提高目標化合物產量等方面具有廣闊的前景[7]。
本文主要綜述了有關原核生物轉錄調控中核酸-蛋白質相互作用現有的一些研究技術,包括凝膠電泳遷移率實驗(electrophoretic mobility shift assay,EMSA)、DNase I footprinting技術、染色質免疫共沉淀(chromatin immunoprecipitation,ChIP)技術、微量熱泳動技術(MicroScale Thermophoresis,MST)、等溫滴定量熱法(isothermal titration calorimetry,ITC)及細菌單雜交系統(bacterial-one-hybrid system,B1H),分別從6種方法的原理、應用和優缺點等方面進行介紹(表1),并展望了未來的研究熱點,為進一步闡明原核生物的基因調控提供借鑒。
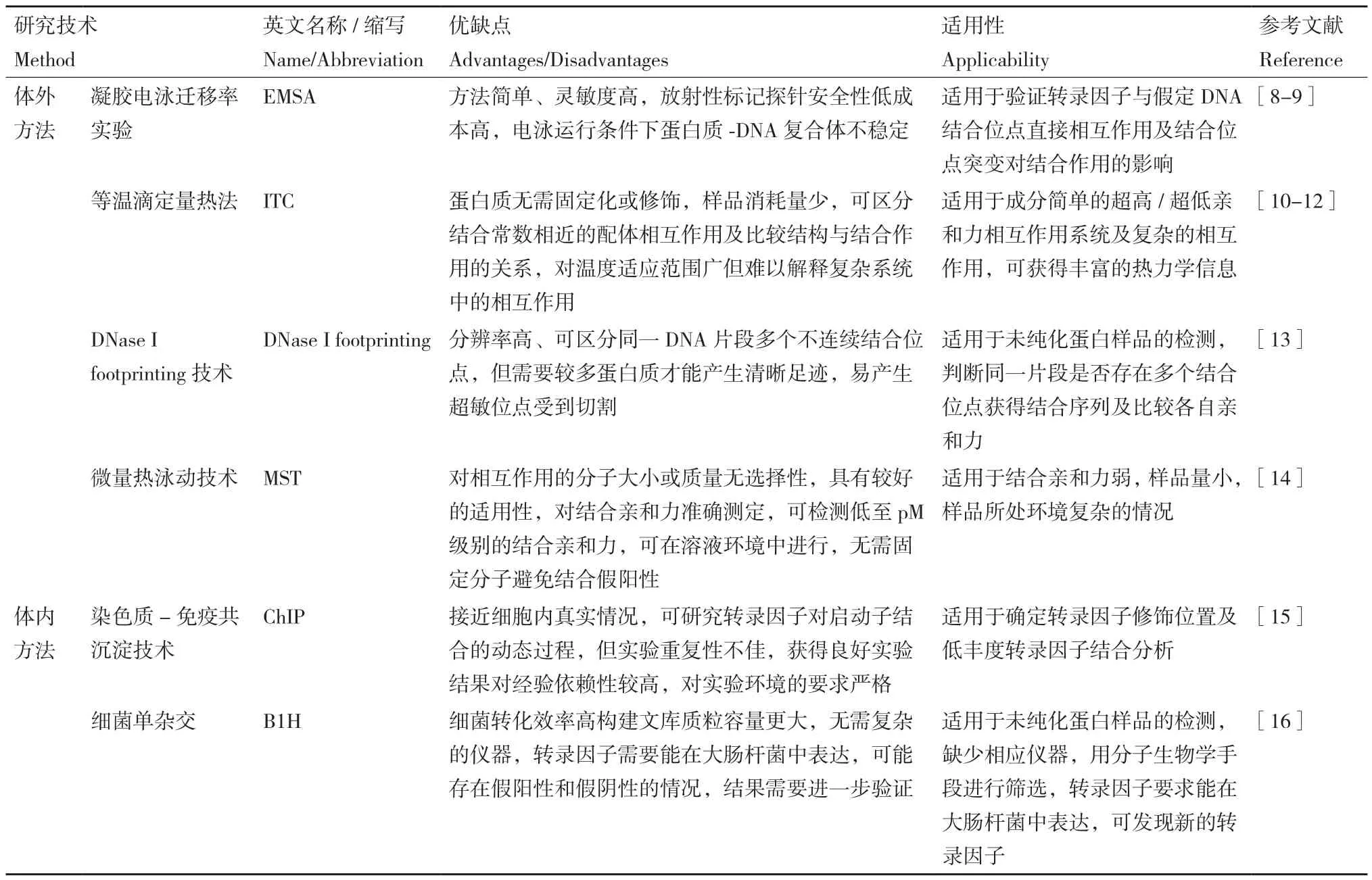
表1 原核生物轉錄調控研究技術總結Table 1 Summary of research techniques on transcriptional regulation in prokaryotes
1 凝膠電泳遷移率實驗(EMSA)
1.1 EMSA基本原理
EMSA是一種在體外研究蛋白質與核酸相互作用的簡單、廉價、快速而靈敏的技術,它可實現對目的蛋白與核酸作用的定性和定量分析[8,17],此外,還可用于熱力學和動力學參數的定量測量以及構象變化的分析[18]。EMSA的作用原理為(圖1):通常是將寡核苷酸標記的DNA或RNA探針與DNA特異結合蛋白或RNA一同孵育,隨后通過非變性聚丙烯酰胺凝膠電泳(non denaturing polyacrylamide gel electrophoresis,Native-PAGE)分離蛋白質-核酸復合物與游離的探針。由于目的蛋白與核酸探針結合后分子量增大,故其電泳遷移率會降低,在凝膠中將會看到阻滯的條帶[17]。其電泳遷移率是生物分子的固有物理性質,與生物大分子大小、電荷和分離介質的粘度有關[19]。根據所顯示滯后帶的有無和量的多少,來反映DNA結合蛋白與DNA探針的結合活性和特異性,并可以計算出兩者的結合常數或解離常數。
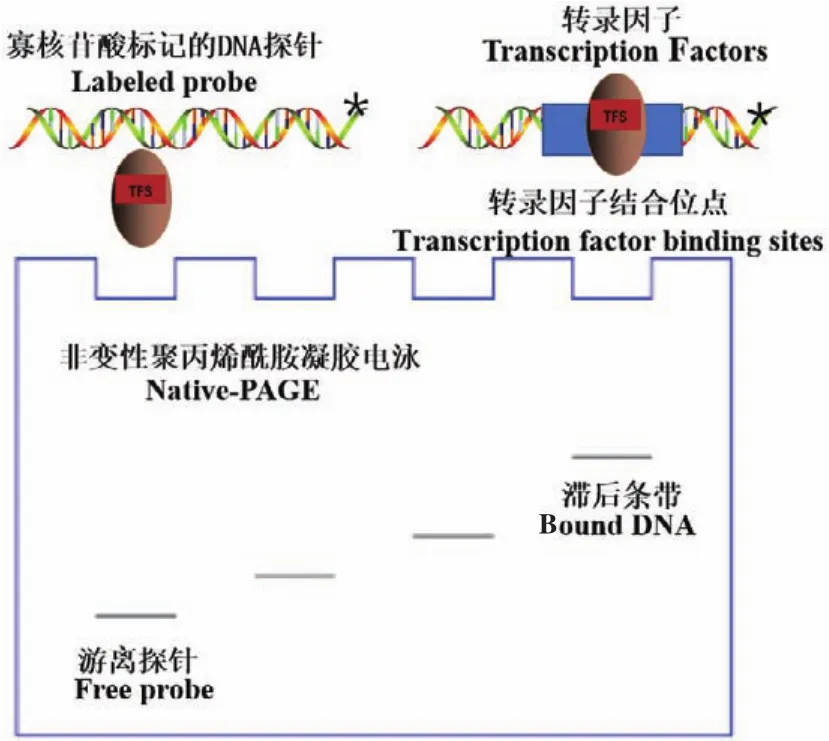
圖1 EMSA實驗的基本原理Fig.1 Basic principle of EMSA experiment
1.2 EMSA鑒定轉錄調控因子-結合位點直接相互作用及適用性分析
EMSA實驗有許多優點,傳統的EMSA實驗一般采用放射性同位素(32P)標記核酸探針,其基本操作技術簡單,靈敏度高,研究表明,即使待測樣品的濃度≤0.1 nmol/L,樣品的體積≤20 μL也可進行測定[8]。但是同位素的半衰期短,實驗周期長,對人體及環境均會產生危害且處理成本高[20]。因此許多研究者對該方法進行了改進,出現了采用生物素或地高辛標記的核酸探針代替傳統的放射性同位素標記的探針,利用堿性磷酸酶或辣根過氧化物酶化學發光檢測系統檢測[21]。例如葛興楓等[22]利用經蛋白酶K消化步驟優化的生物素標記的EMSA方法,也可明顯觀察到核酸適配體與靶蛋白結合的阻滯條帶,與同位素標記的EMSA實驗無明顯差異。此外這兩種方法安全、成本低且檢測時間短。然而Vavrova等[20]研究表明,網織紅細胞系統體外翻譯蛋白質不適用于非放射性EMSA,因為網織紅細胞裂解物中存在干擾的生物素化蛋白質;Tokunaga等[23]也發現在使用地高辛標記的探針檢測轉錄因子的過程中陰性對照實驗存在相當大的非特異性變化帶的問題,影響目標蛋白的檢測。另一個限制因素是電泳過程中蛋白質與核酸的復合物處于非化學平衡狀態,轉錄因子的結合作用可能被減弱,同時某些絡合物在凝膠中的穩定性顯著高于溶液環境,使得轉錄因子與DNA的親和力檢測結果偏低,或是EMSA實驗對某些相互作用分子的研究效果不佳[8,24]。
EMSA實驗的主要應用之一是鑒定轉錄因子與DNA結合蛋白的作用位點,Brown等[25]在研究德氏乳桿菌乳酸亞種CRL581(Lactobacillus delbrueckii subsp.lactis CRL 581)中與蛋白水解系統相關的基因時,通過EMSA實驗發現YebC與蛋白水解酶系統相關基因prtL、oppA1和opts啟動子區域結合,表明YebC是關鍵蛋白水解酶基因的轉錄調控因子。王麗濱[26]利用EMSA實驗驗證了碳代謝調控蛋白A(catabolite control protein A,CcpA)與肺炎鏈球菌(Streptococcus pneumoniae)莢膜多糖基因座轉錄調控區域的結合,為研究肺炎鏈球菌的致病機理及防治提供了理論依據。本課題組研究植物乳桿菌CcpA對碳分解代謝抑制作用(carbon catabolite repression,CCR)的調控作用時,通過EMSA證實CcpA與分解代謝反應元件(catabolite responsive element,cre)位點的結合[27]。
EMSA是一項較為成熟的研究DNA-蛋白質相互作用的技術,可獲得蛋白質-核酸相互作用的親和力、特異性、動力學特性及最小結合位點。EMSA的優點是可以分析與核酸結合的多個蛋白質或蛋白質復合體,但EMSA在體外進行實驗不能精確揭示體內蛋白質-DNA的相互作用,轉錄因子需要通過硫酸銨分步沉淀、凝膠過濾層析、離子交換層析等技術進行一定程度的純化,增加了實驗操作的復雜性。此外有許多變量只能通過經驗確定,要根據具體相互作用的物質調整反應條件和凝膠運行條件,核酸靶標、結合反應的條件以及凝膠電泳的條件是實驗優化主要考慮的因素[28]。
2 DNase I footprinting技術
2.1 DNase I footprinting基本原理
DNase I footprinting技術是用于體外研究蛋白質與DNA結合位點的方法。它的原理是(圖2):首先對待測雙鏈DNA片段中一條鏈的一端選擇性地進行標記,再加入適當濃度的脫氧核糖核酸酶I(DNase I),在DNA雙鏈上形成缺口,經過變性后聚丙烯酰胺凝膠電泳分離,放射自顯影,即形成以相差一個核苷酸為梯度的DNA條帶[29]。但當DNA片段與相應的序列特異性DNA結合蛋白結合后,DNA結合蛋白可局部抑制DNase I對相應DNA片段的消化,因此在放射自顯影圖譜上,DNA梯度條帶在結合區域中斷,從而形成一空白區域,恰似蛋白質在DNA片段上留下的足跡,根據其放射自顯影呈現的結果把這種研究DNA-蛋白質特異性結合的方法形象地稱為足跡法。如果要得出與目的蛋白特異性結合的堿基序列,可以進一步對DNA進行測序。經過40余年的發展DNase I footprinting技術不斷得到完善,包括:(1)對雙鏈DNA片段其中一條鏈進行標記時采用生物素進行末端標記,避免放射性同位素的摻入,減少危害;(2)可利用固定相磁珠對傳統DNase I footprinting技術進行改進,在獲取特異性DNA結合蛋白時省略了硫酸銨分步沉淀、離子交換層析、凝膠過濾層析等蛋白純化步驟,可適用于未經純化的蛋白粗提物內特異性DNA結合蛋白的研究,與傳統方法相比具有操作簡便、效率高、使用范圍更廣泛等顯著優勢[30]。
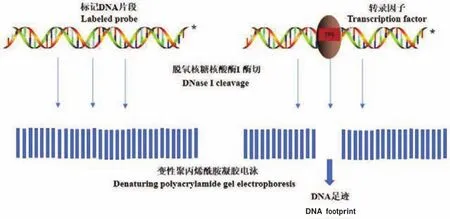
圖2 DNase I footprinting技術基本原理Fig.2 Basic principle of DNase I footprint technology
2.2 DNase I footprinting獲取結合位點及適用性分析
DNase I footprinting技術在研究生物體轉錄調控中有廣泛的應用,常用來得到對某個確定基因具有調控作用的調控因子在基因組上的結合位點。Gong等[31]研究短鏈乳桿菌(Lactobacillus brevis)GlnR對谷氨酸依賴的耐受性的調節作用,為確定GadR基因和gadCB操縱子的GlnR結合位點,用6-羧基熒光素(6-FAM)標記的DNA片段進行DNase I footprinting分析發現了PgadR’和PgadCB’分別和GInR的結合序列。Ihara等[32]研究大腸桿菌在L-丙氨酸積累后,編碼一種L-丙氨酸輸出蛋白的alaE基因的表達受到氮代謝全局調控因子亮氨酸反應調節蛋白(LRP)的正向調控,為進一步識別LRP的結合位點采用了DNase I footprinting技術找出LRP與alaE上游區域-161- -83 bp的核苷酸序列結合。較多情況下轉錄因子與受到調控作用的基因存在多個結合位點,DNase I footprinting技術能找出位于同一片段不連續的結合位點并獲得各自的結合序列。Yang等[33]研究植物乳桿菌(Lactobacillus pl-antarum)在高濃度乙醇環境下的強適應性發現調節因子AcrR與編碼3-羥基酰基-ACP脫水酶(FabZ1)基因的啟動子PFabZ1結合調控FabZ1的轉錄表達,利用DNase I footprinting技術獲得PFabZ1上兩個特異的AcrR結合位點。
與其他轉錄調控研究技術相比,DNase I footprinting技術不僅證實了DNA序列與目標蛋白質特異性結合,還可以得出調控因子與DNA調控元件特異性結合的DNA序列,為研究生物體轉錄調控網絡提供了極大的便利。DNase I footprinting也可用于研究EMSA技術表現不佳的轉錄因子,例如一種相對低親和力的DNA結合蛋白xUBF在DNase I footprinting分析中取得比EMSA更好的效果[13]。但在進行DNase I footprinting分析時要有足夠多的蛋白質才能產生清晰的足跡,而蛋白質含量增加要求DNase I濃度也要相應升高,由于DNase I本身是一種蛋白,也可競爭結合在相應的位點干擾蛋白質結合靶基因出現假陽性影響實驗結果準確性,所以實驗前必須仔細滴定DNase I濃度[34]。
3 染色質-免疫共沉淀技術(ChIP)
3.1 ChIP基本原理
ChIP技術是研究蛋白質和基因組DNA特定區域相互作用一種有效的方法[35],是用于評估蛋白質與體內特定DNA區域結合的多用途技術。1993年,在果蠅的培養細胞中,Polycomb阻遏蛋白是第一個使用ChIP技術進行定位的蛋白質,為了解其生物學功能奠定基礎[36]。ChIP技術是一個多步驟的過程,每個步驟都需要標準化以獲得最佳結果。其作用原理為(圖3)[37]:通常是在生理狀態下將細胞內的DNA與蛋白質交聯在一起[37],通過機械或酶消化將染色質碎片化后,用目的蛋白的特異性抗體免疫沉淀富集DNA-蛋白質交聯復合體[38],只有與目的蛋白結合的DNA才能被沉淀下來,獲得目的蛋白結合的DNA后,通過PCR、芯片和測序技術等,以定量檢測特定的DNA靶標[15]。ChIP技術可用于分析轉錄因子、轉錄輔因子、DNA復制因子和DNA修復蛋白的結合[39],是研究細胞內蛋白質-DNA相互作用的重要技術。
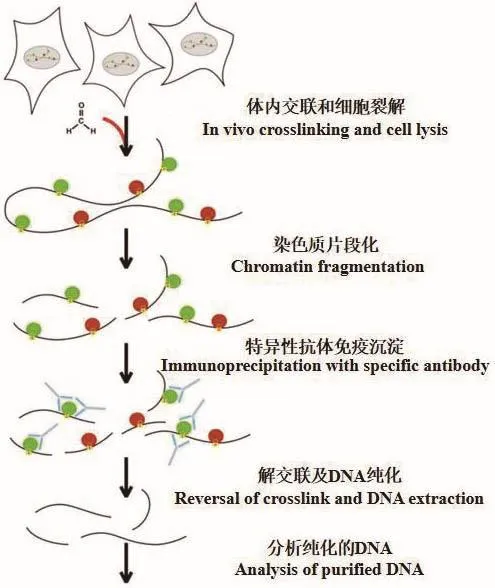
圖3 ChIP實驗的基本原理Fig.3 Basic principle of ChIP experiment
3.2 ChIP篩選結合位點及適用性分析
最初,ChIP技術用于研究高乙酰化組蛋白與特定DNA序列的結合,以進一步了解組蛋白乙酰化在轉錄中的作用[40]。近年來,為確定轉錄因子在基因組內的結合位點并監測其分布的動態變化,開發了與芯片雜交結合的染色質免疫沉淀技術(ChIP-chip),并且已經被廣泛應用于鑒定真核生物基因組上DNA結合蛋白的位置[41],研究表明此方法也可用于原核生物。Ratib等[42]利用ChIP-chip技術先在體內交聯DNA-蛋白質復合物再與基因芯片雜交檢測到ChvI蛋白除EMSA實驗獲得的其他結合位點,通過ChIP-chip技術獲得了較其他體外檢測方法更多的與ChvI蛋白直接結合的靶基因。Yun等[43]利用ChIP-chip技術篩選惡臭假單胞菌KT2440(Pseudomonas putida KT2440)基因組中調控因子Pmr、TurA和TurB的結合區域。
ChIP與高通量測序相結合(ChIP-seq)是體內蛋白質-DNA相互作用的全基因組分析的有力工具。基本原理是先獲得與轉錄調控因子特異性結合的DNA片段,再通過測序技術確定其基因序列。近年來,ChIP-seq逐漸超越了ChIP-chip,越來越多地應用于轉錄調控研究中。Shao等[44]在研究囊性纖維化患者的條件致病菌銅綠假單胞菌(Pseudomonas aeruginosa)內一種全局調控因子RpoN對銅綠假單胞菌一組毒力因子和群體感應基因的作用,利用ChIP-seq鑒定了RpoN的1 068個結合位點,并通過EMSA等技術證實它們之間存在特異性結合作用。2012年,Bard等[45]通過分析轉錄因子EVI1靶向序列的特征,發現在EVI1的ChIP-seq峰附近常常伴隨有低聚果糖結合位點,并通過ChIP-seq和芯片技術證實FOS是EVI1的相互作用分子。本課題組通過ChIP-seq技術證實兩個調控植物乳桿菌中FOS代謝的基因簇的預測啟動子區域存在6個潛在的CcpA結合cre位點,揭示了依賴CcpA的CCR作用調節FOS代謝的調控網絡[27]。
ChIP技術是研究DNA-蛋白質互作的常用技術,具有特異性較強且DNA富集效率高的特點。從研究目的來說,更多情況下研究者希望得到真實反映在相應生理條件下轉錄因子與DNA的結合情況,作為一種體內研究方法ChIP技術則能很好滿足這一需求。但ChIP技術也相對考驗操作經驗,ChIP技術對染色質片段的長度以及實驗中其他影響因素有較高要求,如以甲醛為交聯劑時影響轉錄因子的分布情況,使用交聯劑時需要注意交聯劑濃度和交聯時間、優化超聲破碎參數使染色質的破碎片段長度在一定范圍、需要選擇合適的抗體等,結果分析時也需要格外注意,與目的蛋白結合的其他蛋白質也會與DNA結合影響實驗結果[46]。
4 微量熱泳動技術(MST)
4.1 MST基本原理
MST是一種基于熒光檢測的優勢,與熱泳動相結合,能快速、精確量化微升溶液中生物分子相互作用的方法。這項技術的基礎是一種稱為熱泳的物理效應,它描述了分子通過溫度梯度的定向運動。分子的熱泳特性取決于其大小、電荷和水化層[47]。其作用原理為(圖4)[48]:運行MST實驗時,紅外激光瞬間加熱生成一個微觀溫度梯度場,通過共價結合的熒光染料、熒光融合蛋白或蛋白自身色氨酸熒光來監測并定量分析分子的定向移動[49],以檢測相互作用的生物分子間的親和性。簡而言之,其中一種分子用熒光染料標記并保持恒定的濃度,另一種分子被稀釋至適宜的倍數,建立等濃度梯度稀釋系列,以此產生大量濃度范圍,隨后將這兩種分子混合并加載到用以掃描的毛細管中,樣品經溫度梯度,熒光探測器跟蹤熒光標記分子的運動。分子在初始溫度和新溫度下的熒光差異產生未標記分子的結合曲線[50]。另外,MST還可以進行分子間競爭結合測定、多結合配體的測定、穩定性測定和篩選測定,獲取化學計量和熱力學參數等[51]。
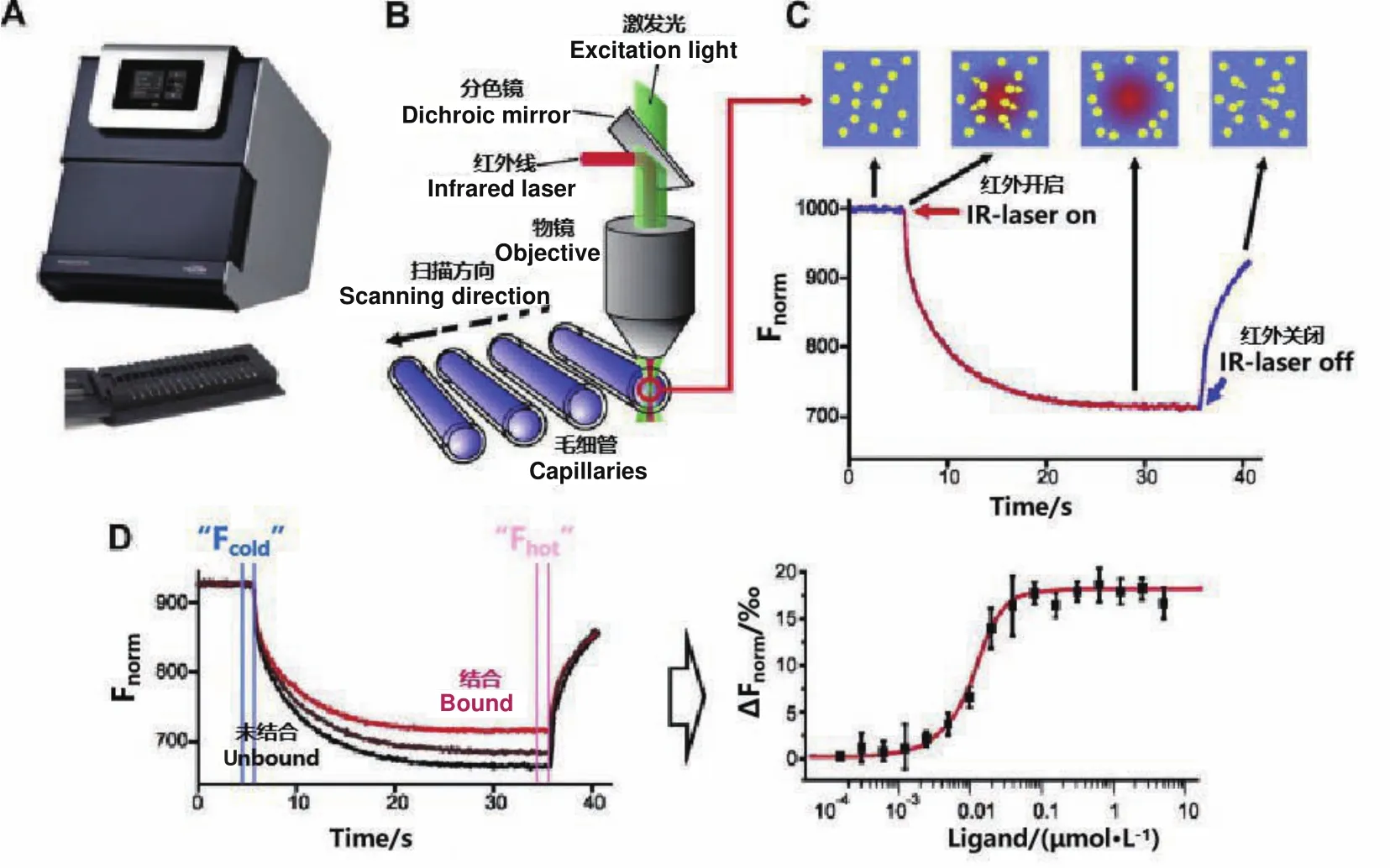
圖4 MST實驗的基本原理Fig.4 Basic principle of MST experiment
4.2 MST定量分析結合相互作用及適用性分析
近年來,MST成功地用于分析各種生物分子相互作用,如寡核苷酸相互作用[52]、蛋白質-DNA相互作用[53]、蛋白質-小分子蛋白質相互作用和蛋白質-脂質相互作用[54-55]。在蛋白質與DNA的相互作用研究中,Papageorgiou 等[56]用MST方法檢測嗜熱棲熱菌(Thermus thermophilus)組蛋白類DNA結合蛋白HUTth 與pUC18質粒DNA的相互作用,測得了HUTth與pUC18結合的解離常數,并在相同實驗條件下測定了另外兩個HU蛋白與pUC18的親和力得出了HU蛋白與DNA分子結合的化學計量比,發現MST方法重復性好。MST技術提供了方便的數據分析系統,根據實驗的需要配置了多種曲線擬合的選項,在數據采集的動態過程中即可分析數據[47]。而且MST技術在幾乎任何的溶液環境都適用,使某些復雜體系如細胞裂解液中相互作用分子的測量更加簡便[57]。
MST技術的優勢是快速、靈敏、所需樣品量少、對研究對象并無特殊的選擇性、無相互作用分子質量和大小以及相互作用后尺寸變化較大等要求[14],同時由于MST的檢測過程是在溶液中進行所以該技術提供了接近自然狀態的檢測方法[58],并且利用檢測儀器分析軟件得出MST結合曲線并進行數據分析可以方便得出配體分子是否結合、結合位點數量及親和力等信息[59]。因此MST技術已廣泛用于生命科學研究的諸多方面。但是,MST也存在一定的局限性,比如儀器價格昂貴、不能直接確定具體的結合位點等。
5 等溫滴定量熱法(ITC)
5.1 ITC基本原理
ITC是一種廣泛用于研究分子間結合相互作用的方法,ITC實驗的主要數據是熱分析圖,圖中記錄了絕熱的對照池和樣品池之間保持恒定的溫差所需的時間進程。其原理為(圖5)[10]將已知濃度的反應物滴定到樣品中,每次樣品的注入都會引起樣品池中溶液成分的變化,并且在其反應達到新的平衡期間,系統將記錄反應熱并形成相應的峰,每個峰的面積表示在樣品與樣品池中組分反應時產生或消耗的總熱量。例如,在模擬整合加熱的等溫線之后,可以得到反應焓變、結合親和力和結合化學計量等信息[60]。
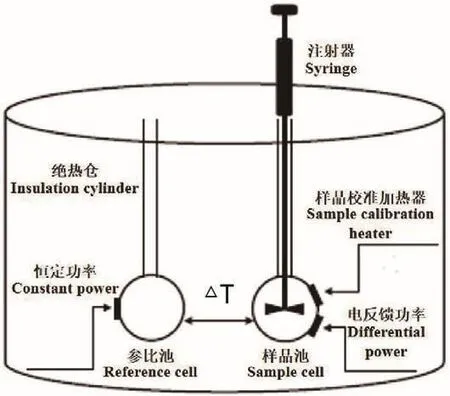
圖5 ITC實驗的基本原理Fig.5 Basic principle of ITC experiment
5.2 ITC研究結合作用模式及適用性分析
在過去的幾十年里,ITC已經被應用到眾多的系統中。這些研究大多集中于分子間的相互作用,如蛋白質之間、蛋白質與小配體之間、DNA與其他大分子系統之間以及酶動力學中[61]。在原核生物的轉錄調控研究中,Zhuo等[62]研究黃色粘球菌DK1622(Myxococcus xanthus DK1622)groELs差異性表達的轉錄調控網絡,通過ITC技術用DNA滴定粘球菌DK1622的HrcA蛋白,分析HrcA蛋白和分子伴侶表達反向重復序列(controlling inverted repeat of chaperone expression,CIRCE)之間的相互作用,發現HrcA蛋白不能與CIRCE2groESL1元件結合,而傾向于與CIRCE1groESL1結合,其次是CIRCEgroEL2。2014年,Wang等[63]通過該方法對一些調控因子與啟動子的結合參數進行了詳細的表征,另外還對調控因子結合效應物小分子的相關參數進行了分析,展示了外源抗生素JdB 對天藍色鏈霉菌ScbR2(Streptomyces coelicolor ScbR2)的結合情況,數據表明它們近似1∶1結合,取得了較好的研究效果。雖然ITC技術可應用于多種系統相互作用的研究,但傳統的ITC技術直接滴定的方法難以用于超高(Ka>108M-1)/超低(Ka<104M-1)親和力系統的測定,利用與目標分子具有較弱親和作用的競爭性配體采取置換滴定的方式,可獲得準確的熱力學信息,提高該方法的適用性[11-12]。ITC技術還可更進一步研究轉錄調控因子的某一結構域與DNA序列的關系,得出結合親和力的具體信息、反應焓變和熵等參數可幫助研究相互作用分子之間的結合模式,為更深入研究轉錄調控因子提供了豐富的信息[64]。
ITC在分子相互作用研究方面有兩大優勢。首先,ITC主要應用于天然蛋白,不需要對其進行修飾;其次,ITC提供了豐富的熱力學信息,包括焓值、熵值和熱容量等。因此,該技術提供的豐富的信息常用來推斷分子間相互作用反應機制,例如結合位點的數目、不同構象反應物滴定的熱力學差異等[65]。然而,傳統的ITC也存在局限性,其分析受到隨機熱譜圖噪聲影響,且單個滴定實驗信息量有限。因此,Brautigam 等[66]提出一個基于自動形狀分析注射峰的無偏差熱成像積分的方案,然后將來自不同量熱滴定實驗的等溫線組合進行全局分析,并將結合參數的統計分析結果以圖形直觀地表示。
6 細菌單雜交系統(bacterial-one-hybrid system)
6.1 細菌單雜交系統基本原理
細菌單雜交系統是一種在體內研究轉錄因子和目的基因相互作用的研究技術,該技術是在酵母單雜交和細菌雙雜交技術的基礎上發展而來。細菌單雜交系統的原理是轉錄因子與RNA聚合酶的α亞基融合表達,識別隨機文庫載體上的DNA片段并與之結合,使RNA聚合酶聚集到報告基因上游弱啟動子區域,激活報告基因his3和ura3表達(圖6)[67]。該系統包括3個組成部分:轉錄因子表達載體、結合隨機位點文庫的報告載體和營養缺陷型宿主菌[68]。轉錄因子與啟動子區域結合激活報告基因his3和ura3,有利于組氨酸和尿嘧啶合成,轉錄因子表達載體和隨機文庫報告載體轉化到營養缺陷型宿主菌中使其在含有一定濃度3-氨基-1,2,4-三唑(3-AT)的缺乏組氨酸和尿嘧啶篩選平板上生長,篩選出與轉錄因子相互作用的DNA片段。
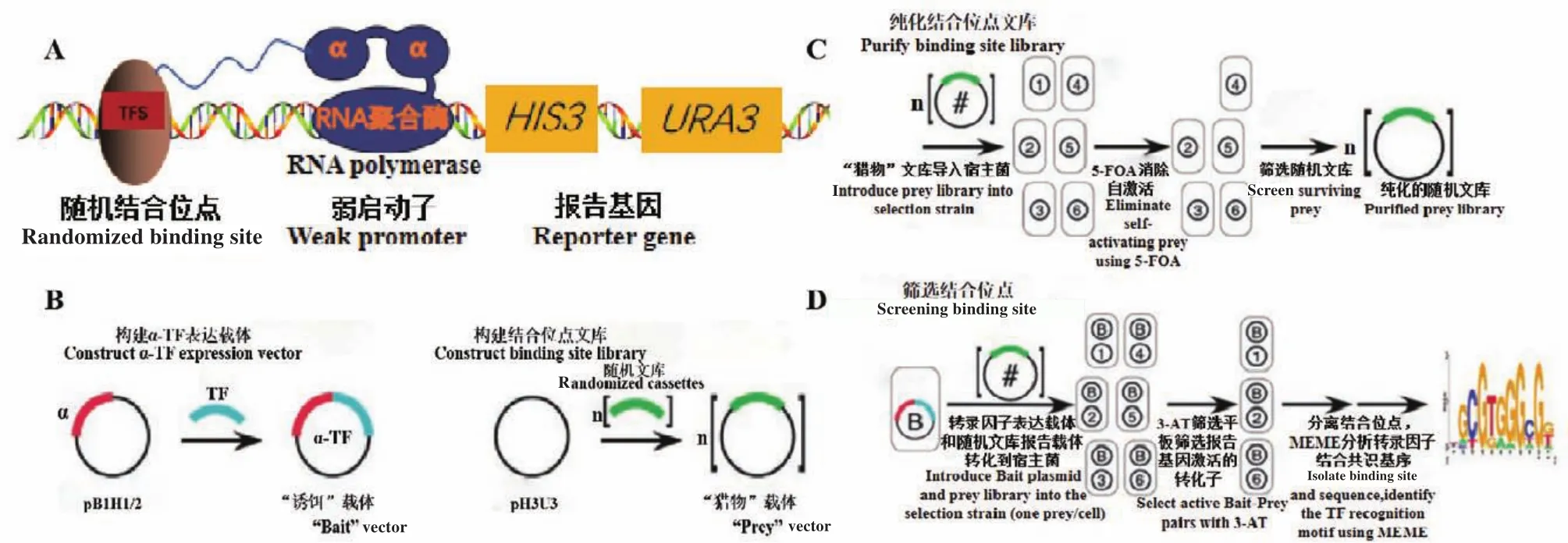
圖6 細菌單雜交系統基本原理Fig.6 Basic principle of bacterial one hybrid system
6.2 細菌單雜交篩選轉錄調控因子及適用性分析
細菌單雜交系統在研究蛋白質-DNA相互作用方面得到了廣泛的應用,如Hebdon等[69]利用細菌單雜交系統篩選了艱難梭狀芽孢桿菌R20291(Clostridioides difficile R20291)反應調節因子RR_1586的可能調控靶點,并利用EMSA驗證了RR_1586與該段基因序列的結合,證實了RR_1586結合位點位于可能的靶基因上游。Zhai等[70]發現保加利亞乳桿菌(Lactobacillus bulgaricus)在酸脅迫條件下預測的轉錄調控因子Ldb0677表達上調1.84倍,用細菌單雜交和EMSA測定了Ldb0677的DNA結合特異性,表明它可能是保加利亞乳桿菌酸脅迫反應的主要調節因子。對于基因轉錄調控研究,建立有關物種的轉錄調控因子數據庫,包括已經證實的轉錄因子、全基因組結合位點、位置權重矩陣(position frequency matrix,PFM)等信息,對快速構建相關的轉錄調控網絡有很大幫助,細菌單雜交系統因其較高的轉化效率被用于建立轉錄因子特異性結合數據庫[71]。
與EMSA相比,細菌單雜交系統不需要對轉錄因子進行蛋白純化;此外,細菌生長速度較快,具有更高的轉化效率,與酵母單雜交系統相比此技術可以搜索更大的隨機文庫。通過此方法有利于發現與相應DNA序列特異性結合的潛在轉錄因子。此方法具有操作簡單,無需復雜儀器且轉化效率高的特點,適用于轉錄因子結合位點鑒定并進行高通量分析,但有可能出現假陽性的結果,所以往往需要與其他技術聯用來驗證結果的準確性。
7 總結與展望
基因表達調控是生物遺傳調控的一個重要方面,轉錄調控是原核生物關鍵調控步驟且是一個非常復雜的過程。本文總結了原核生物DNA-蛋白質相互作用的研究技術,主要從基本原理、實驗方法、注意事項及其進展進行綜述。通過其具體應用了解這些研究技術在研究原核生物基因轉錄調控網絡的重要作用及其發展趨勢。
盡管上述的每項研究技術都是一項獨立的技術,但是目前看來某種研究技術都存在各自的優缺點和適用性,可以根據情況選擇合適的技術而且往往需要相互補充才能確認DNA-蛋白質相互作用的特異性和親和性,因此在研究中通常兩項或兩項以上技術結合使用。此外,對于轉錄調控網絡的研究技術還有待于進一步地發展,通過各種技術手段建立轉錄因子與啟動子之間的動態調控網絡更為重要,以期能夠重新解釋原核生物的各種生理現象,為構建更加復雜、更準確地反映原核生物生命現象的動態網絡提供更多的經驗。隨著后基因時代的發展,原核生物基因轉錄調控研究技術的應用會越來越廣泛。對這些研究技術的改進或在原有技術基礎上開發出新技術使其適用于更多的情況,為原核生物的基因改造提供新的靶點和思路,從而更好地發揮原核生物作為生產宿主的優勢,助力創造綠色低碳、可持續發展的資源節約型生產方式,為人類造福。

