溶液酸堿性的判斷與pH 的計算
亓華興
(山東省濟南市萊蕪第二中學)
溶液酸堿性的判斷是高考的考點之一,也是學生學好電解質溶液的關鍵之一,涉及水的電離平衡與鹽類的水解等.
1 溶液酸堿性的判斷

圖1
例1 關于溶液的酸堿性,下列說法正確的是( ).
A.pH=7的溶液呈中性
B.中性溶液中一定有c(H+)=1.0×10-7mol·L-1
C.c(H+)=c(OH-)的溶液呈中性
D.在100 ℃時,純水的pH<7,因此顯酸性

在100 ℃時,純水的pH=6,呈中性,該溫度下pH=7的溶液呈堿性,所以溫度未知時,不能根據pH 大小判斷溶液酸堿性,選項A、D 錯誤.常溫下中性溶液中c(H+)=1.0×10-7mol·L-1,溫度未知,中性溶液中不一定有c(H+)=1.0×10-7mol·L-1,選項B錯誤.c(H+)=c(OH-)的溶液呈中性,與溶液溫度高低無關,選項C正確.答案為C.
2 溶液pH 的計算方法
2.1 單一溶液pH 的計算(25 ℃)

表1
2.2 不同濃度的強酸(或強堿)混合后pH 的計算(25 ℃)
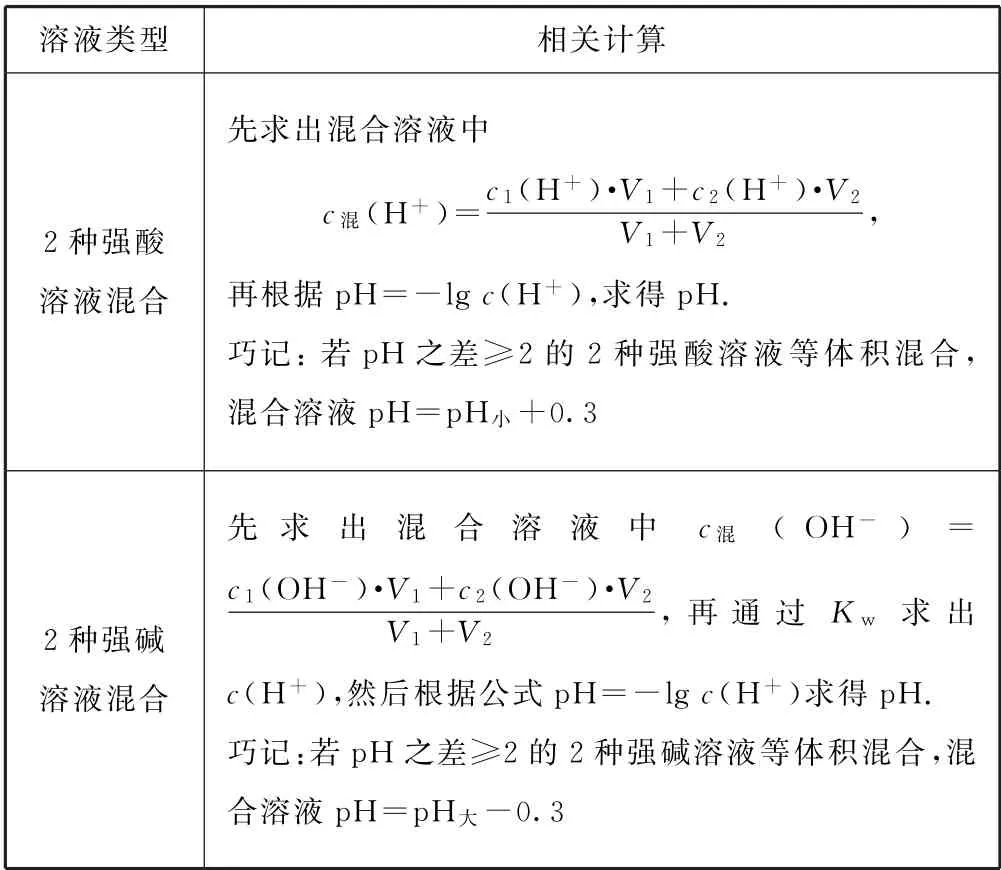
表2
2.3 強酸強堿中和反應后溶液pH 的計算(25 ℃)
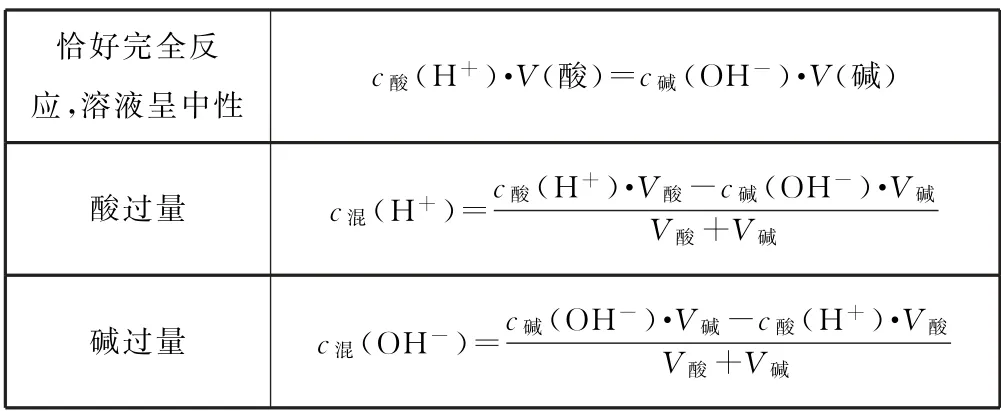
表3
2.4 酸、堿稀釋后溶液pH 的計算

表4

例3 25 ℃時,若pH=a的10體積某強酸溶液與pH=b的1體積某強堿溶液混合后溶液呈中性,則混合之前該強酸的pH 與強堿的pH 之間應滿足的關系為( ).
A.a+b=14 B.a+b=13
C.a+b=15 D.a+b=7

2)等體積強酸(pH1)和強堿(pH2)混合:
若pH1+pH2=14,則溶液呈中性,pH=7;若pH1+pH2>14,則溶液呈堿性,pH>7;若pH1+pH2<14,則溶液呈酸性,pH<7.
3)酸與堿的pH 之和為14,等體積混合:
若為強酸與強堿,則pH=7;若為強酸與弱堿,則pH>7;若為弱酸與強堿,則pH<7.
規律:誰弱誰過量,誰弱顯誰性[酸和堿已電離出的H+與OH-恰好中和,誰弱誰的H+或OH-有儲備(即物質過量),還能繼續電離].
例4 常溫下,pH=11的X、Y 2 種 堿 溶 液 各1mL,分別稀釋到100mL,其pH 與溶液體積(V)的關系如圖2所示,下列說法正確的是( ).

圖2
A.X、Y2種堿溶液中溶質的物質的量濃度一定相等
B.稀釋后,X 溶液的堿性比Y 溶液的堿性強
C.分別完全中和X、Y 這2種堿溶液時,消耗同濃度鹽酸的體積V(X)>V(Y)
D.若9<a<11,則X、Y 都是弱堿

由圖可知,pH=11的X、Y2種堿溶液稀釋到原溶液體積的100倍時,pH:Y>X,所以物質的量濃度:c(Y)>c(X),稀釋后溶液堿性:Y>X,故選項A、B均錯誤.因為c(Y)>c(X),且V(Y)=V(X),故n(Y)>n(X),所以中和同濃度的鹽酸時,Y消耗得多,選項C錯誤.若9<a<11,說明稀釋到原溶液體積的100 倍時,X、Y 的pH 均減小不到2 個單位,故X、Y 都是弱堿,選項D 正確.答案為D.
【方法點撥】酸堿溶液稀釋過程pH 的變化趨勢圖(如圖3).

圖3

