腐乳源乳酸乳球菌17M1高密度培養條件研究
南樹港,李 理
(華南理工大學 食品科學與工程學院,廣東 廣州 510641)
乳酸乳球菌(Lactococcus lactis)屬兼性厭氧的革蘭氏陽性細菌,是乳酸菌中一種重要的模式菌,具有潛在的應用價值[1]。乳酸乳球菌憑借其快速酸化、水解蛋白以及產生揮發性風味物質的能力廣泛應用于食品發酵領域,其中最具代表性的菌種為乳酸乳球菌乳酸亞種(Lactococcus lactissubsp.lactis)和乳酸乳球菌乳脂亞種(Lactococcus lactissubsp.cremoris)[2]。LANGA S等[3]研究發現,乳酸乳球菌的添加對奶酪的物理化學性質和感官特性產生了積極的影響,并從中分離出乳酸鏈球菌肽(nisin)等抑菌物質。除此之外,由于其易于生長、載體系統可用且發展良好等優點,探究乳酸乳球菌作為細胞工廠表達活性物質的潛力也是目前的一大熱點[4-5]。乳酸乳球菌具有廣泛的自然棲息環境,從天然植物、發酵食品以及人體生殖器官中均發現了該菌種的存在[6-8]。腐乳作為中國傳統發酵食品,其加工不經過滅菌步驟,環境中的微生物對腐乳的風味及品質產生了重要影響[9-10]。乳酸乳球菌作為腐乳發酵過程中的優勢菌群,在產品風味的改善、致病菌抑制等方面均可能產生重要影響[11-12]。
為滿足工業生產的需求,必須保證發酵菌株的活菌數和發酵活力,其中,營養成分以及培養條件對微生物的生長繁殖有至關重要的作用。董安利[13]研究發現,乳酸乳球菌乳酸亞種BL19的最優培養基組成為海藻糖5.10 g/L、蔗糖15.31 g/L、酵母蛋白胨14.79 g/L、酵母浸粉44.38 g/L、磷酸二氫鉀19.63 g/L、氫氧化鈉4.04 g/L、MgSO4·7H2O 0.20 g/L、維生素B2(vitamin B2,VB2)0.50 g/L,調整pH為7.7,采用該培養基于30 ℃條件下培養5~6 h,活菌數可達(8.03±0.59)×109CFU/mL。除此之外,培養基的優化不僅要保證獲得大量的菌體,同時還要考慮其成本問題[14]。陳雪[15]以營養豐富且價格低廉的乳清粉作為基礎培養基,通過添加酵母粉、酶水解酪蛋白胨以及多種促生長因子等顯著提高了乳酸乳球菌KLDS4.0326和KLDS4.0424的活菌數;周劍忠[16]同樣以乳清粉為基礎培養基對微囊化的乳酸乳球菌進行高密度培養,通過添加濃縮乳清蛋白20.00 g/L,酵母提取物7.63 g/L,碳酸鈣6.20 g/L,硫酸鎂0.20 g/L和硫酸錳0.03 g/L,并調整初始pH值為6.50,30.4 ℃培養22 h,其活菌數對數值高達11.15。
乳酸乳球菌17M1是課題組前期從腐乳毛坯中分離鑒定的菌株,具有安全、耐鹽以及發酵豆基食品的能力,應用前景廣闊。豆腐乳清是豆腐制備過程中產生的黃色瀝水,富含大豆低聚糖、蛋白質、異黃酮等營養物質[17-18],是微生物的良好培養基。因此,本研究以豆腐乳清作為基礎培養基,以菌體密度和活菌數為評價指標,通過響應面法(response surface methodology,RSM)優化乳酸乳球菌17M1的培養基配方,并研究其培養條件,以期為乳酸乳球菌17M1直投式發酵劑的制備提供依據,為其工業化應用奠定基礎。
1 材料與方法
1.1 材料與試劑
乳酸乳球菌17M1:分離純化自廣東某腐乳廠的腐乳毛坯,保藏于廣東省微生物菌種保藏中心,保藏號為GDMCC No.61396。
豆腐乳清(pH值為5.45,酸度值為18.43°T,可溶性固形物含量為4.73%,總氮含量為0.468 g/L,總蛋白含量為2.925 g/L):取自廣東某腐乳廠,經離心(8 000×g,10 min)去除雜質后作為基礎培養基。
生長因子的制備[19]:將100 g新鮮黃瓜、番茄洗凈、切碎,加入100 mL蒸餾水煮沸5 min,榨汁、過濾并定容至200 mL。
M17肉湯培養基:青島高科技工業園海博生物技術有限公司;瓊脂、大豆蛋白胨、胰酪蛋白胨(均為生化試劑):廣東環凱微生物科技有限公司;檸檬酸銨(分析純):生工生物工程(上海)股份有限公司;抗壞血酸鈉(分析純):上海麥克林生化科技有限公司;D-海藻糖:上海阿拉丁生化科技股份有限公司。其他試劑均為國產分析純。
1.2 儀器與設備
ME 204/02型電子天平:梅特勒托利多儀器有限公司;LS-28HD型立式壓力蒸汽滅菌器:江陰濱江醫療設備有限公司;SE-CJ-1FD型超凈工作臺:蘇州安泰空氣技術有限公司;DHP-9052型電熱恒溫培養箱:上海申賢恒溫設備廠;JW-3021HR型高速冷凍離心機:安徽嘉文儀器裝備有限公司;Marker SynergyH1型多功能酶標儀:美國伯騰儀器有限公司;2WAJ型阿貝折光儀:上海天美科學儀器有限公司;KDN-102C型凱式定氮儀:上海纖檢儀器有限公司。
1.3 方法
1.3.1 乳酸乳球菌17M1的活化與培養
吸取適量-80 ℃冰箱中保藏的乳酸乳球菌17M1菌液至M17肉湯培養基中,30 ℃條件下恒溫靜置培養24~48 h,使菌株復壯。以3%(V/V)的接種量接入5 mL M17肉湯培養基中,在30 ℃條件下恒溫靜置培養24 h。
1.3.2 乳酸乳球菌17M1增殖培養基配方優化響應面試驗
(1)部分因子試驗設計及關鍵因子的篩選
為滿足乳酸乳球菌17M1的增殖需求,篩選出適合菌株生長的因子,以菌體密度(OD600nm值)作為響應值,選用D-海藻糖(A)、大豆蛋白胨(B)、胰酪蛋白胨(C)、檸檬酸銨(D)、抗壞血酸鈉(E)、番茄汁(F)和黃瓜汁(G)添加量7個因素進行7因素2水平1/4部分因子試驗[20],共進行64次試驗(重復2次)和3次中心點試驗,快速獲得一階擬合方程,獲得顯著影響因子。
(2)最陡爬坡試驗設計
根據部分因子試驗結果按照顯著影響因素影響效應的大小及其與響應值之間的相關系數設計顯著因子的最陡上升路徑,從而快速逼近最優響應區域。以OD600nm值作為響應值,得到最大響應值所對應的顯著因子成分比例。
(3)中心組合旋轉設計試驗
在得到最大響應值對應的最優區域后,進行中心組合旋轉設計試驗,以活菌數作為響應值,得到響應值和各因子變量關系的二階擬合方程,從而獲得最佳組合設計。
(4)驗證試驗
為驗證模型的有效性及重現性,選用中心組合旋轉設計試驗中分析得到的最優點、最高點、最低點、中心點以及M17肉湯培養基和基礎培養基對乳酸乳球菌17M1進行培養,對菌株的生長情況進行對比。
1.3.3 乳酸乳球菌17M1增殖培養條件研究
以最優增殖培養基為基礎,考察培養溫度(25 ℃、30 ℃、37 ℃、42 ℃)、初始pH值(5.15、5.65、6.15、6.65)及培養時間(0~30 h)對乳酸乳球菌17M1增殖的影響。
1.3.4 數據處理
采用Design Expert 8.0.6設計部分因子試驗以及旋轉中心組合試驗,試驗數據采用SPSS 19.0進行顯著性分析(P<0.01)。所有試驗進行兩次重復。
2 結果與分析
2.1 乳酸乳球菌17M1增殖培養基配方優化響應面試驗結果
2.1.1 部分因子試驗設計及關鍵因子的篩選
七因素兩水平全因子設計需要進行128次試驗,包含單因子、雙因子以及多因子之間的相互影響[21-22]。假定忽略某些高階因子的相互作用,部分因子試驗可以減少試驗運行次數,從而快速篩選出關鍵因子[20]。本試驗采用七因素兩水平1/4部分因子試驗,包括32個試驗點和3個中心點,在試驗設定的條件下測定菌株的菌體密度。
豆腐乳清中氮源(0.468 g/L)含量比商業M17肉湯培養基(10.000 g/L)中的低,另外,在前期的試驗結果發現,乳酸乳球菌17M1對豆腐乳清中棉子糖和水蘇糖的利用率比較弱,對D-海藻糖的利用率最高。番茄汁和黃瓜汁富含多種維生素、微量元素等生長因子,為菌株的生長提供礦物質、B族維生素等多種營養成分[23-24]。考慮菌株增殖所需要的碳源、氮源、緩沖鹽、生長因子等,對D-海藻糖(A)、大豆蛋白胨(B)、胰酪蛋白胨(C)、檸檬酸銨(D)、抗壞血酸鈉(E)、番茄汁(F)和黃瓜汁(G)添加量7個因子進行了考察。部分因子試驗設計及結果見表1,回歸分析見表2。
由表1可知,不同因素水平乳酸乳球菌17M1的菌體密度為0.59~0.98。由表2可知,模型顯著(P<0.000 1),失擬項不顯著(P>0.05),決定系數R2=0.892 2,調整決定系數R2Adj=0.863 2,表明模型與實際情況擬合良好。該模型回歸系數顯著性檢驗表明,七個因子中,大豆蛋白胨、胰酪蛋白胨以及檸檬酸銨顯著影響乳酸乳球菌17M1在基礎培養基(豆腐乳清)中的增殖(P<0.01)。
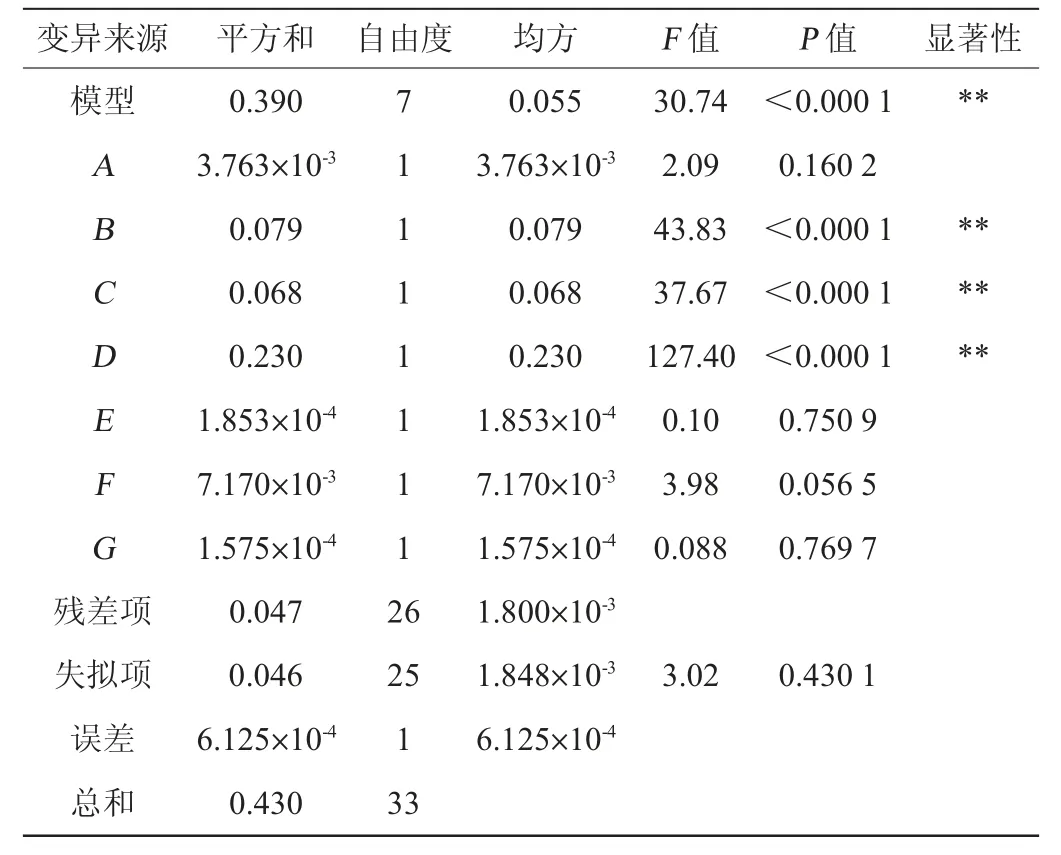
表2 部分因子PB設計試驗結果方差分析Table 2 Variance analysis of PB experimental results of partial factor design
蛋白胨富含自由氨基酸、多肽、蛋白質以及糖類、維生素等,能更好的促進乳酸乳球菌的生長[25-26]。另外,研究發現復合氮源比單一氮源能更加有效地促進菌株生長[27]。培養基中添加合適的緩沖鹽可以中和培養液中的酸性物質,減緩菌液pH的下降速率,并且可以調節細胞滲透壓,保護細胞[28]。吳軍林等[29]研究發現,檸檬酸鹽的添加可以提高乳酸菌的菌體密度。
鑒于D-海藻糖、抗壞血酸鈉、番茄汁和黃瓜汁的偏差平方和較小,故忽略不計。得到回歸方程:Y=0.76+0.050B+0.046C+0.085D。從回歸方程可以看出,大豆蛋白胨、胰酪蛋白胨和檸檬酸銨的回歸系數均為正數,說明這3個因素對菌體密度存在正向的影響,且影響程度順序為:檸檬酸銨>大豆蛋白胨>胰酪蛋白胨。因此,確定大豆蛋白胨、胰酪蛋白胨和檸檬酸銨為影響乳酸乳球菌17M1生長的關鍵因子。
2.1.2 最陡爬坡試驗設計
根據表2分析得到的顯著影響因素,進一步利用最陡爬坡試驗使顯著影響因素逼近最佳響應區域。因此,將檸檬酸銨作為最陡爬坡試驗的基準步調(具有最大回歸系數),以0.5%的增長作為爬坡試驗的步長,大豆蛋白胨和胰酪蛋白胨分別以0.6(0.050/0.085≈0.6)和0.5(0.046/0.085≈0.5)的增長作為試驗的步長,最陡爬坡試驗設計及結果見表3。由表3可知,不同比例的大豆蛋白胨、胰酪蛋白胨以及檸檬酸銨的添加對乳酸乳球菌17M1的菌體密度影響不同。當大豆蛋白胨為1.75%、胰酪蛋白胨為1.50%和檸檬酸銨為2.75%時,菌體密度最大,OD600nm值達到1.04±0.01,故將該條件作為旋轉中心組合試驗設計的中心點。
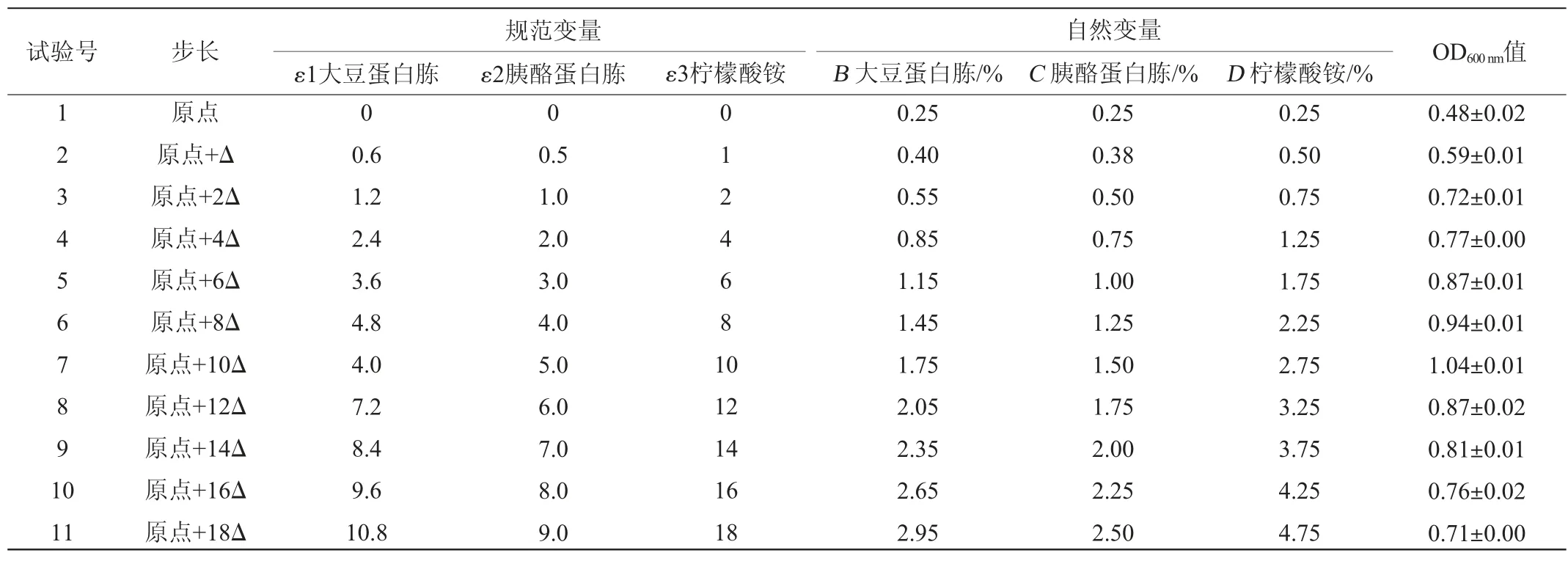
表3 最陡爬坡試驗設計及結果Table 3 Design and results of steepest climbing tests
2.1.3 中心組合旋轉設計試驗及響應面分析
以大豆蛋白胨1.75%、胰酪蛋白胨1.50%以及檸檬酸銨2.75%作為中心組合旋轉設計試驗的中心點,取α=±1.682進行中心組合旋轉設計,試驗因素與水平見表4,試驗設計及結果見表5,方差分析見表6。

表4 中心組合旋轉設計試驗因素與水平Table 4 Factors and levels of center combination rotation design tests

表5 中心組合旋轉設計試驗設計及結果Table 5 Design and results of center combination rotation design tests
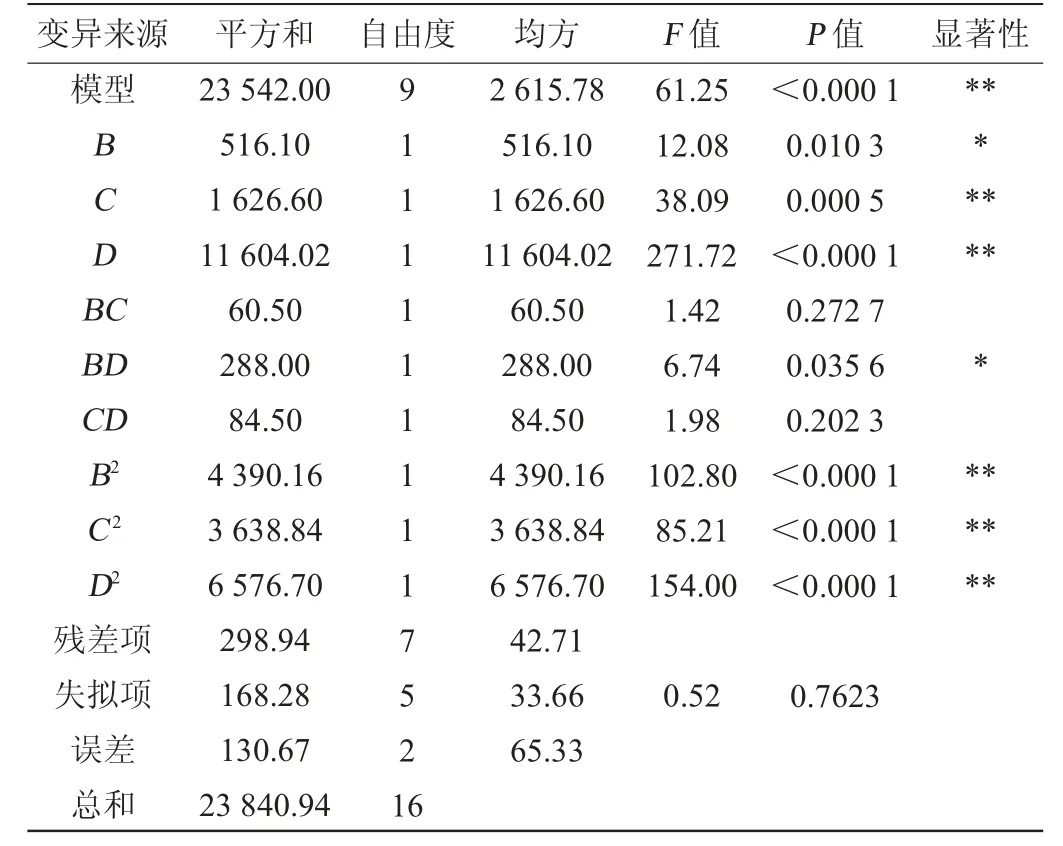
表6 中心組合旋轉設計試驗結果的方差分析Table 6 Variance analysis of center combination rotation design tests results
采用Design Expert 8.0.6對表6數據結果進行多元二次回歸擬合,得到多元二次回歸方程為:Y=213.63+6.15B+10.91C-29.15D+2.75BC-6.00BD-3.2CD-19.73B2-17.97C2-24.15D2。由表6可知,模型極顯著(P<0.01),失擬項不顯著(P>0.05),決定系數R2=0.930 1,調整決定系數R2Adj=0.971 3,表明模型與實際情況擬合良好。一次項C和D及二次項B2、C2、D2對結果影響極顯著(P<0.01),一次項B及交互項BD對結果影響顯著(P<0.05),其他項對結果影響不顯著(P>0.05)。
根據模型分析結果,得到乳酸乳球菌17M1生長的最佳培養基配方為大豆蛋白胨2.01%、胰酪蛋白胨1.69%、檸檬酸銨2.30%。為便于實際操作,將最優培養基配方修正為大豆蛋白胨2.00%、胰酪蛋白胨1.70%、檸檬酸銨2.30%。此優化培養基條件下菌落數預測值可達2.26×109CFU/mL。響應面圖反映了各因素及其之間的相互作用,等高線的形狀可以表示交互作用的強弱,各因素間交互作用對乳酸乳球菌17M1活菌數影響的響應面及等高線見圖1。由圖1可知,響應曲面呈凸形,存在最高點,且大豆蛋白胨與檸檬酸銨間交互作用對乳酸乳球菌17M1活菌數影響的等高線呈橢圓形,交互作用顯著,與方差分析結果一致。

圖1 大豆蛋白胨、胰酪蛋白胨和檸檬酸銨添加量間交互作用對乳酸乳球菌17M1活菌數影響的響應面及等高線Fig.1 Response surface plots and contour lines of effect of interaction between soybean peptone,casein tryptone and ammonium citrate addition on the viable count of Lactococcus lactis 17M1
2.1.4 驗證試驗
為驗證響應面試驗設計的可靠性及結果的重現性,以M17肉湯培養基為對照,在30 ℃條件下培養24 h,測定乳酸乳球菌17M1的活菌數,結果見表7。由表7可知,乳酸乳球菌17M1在最優培養基上的生長情況最好,活菌數實際值為2.46×109CFU/mL,與M17肉湯培養基相比提高了1.37倍。因此,采用RSM法優化增殖培養基各參數準確可靠,且增殖培養基在降低成本的情況下有效提高了乳酸乳球菌17M1的菌體生長量。
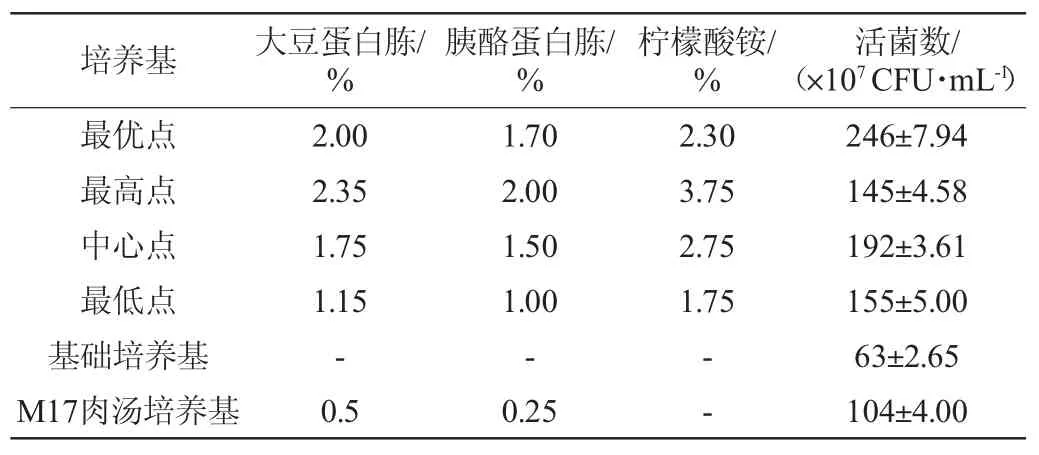
表7 驗證試驗結果Table 7 Results of validation tests
2.2 乳酸乳球菌17M1增殖培養條件研究
2.2.1 培養溫度和初始pH值對乳酸乳球菌17M1生長的影響
在最優增殖培養基下,培養溫度及初始pH值對乳酸乳球菌17M1生長的影響見表8。由表8可知,不同的培養條件對乳酸乳球菌17M1的OD600nm值有顯著影響(P<0.01)。隨著初始pH值及培養溫度的升高,OD600nm值均呈先升高后下降的趨勢,當初始pH值和培養溫度分別為6.15和37 ℃時,OD600nm值均最高,分別為1.94±0.008、2.00±0.011。綜上,乳酸乳球菌17M1的最佳培養條件為初始pH6.15,培養溫度37℃。
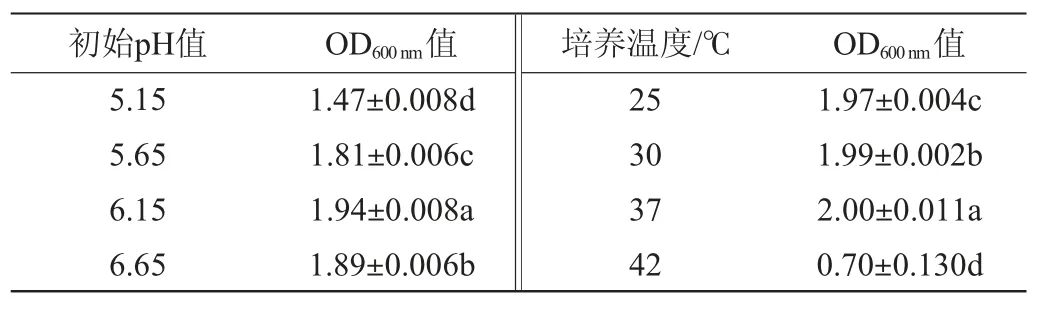
表8 初始pH值及培養溫度對乳酸乳球菌17M1菌體密度的影響Table 8 Effect of initial pH and culture temperature on the cell density of Lactococcus lactis 17M1
2.2.2 培養時間對乳酸乳球菌17M1生長的影響
在最優培養基以及最適培養條件下測定乳酸乳球菌17M1的生長曲線,結果見圖2。
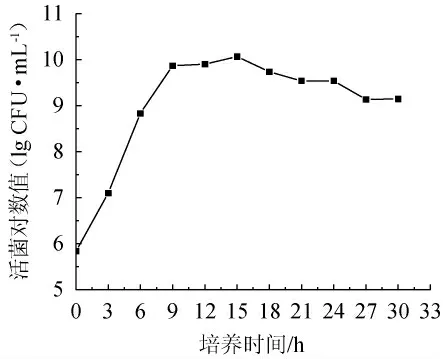
圖2 培養時間對乳酸乳球菌17M1活菌數的影響Fig.2 Effect of culture time on the viable count of Lactococcus lactis 17M1
由圖2可知,隨著培養時間的延長,菌株17M1的菌落數呈先升高后下降的趨勢,當培養15 h時,活菌數達到最大值,為1.17×1010CFU/mL,因此,選擇15 h作為乳酸乳球菌17M1菌體增殖培養基的最適培養時間。
3 結論
本研究以豆腐乳清為基礎培養基,通過響應面試驗得到乳酸乳球菌17M1高密度培養的最佳發酵培養基配方為:大豆蛋白胨2.00%,胰酪蛋白胨1.70%,檸檬酸銨2.30%。采用該培養基,在初始pH值6.15,37 ℃培養15 h后,菌株17M1的活菌數達到最大,為1.17×1010CFU/mL,高于M17肉湯培養基活菌數(1.04×109CFU/mL)。

