補氣養陰祛瘀泄濁湯聯合厄貝沙坦片治療氣陰兩虛兼痰阻血瘀型糖尿病腎病的臨床研究※
鄭映丹 饒克瑯
(廣州中醫藥大學附屬寶安中醫院腎病科,廣東 深圳 518101)
糖尿病腎病(diabetic kidney disease,DKD)是糖尿病慢性發展過程中的重要并發癥,在病程10年以上的2型糖尿病(T2DM)患者中,約20%的患者可發展為DKD[1]。近年來,我國糖尿病患病率從1980年大致估計的1%[2],攀升至2010年統計的11.6%[3],隨之而來DKD患者的數量也快速增加。DKD早期以白蛋白尿、腎功能受損為主要表現,隨著病情進展,腎功能進行性惡化,最終發展為終末期腎病(ESRD),已成為我國慢性腎臟病(CKD)的主要原因[4]。DKD發病機制復雜,可能是糖脂代謝紊亂、炎性反應、血流動力學異常、細胞因子、蛋白激酶、遺傳等多因素聯合介導了DKD的發生發展[5-6]。目前西醫臨床對未進入ESRD階段患者的主要治療方式為積極控制DKD發展的危險因素,通過降血糖、降血壓、調血脂等基礎治療以期延緩病情進展,但療效往往并不理想。而中醫在治療DKD方面積累了豐富的經驗,認為其基本病機為陰虛燥熱,長期氣陰虧耗而出現濕濁內蘊,瘀血阻滯之證。2019年5月至2021年5月,我們采用補氣養陰祛瘀泄濁湯聯合厄貝沙坦片治療氣陰兩虛兼痰阻血瘀型DKD患者34例,并與單純采用厄貝沙坦片治療33例對照觀察,結果如下。
1 資料與方法
1.1 一般資料 全部67例均為廣州中醫藥大學附屬寶安中醫院腎病科收治的氣陰兩虛兼痰阻血瘀型DKD住院患者,按照隨機數字表法分為2組。治療組34例,男22例,女12例;年齡42~70歲,平均(57.14±9.02)歲;糖尿病病程6~17年,平均(10.88±4.72)年;DKD病程6個月~6年,平均(3.50±1.69)年;DKD病情Mogensen分期均為Ⅳ期[4]。對照組33例,男19例,女14例;年齡35~69歲,平均(58.18±7.43)歲;糖尿病病程6~19年,平均(11.27±5.94)年;DKD病程6個月~7年,平均(3.30±1.64)年;DKD病情Mogensen分期均為Ⅳ期。2組一般資料比較差異無統計學意義(P>0.05),具有可比性。
1.2 病例選擇
1.2.1 診斷標準 西醫診斷參照《糖尿病腎病防治專家共識(2014年版)》中DKD的診斷標準[4],其中Ⅳ期DKD即是指進入大量蛋白尿階段,持續尿蛋白>0.5 g/24 h,腎小球濾過率(GFR)正常或下降。中醫診斷參照《糖尿病腎病診斷、辨證分型及療效評定標準(試行方案)》中氣陰兩虛兼痰阻血瘀型DKD的診斷標準[7]。主癥:倦怠乏力,頭暈耳鳴,心悸氣短,自汗盜汗,心胸窒悶,肢沉體胖;次癥:面色白,煩躁失眠,遺精早泄,口渴嗜飲,嗜睡,痰多口黏,肢體酸痛;舌脈:舌質淡紅,苔少或濁膩,脈弦滑細。具備主癥2項,或主癥1項、次癥2項,結合舌脈即可確診。
1.2.2 納入標準 符合上述中、西醫診斷標準;年齡18~70歲;患者知情同意并自愿參加本研究,簽署知情同意書,經過廣州中醫藥大學附屬寶安中醫院醫學倫理委員會批準。
1.2.3 排除標準 24 h尿蛋白定量(24 hUTP)>10 000 mg,血漿白蛋白<25 g/L者;合并急性心腦血管意外、糖尿病酮癥酸中毒、惡性腫瘤等危重急病者;近期血壓控制欠佳者[≥160/100 mmHg(1 mmHg≈0.133 kPa)];對本研究治療藥物過敏者;治療依從性差,不能按要求完成治療者;妊娠期或哺乳期婦女。
1.3 治療方法
1.3.1 對照組 予厄貝沙坦片[賽諾菲(杭州)制藥有限公司,國藥準字H20040494]150 mg,每日1次口服。同時給予控制血糖、血脂等基礎治療,開展糖尿病飲食健康宣教,適量運動。
1.3.2 治療組 在對照組的基礎上加用補氣養陰祛瘀泄濁湯治療。藥物組成:黃芪15 g,太子參15 g,生地黃15 g,山茱萸15 g,山藥15 g,茯苓15 g,白術15 g,丹參15 g,川芎15 g,生大黃5 g,積雪草15 g,玉米須15 g。倦怠氣短明顯者,太子參、黃芪增至30 g;頭暈明顯者,加姜半夏10 g、膽南星5 g;自汗盜汗明顯者,加煅牡蠣15 g、煅龍骨15 g;腰痛甚者,加杜仲15 g、牛膝15 g。日1劑,水煎取汁400 mL,分早、晚2次溫服。
1.3.3 療程 2組均治療12周后統計療效。
1.4 觀察指標及方法 ①比較2組治療前后中醫癥狀積分變化情況,參考《中藥新藥臨床研究指導原則(試行)》[8]中相關內容擬定評分標準,包括倦怠乏力、頭暈耳鳴、心悸氣短、自汗盜汗、心胸窒悶及肢沉體胖6項主癥,均按無、輕、中、重的程度分別評為0、2、4、6分,積分越高表示癥狀越重。②比較2組治療前后血糖、血脂指標變化情況,包括空腹血糖(FPG)、糖化血紅蛋白(HbA1c)、總膽固醇(TC)及甘油三酯(TG)。③比較2組治療前后腎功能指標變化情況,包括血肌酐(SCr)、尿素氮(BUN)、胱抑素C(Csy-c)及24 hUTP。④比較2組治療前后超敏C反應蛋白(hs-CRP)、白細胞介素6(IL-6)及D-二聚體(D-D)水平變化情況。⑤觀察記錄2組治療期間不良反應發生情況。
1.5 療效標準 顯效:患者癥狀、體征明顯改善,中醫癥狀積分減少≥70%;有效:患者癥狀、體征均有好轉,中醫癥狀積分減少≥30%,<70%;無效:患者癥狀、體征均無好轉甚或加重,中醫癥狀積分減少<30%[8]。總有效率=(顯效例數+有效例數)/總例數×100%。
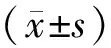
2 結果
2.1 2組臨床療效比較 治療組總有效率85.3%(29/34),對照組總有效率57.6%(19/33),治療組療效優于對照組(P<0.05)。見表1。

表1 2組臨床療效比較 例
2.2 2組治療前后中醫癥狀積分變化比較 與本組治療前比較,2組治療后中醫癥狀倦怠乏力、頭暈耳鳴、心悸氣短、自汗盜汗、心胸窒悶及肢沉體胖積分均下降(P<0.05),且治療組治療后中醫癥狀倦怠乏力、頭暈耳鳴、心悸氣短、自汗盜汗、心胸窒悶及肢沉體胖積分均低于對照組(P<0.05)。見表2。

表2 2組治療前后中醫癥狀積分變化比較 分,
2.3 2組治療前后腎功能指標水平變化比較 與本組治療前比較,2組治療后SCr、BUN、Csy-c及24 hUTP水平均降低(P<0.05),且治療組治療后SCr、BUN及24 hUTP水平均低于對照組(P<0.05)。見表3。

表3 2組治療前后腎功能指標水平變化比較
2.4 2組治療前后hs-CRP、IL-6及D-D水平變化比較 與本組治療前比較,2組治療后hs-CRP、IL-6及D-D水平均降低(P<0.05),且治療組治療后hs-CRP、IL-6及D-D水平均低于對照組(P<0.05)。見表4。

表4 2組治療前后hs-CRP、IL-6及D-D水平變化比較
2.5 2組治療前后FPG、HbA1c、TC及TG水平變化比較 與本組治療前比較,2組治療后FPG、HbA1c、TC及TG水平均降低(P<0. 05),且治療組治療后TC及TG水平低于對照組(P<0.05)。見表5。

表5 2組治療前后FPG、HbA1c、TC及TG水平變化比較
3 討論
DKD是糖尿病代謝異常導致微小血管發生病變,而出現的腎小球基底膜增厚、腎小球肥大硬化、腎小管間質炎癥纖維化等病變。目前,臨床上對于DKD出現持續蛋白尿,伴或不伴高血壓的患者推薦首選腎素-血管緊張素系統(RAS)阻滯劑治療,有明確的證據表明,使用RAS阻滯劑可延緩大量蛋白尿DKD患者病情的進展[4]。故我們使用厄貝沙坦片作為基礎治療藥物。厄貝沙坦片是血管緊張素Ⅱ(AngⅡ)受體抑制劑,通過選擇性地阻斷AngⅡ與受體的結合,抑制血管收縮,同時減少尿蛋白排泄,改善腎間質纖維化,從而有效發揮腎保護作用[9]。但單獨選擇RAS阻滯劑治療,療效存在較大的個體差異,并且有嚴重副作用的風險,如急性腎損傷和高鉀血癥,因此廣大學者仍在不斷探索更安全有效的治療手段[10]。
中醫學根據DKD的臨床癥狀,將其歸屬為“消癉”“尿濁”“虛勞”“水腫”等范疇。認為本病緣于消渴遷延日久,累及腎臟,形成本虛標實的病機特征,以脾、腎氣陰兩虛為本,濕濁內生、瘀血內阻為標。脾虛則水谷不化,升清功能障礙,導致濕濁之邪羈留,脾虛氣血不生,腎精充養不足;腎虛封藏失職,水精失固,精微物質外泄,腎臟氣陰耗傷更甚。陰虛者血不足,絡脈空虛,血行不暢,導致瘀血內停。血瘀阻滯氣機,津液輸布困難,進一步加重濕濁,濕濁、血瘀交阻腎絡,脾腎虧損不愈而發病。補氣養陰祛瘀泄濁湯是在參芪地黃湯的基礎上化裁而來,取其健補脾腎、補益氣陰之功,同時又加強化濕泄濁、活血通絡的作用。方中黃芪補氣升陽,益氣固表,使脾運升清,腎氣補益,固澀在職;太子參益氣生津,與黃芪合用,增強補氣之功;生地黃滋補腎水真陰,助黃芪、太子參氣陰雙補;山茱萸滋補肝腎,固腎精,澀精微;山藥健運脾胃,補腎澀精;茯苓、白術健脾益氣,利水除濕,兩者佐山藥有助于脾胃生化氣血,淡滲痰濁;丹參、川芎活血化瘀,合用加強化瘀通絡功效;生大黃瀉熱通腸,涼血逐瘀,使熱邪、濕濁從腸腑而去;積雪草清熱利濕;玉米須利濕泄熱。全方配伍嚴謹,共奏脾腎氣陰并補、濕濁瘀血同消之效。現代藥理學研究表明,黃芪中的有效成分黃芪甲甙及黃芪多糖具有抗炎、免疫調節作用,通過阻斷腎組織內質網應激反應,減少蛋白尿,改善腎小球硬化和間質纖維化[11];太子參能降低血糖,調節血脂水平,在一定程度上改善糖尿病大鼠的腎臟病理變化[12];丹參提取物能保護血管內膜,改善腎臟的微循環,改善脂代謝紊亂,具有抗炎、抗凝作用[13];川芎可以有效降低糖尿病模型小鼠的血糖和脂質水平,具有降血糖、降血脂作用,同時具有擴張血管的功效[14];玉米須能降血糖,同時下調腎臟轉化生長因子β1(TGF-β1)、纖維粘連蛋白(FN)的表達,發揮腎保護作用[15];積雪草總苷具有抑制炎性反應、抑制纖維化、抑制氧化應激、保護足細胞、抑制細胞凋亡作用[16]。
研究表明,DKD患者普遍存在脂代謝紊亂,且脂質紊亂是糖尿病患者腎臟損害進行性發展的重要因素之一。血脂異常可以誘發炎性反應,并通過氧化應激激活TGF-β途徑損傷內皮細胞,加速腎臟病進展,另外TC、TC還可沉積于腎臟,導致腎小球硬化,通過調節血脂水平,或可改善DKD預后[17]。近年來,DKD被認為是多因素共同作用的結果,已經發現炎癥因素及高凝狀態參與了DKD的發病過程,糖脂代謝紊亂增加了血管內皮的通透性,損傷血管內皮功能,同時可引起炎癥因子低水平、持續性釋放,進一步加劇血管內皮損傷,加重腎臟損害[18-19]。IL-6是常見的促炎因子,幾乎參與了所有慢性炎癥性疾病的發展,在腎臟組織炎癥損傷后迅速產生,隨后誘導大量炎癥因子如hs-CRP的分泌,IL-6及hs-CRP水平升高,誘導血管內皮生長因子(VEGF)的過量合成,導致血管通透性增加[20-21]。DKD患者在慢性、持續的炎性反應下,可導致腎臟血流動力學異常,血液黏稠度升高,血液流速降低,形成高凝狀態,加重腎臟缺血情況,導致功能受損[22]。D-D是一種纖維蛋白降解產物,其水平異常增高提示體內高凝狀態[23]。本研究結果顯示,治療組總有效率高于對照組(P<0.05),治療后中醫癥狀倦怠乏力、頭暈耳鳴、心悸氣短、自汗盜汗、心胸窒悶及肢沉體胖積分均低于對照組(P<0.05),TC、TG、SCr、BUN、24 hUTP、hs-CRP、IL-6及D-D水平均低于對照組(P<0.05)。提示補氣養陰祛瘀泄濁湯聯合厄貝沙坦片治療氣陰兩虛兼痰阻血瘀型DKD療效確切,可有效改善患者中醫癥狀,有效減少蛋白尿,保護腎功能,其作用機制可能是通過調控血脂水平,改善血管內皮功能,抑制炎性反應,減輕腎臟損害,改善血液高凝狀態,緩解腎臟供血不足,從而延緩DKD病情進展,具有較高的臨床應用價值。但本研究觀察樣本量有限,且觀察時間較短,具體機制未十分明確,仍需進一步深入研究。

