激活受體PPAR-γ調節壓力超負荷誘導的大鼠心肌纖維化的研究①
王丹 盧迎宏 井海云王夢超李智慧包曉青陳文哲劉凱邢瑞星
(鄭州大學附屬鄭州中心醫院心血管內科,鄭州 450007)
心肌肥厚是多種心血管疾病發生發展過程中共同的病理特征,心肌細胞體積增大,成纖維細胞的活化導致膠原、纖連蛋白等細胞外基質異常沉積是其主要的病理生理變化。心肌肥厚作為一種機體代償性改變,隨著病情的逐漸加深,會逐漸進展為失代償性心力衰竭[1]。隨著生活水平及飲食習慣的改變,高血壓患者日益增多,持續高血壓引起的慢性壓力超負荷心功能不全逐漸引起人們的關注。過氧化物酶體增殖因子活化受體-γ(peroxisome proliferator-activated receptor-γ,PPAR-γ)作為核激素受體家族的成員之一,是配體激活的一類轉錄因子,主要參與調解炎癥反應在內的多種生物學功能[2]。有研究證實其主要通過抑制心肌炎癥反應進而在心肌缺血再灌注損傷中發揮保護效應[3]。炎癥反應是誘發心肌纖維化的因素之一,促炎因子分泌增多可活化心肌成纖維細胞,促進心肌細胞損傷或壞死,損傷心功能。基因治療是通過將功能明確的基因以載體導入病灶部位,對靶點區域部位的功能異常進行修復、補償和校正,進而恢復相關區域正常生理功能[4]。慢病毒載體作為一類使用較多的用于基因表達與治療的缺陷型載體,具有穩定表達、較低免疫性及外源基因容量大的優點,在心血管疾病等基因治療中廣泛應用[5-6]。PPAR-γ作為已知參與心肌異常的心血管炎癥疾病的發展環節的轉錄因子,為了探索PPAR-γ與壓力超負荷誘導的大鼠心肌細胞重塑的相關性[7]。本研究通過構建攜帶PPAR-γ的慢病毒載體,并用該載體對壓力超負荷大鼠進行治療,觀察其對大鼠心肌纖維化的影響,以期為壓力超負荷引起的心功能不全治療提供理論基礎。
1 材料與方法
1.1 材料
1.1.1 實驗動物SPF級雄性6周齡SD大鼠40只,體質量260~280 g,購于濟南金豐實驗動物有限公司[生產許可證號:SCXK(魯)2018-0006],于恒溫(22±2)℃、恒濕(55±5)%,SPF級飼養環境進行常規飼養。所有操作程序經倫理委員會批準。
1.1.2 試劑和儀器Lv-NC、Lv-PPAR-γ慢病毒載體的構建包裝純化均委托上海吉凱生物技術有限公司完成;TRIzol提取液購自美國Invitrogen公司;反轉錄相關試劑購自日本TaKaRa公司;SYBR Green Mix試劑盒購自美國LifeTech-nology公司;總蛋白RIPA裂解液購自美國ThermoFisher公司;PPAR-γ、α-滑肌肌動蛋白(α-smooth muscle actin,α-SMA)、TGF-β、纖維連接蛋白(fibronectin,FN)、誘導型一氧化氮合酶(inducible nitric oxide synthase,iNOS)、IL-10、IL-1β、IL-4、IL-6的PCR引物委托上海生物工程股份有限公司設計并合成;兔抗大鼠PPAR-γ、α-SMA、TGF-β、FN、iNOS、IL-10、β-actin單克隆抗體購自美國Santa Cruz公司;低溫高速離心機購自德國Eppendorf公司;酶標儀、蛋白印跡電泳儀購自美國Bio-Rad公司;熒光定量PCR擴增儀購自美國Thermo Fisher公司;倒置顯微鏡購自日本Olympus公司;超聲心動圖系統購自美國GE Health?care公司;BL-410生物機能實驗系統購自成都泰盟科技有限公司。
1.2 方法
1.2.1 動物的模型建立、分組及處理將40只SD大鼠隨機分為假手術組、模型組、Lv-NC組和Lv-PPAR-γ組,每組10只。在恒溫(22±2)℃、恒濕(55±5)%,SPF級飼養環境下適應性喂養1周后,給予3 ml/kg的水合氯醛麻醉后仰面固定在操作臺,常規消毒備皮后,沿腹部中線打開腹腔,小心地將腹主動脈分離,并用直徑0.7 mm的21G針頭沿腹主動脈平行位置放置,然后用4號手術線從腹主動脈背側p穿出,將針頭與腹主動脈共同結扎后,迅速移去針頭,形成50%~70%腹主動脈縮窄,之后關閉腹腔,假手術組大鼠僅打開腹腔,不結扎手術線[8]。完成手術后3 d,Lv-NC組和Lv-PPAR-γ組大鼠分別尾靜脈注射20μl 1×109TU/ml Lv-NC、Lv-PPAR-γ,假手術組、模型組注射等量生理鹽水。常規飼養4周后進行相關指標測定。
1.2.2 大鼠心功能檢測完成實驗后,將各組大鼠以三溴乙醇114 mg/kg腹腔注射麻醉后,使用超聲心動圖系統進行超聲心動圖檢測,從圖像中測量前壁和后壁的厚度,記錄中測量左心室舒張末期直徑(LVEDD)和左心室收縮末期直徑(LVESD),測定5個心動周期,并計算左室短軸縮短率(FS),計算公式為:FS(%)=(LVEDD-LVESD)×100/LVEDD×100%。測量完成后,大鼠取仰臥位,分離右頸部動脈,將充滿肝素的生理鹽水聚苯乙烯左心導管插入左心室,采用BL-410生物機能實驗系統檢測大鼠的心率(HR)及左心室收縮壓(LVSP)。
1.2.3 血清心肌損傷標志物水平檢測心功能檢測完成后,腹主動脈取血,分離血清,利用ELISA試劑盒檢測血清中cTnⅠ、CK-MB和Mb水平。
1.2.4 心肌組織HE染色及Masson染色稱重斷頭處死大鼠,取出心臟,用預冷的生理鹽水將血液等沖洗干凈,置于干凈的濾紙上吸干多余水分,沿房室交界處去除左右心房,保留左心室稱量后,將心臟標本分為2份,一部分用錫紙包裹置于液氮中速凍,保存于-80℃超低溫冰箱用于后續RT-PCR及Western blot檢測。一部分置于4%多聚甲醛內固定24 h,常規脫水,透明,包埋,切片后,按照HE試劑盒說明進行染色,顯微鏡下各組大鼠心肌組織病理改變。另取部分切片根據Masson試劑盒說明書添加染液,分化,脫水,透明,封片。在倒置熒光顯微鏡下觀察膠原沉積,并使用Image-ProPlus 6.0軟件計算膠原容積分數(CVF)。
1.2.5 RT-PCR檢測心肌組織中相關基因mRNA表達取1.2.3中保存的心肌組織樣品,按照總RNA提取試劑盒說明書上操作步驟提取總RNA,提取后用紫外分光光度計檢驗,OD值(A260/A280)=1.8~2.0,并用凝膠電泳檢測RNA的完整性。將符合要求的低mRNA按照反轉錄試劑盒說明書進行cDNA的合成。反轉錄體系(10μl):2×miRNA反應混合液5μl、0.1%BSA 1μl、miRNA PrimeScript?RT酶混合物1μl、總RNA 0.5μl、去RNA酶ddH2O 2.5μl。反應條件設置:37℃60 min,85℃5 s,4℃30 min。PCR體系10μl:SYBR?Prmix Ex TapⅡ(2×)5μl、正向引物0.4μl、反向引物0.4μl、ROX Reference DyeⅡ(50×)0.2μl、cDNA 1μl、ddH2O 3μl。詳細操作見試劑盒說明書。PCR反應參數設置:50℃激活聚合酶5 min,95℃預變性30 s,95℃變性5 s,60℃退火和延伸34 s,反應進行40個循環。溶解曲線繪制:95℃15 s,60℃60 s,85℃15 s,60℃15 s。每個樣孔設置3個復孔。用2-ΔΔCt法計算mRNA表達。
1.2.6 Western blot檢測心肌組織中相關蛋白表達取凍存的心肌組織于冰上研磨成粉末,加入RIPA裂解液后提取總蛋白,采用BCA法對蛋白水平進行定量,并利用Bradford調整各組蛋白濃度一致,經SDS-PAGE凝膠電泳、電轉膜至甲醛預處理過的PVDF膜,密封2 h,加入兔抗鼠PPAR-γ、α-SMA、TGF-β、FN、iNOS、IL-10、Actin(1∶500)一抗4℃孵育過 夜,TBST漂 洗40 min,加 入HRP標 記 的 二 抗(1∶500)孵育1 h,TBST漂洗40 min,使用ECL試劑盒在DNR Bio Imaging System上觀察膜上蛋白條帶,收集影像,采用Image J軟件對各組條帶灰度值進行半定量分析。
1.3 統計學處理采用SPSS20.0統計軟件進行數據分析,計量資料以±s表示,若正態分布、方差齊,采用獨立樣本t檢驗。P<0.05為差異有統計學意義。
2 結果
2.1 Lv-PPAR-γ轉染效率的鑒定如圖1所示,模型組大鼠心肌組織中PPAR-γmRNA及蛋白表達水平較假手術組均顯著降低(P<0.05);模型組與Lv-NC組大鼠心肌組織中PPAR-γmRNA及蛋白表達水平表達差異無統計學意義(P>0.05);Lv-PPAR-γ組大鼠心肌組織中PPAR-γmRNA及蛋白表達水平較模型組顯著升高(P<0.05)。見圖1。
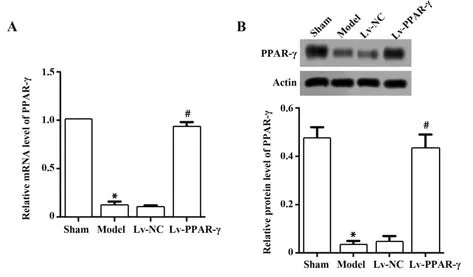
圖1 各組大鼠心肌組織中PPAR-γmRNA及蛋白表達水平Fig.1 Expression levels of PPAR-γmRNA and protein in myocardial tissues of each group
2.2 各組大鼠心室功能指標比較模型組大鼠HR、LVSP、FS水平較假手術組均顯著降低(P<0.05);模型組與Lv-NC組大鼠HR、LVSP、FS水平比較差異無統計學意義(P>0.05);Lv-PPAR-γ組大鼠HR、LVSP、FS水平較模型組顯著升高(P<0.05,表1)。
表1 各組大鼠心室功能指標比較(±s,n=10)Tab.1 Comparison of ventricular function indexes of each group(±s,n=10)

表1 各組大鼠心室功能指標比較(±s,n=10)Tab.1 Comparison of ventricular function indexes of each group(±s,n=10)
Note:Compared with sham group,1)P<0.05;compared with model group,2)P<0.05.
Groups Sham Model Lv-NC Lv-PPAR-γ HR/(beat·min-1)411.32±30.73 212.46±21.521)215.18±22.68 334.29±38.282)LVSP/mmHg 131.66±23.29 55.72±7.171)52.19±8.54 120.13±12.272)FS(%)29.19±2.26 7.91±1.641)8.03±2.43 22.18±2.632)
2.3 各組大鼠血清心肌損傷標志物水平比較模型組大鼠血清中CK-MB、Mb、cTnⅠ水平較假手術組均顯著升高(P<0.05);模型組與Lv-NC組大鼠血清中CK-MB、Mb、cTnⅠ水平比較差異無統計學意義(P>0.05);Lv-PPAR-γ組大鼠血清中CK-MB、Mb、cTnⅠ水平較模型組顯著降低(P<0.05,表2)。
表2 各組大鼠血清心肌損傷標志物水平比較(±s,n=10)Tab.2 Comparison on levels of myocardial injury markers in each group(±s,n=10)
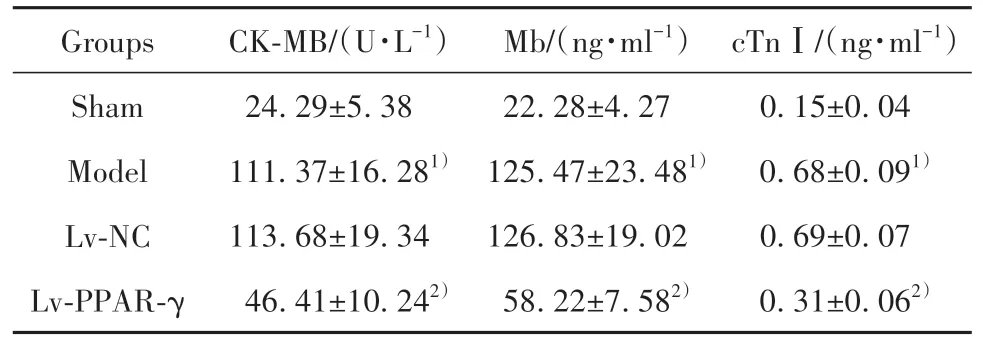
表2 各組大鼠血清心肌損傷標志物水平比較(±s,n=10)Tab.2 Comparison on levels of myocardial injury markers in each group(±s,n=10)
Note:Compared with sham group,1)P<0.05;compared with model group,2)P<0.05.
Groups Sham Model Lv-NC Lv-PPAR-γ CK-MB/(U·L-1)24.29±5.38 111.37±16.281)113.68±19.34 46.41±10.242)Mb/(ng·ml-1)22.28±4.27 125.47±23.481)126.83±19.02 58.22±7.582)cTnⅠ/(ng·ml-1)0.15±0.04 0.68±0.091)0.69±0.07 0.31±0.062)
2.4 各組大鼠左心HE染色結果比較如圖2所示,假手術組大鼠心肌細胞、心肌纖維無異常,紋路清晰;模型組和Lv-NC組大鼠心肌纖維排列紊亂,橫紋難以辨別,可見少量心肌斷裂,核固縮;Lv-PPAR-γ組大鼠心肌排列紊亂明顯改善,可以看出橫紋,肌纖維腫脹也有所改善。

圖2 各組大鼠心肌組織HE染色結果(×400)Fig.2 HE staining results of rats myocardial tissues in each group(×400)
2.5 各組大鼠左心Masson染色結果比較如圖3所示,模型組和Lv-NC組大鼠心肌細胞可見大量藍色膠原纖維沉積,且模型組CVF水平較假手術組顯著升高(P<0.05);Lv-PPAR-γ組大鼠心肌細胞膠原沉積明顯減少,心肌纖維化程度降低,且CVF水平較模型組顯著降低(P<0.05)。
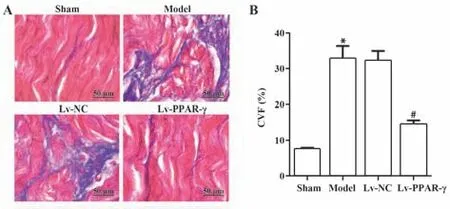
圖3 各組大鼠心肌組織Masson染色結果(×400)Fig.3 Masson staining results of rats myocardial tissues in each group(×400)
2.6 各組大鼠心肌組織中纖維化標志物表達水平比較如圖4所示,模型組大鼠心肌組織中α-SMA、TGF-β、FN mRNA和蛋白相對表達水平較假手術組均顯著升高(P<0.05);模型組與Lv-NC組大鼠心肌組織中α-SMA、TGF-β、FN mRNA和蛋白相對表達水平比較差異無統計學意義(P>0.05);Lv-PPAR-γ組大鼠心肌組織中α-SMA、TGF-β、FN mRNA和蛋白相對表達水平較模型組顯著降低(P<0.05)。

圖4 各組大鼠心肌組織中纖維化標志物mRNA及蛋白表達水平Fig.4 Expression levels of fibrosis markers mRNA and protein in myocardial tissues of each group
2.7 各組大鼠心肌組織中炎癥相關因子表達水平比較如圖5所示,模型組大鼠心肌組織中iNOS、IL-1β、IL-6、IL-10、IL-4 mRNA及iNOS、IL-10蛋白相對表達水平較假手術組均顯著升高(P<0.05);模型組與Lv-NC組大鼠心肌組織中iNOS、IL-1β、IL-6、IL-10、IL-4 mRNA及iNOS、IL-10蛋白相對表達水平比較差異無統計學意義(P>0.05);Lv-PPAR-γ組大鼠心肌組織中iNOS、IL-1β、IL-6 mRNA及iNOS蛋白相對表達較模型組顯著降低(P<0.05),IL-10、IL-4 mRNA及IL-10蛋白相對表達水平較模型組顯著升高(P<0.05)。
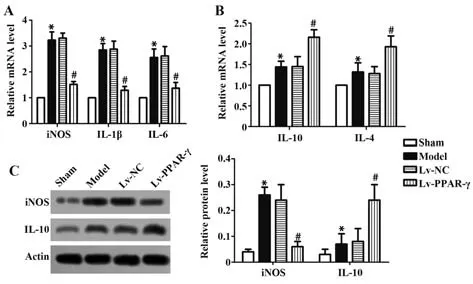
圖5 各組大鼠心肌組織中炎癥相關因子表達水平比較Fig.5 Comparison on expression levels of inflammationrelated factors in rats myocardial tissues of each group
3 討論
心肌肥厚是機體應對壓力負荷過重的一種代償機制,通過增加心肌總量使得心臟收縮能力增強,進而維持心臟的正常血液循環,但由于肥大的心肌會增加耗氧量,冠狀動脈又無法提供足夠的供血,長期如此會導致心肌缺血,而引起代償性心力衰竭發生[9]。雖然目前諸多研究表明PPAR-γ在心肌肥厚等多種心血管疾病中發揮著重要作用[10-11],但其具體的分子機制仍有待探索。壓力負荷性模型是心血管疾病研究的常用模型之一,其中腹主動脈縮窄是建模較為理想的一種[12]。本研究通過采用腹主動脈縮窄術構建心室肥厚大鼠模型,發現模型大鼠心臟組織中PPAR-γmRNA及蛋白表達水平均顯著降低,提示PPAR-γ很有可能成為治療壓力超負荷性心功能不全的有效靶標。慢病毒載體是目前基因治療載體研究的熱點方向,其對分裂和非分裂細胞均有較高的感染能力,從而在體內獲得長期表達,并且安全性好[13]。本研究結果顯示通過尾靜脈注射包裝完成的攜帶PPAR-γ基因的載體后,能夠顯著提高模型大鼠心肌組織中PPAR-γmRNA及蛋白表達水平,表明慢病毒介導的過表達可以有效提高心肌組織中PPAR-γ表達水平。
本研究結果發現,模型組大鼠HR、LVSP、FS水平均顯著降低,并且血清心肌損傷標志物CK-MB、Mb、cTnⅠ水平顯著升高,而感染Lv-PPAR-γ組大鼠HR、LVSP、FS水平均有所改善,并且CK-MB、Mb、cTnⅠ水平顯著降低,表明穩定表達PPAR-γ能夠改善壓力超負荷大鼠左心室功能,減輕心肌損傷。HE染色結果顯示,模型組大鼠心肌纖維排列紊亂,橫紋難以辨別,可見少量心肌斷裂,核固縮,并且存在少量炎癥細胞浸潤。Masson染色結果顯示,膠原沉積顯著升高,而感染Lv-PPAR-γ后大鼠心肌排列紊亂明顯改善,橫紋及纖維腫脹也有所改善,并且膠原沉積也顯著降低。炎癥反應在心力衰竭等心血管疾病的發病機制中發揮重要的作用,而炎癥因子引起的損傷會進一步導致心肌成纖維細胞的遷移及增殖,心肌組織的修復及纖維化必不可少[14]。α-SMA是肌成纖維細胞的特征性標志物,也是成纖維細胞具有收縮活性的基礎[15];FN則是細胞外基質的主要成分,前者可誘導膠原的形成,促進臟器纖維化[16];TGF-β是目前研究發現致纖維化細胞因子中重要的一種調控因子,它能夠誘導α-SMA、COLIA1、Vimentin等纖維蛋白的合成,同時TGF-β還可以通過與相應的受體相結合,刺激活化成纖維細胞,促進成纖維細胞向肌成纖維細胞轉化,大量分泌細胞外基質,最終導致纖維化[17-18]。本研究結果顯示,模型組大鼠心肌組織中α-SMA、TGF-β、FN mRNA和蛋白相對表達水平均顯著升高,而感染Lv-PPAR-γ后α-SMA、TGF-β、FN mRNA和蛋白相對表達水平顯著降低,表明PPAR-γ可能通過抑制α-SMA、TGF-β、FN表達,從而抑制心肌組織纖維化。
iNOS是心肌組織中存在的3種類型NOS其中之一,正常情況下其表達量較低,但在病理相關刺激誘導下大量合成,參與機體防御反應,但同時也具有細胞毒性作用,會引起心肌細胞損傷[19];IL-1β、IL-6是由活化單核細胞合成的促炎癥細胞因子,能促進T、B細胞的增殖活化以及免疫球蛋白的產生,同時還能夠作為內生致熱源參與炎癥反應及促急性時相蛋白合成[20];IL-4、IL-10則主要是由Th2細胞分泌的一類抗炎癥細胞因子,通過抑制巨噬細胞的提呈功能來降低機體的炎癥反應[21]。本研究結果顯示,模型組大鼠心肌組織中促炎癥細胞因子iNOS、IL-1β、IL-6表達顯著升高,而抗炎癥細胞因子IL-4、IL-10水平也顯著升高,這主要是因機體自身調控炎癥細胞因子水平的負反饋調節機制,從而抑制過度炎癥反應,抗炎癥細胞因子也顯著升高。感染Lv-PPAR-γ后,心肌組織中iNOS、IL-1β、IL-6表達顯著降低,IL-4、IL-10水平顯著升高,表明PPAR-γ能夠通過抑制炎癥細胞因子的釋放進而緩解超負荷大鼠各種病理表征。相關研究表明,在壓力超負荷大鼠體內,RNA干擾NF-κB信號通路P65后可緩解壓力應激引起的心肌損傷,而新發現的PPAR-γ激動劑能夠通過抑制NF-κB上游的ⅠκB激酶磷酸化來抑制NF-κB信號通路[22-23]。因此,本研究推測PPAR-γ可能通過抑制NF-κB信號通路激活,抑制下游炎癥細胞因子合成,并促進抗炎癥細胞因子合成,從而減輕對心肌細胞的炎癥損傷,并降低心肌組織內膠原的異常沉積,進而緩解壓力超負荷引起的心肌肥厚與功能損傷。
綜上所述,本研究采用慢病毒介導的過表達PPAR-γ壓力超負荷動物模型試驗,提示心肌組織中穩定表達PPAR-γ可緩解壓力超負荷引起的心肌肥厚與功能損傷,其機制可能與抑制炎癥細胞因子釋放,降低心肌組織內膠原異常沉積有關。

