基于HMGB1/Beclin-1信號通路探討溫陽利水通絡法對腎病綜合征模型小鼠TNF-α、IL-4、IL-8的作用機制①
吳鵬公 敏黃琳 曾冬梅 吳洪皓 邱家廷(江西省贛州市中醫院,贛州 341000)
腎病綜合征是由感染、遺傳、免疫等多種病因引起的臨床腎臟疾病綜合征,其主要臨床癥狀表現為大量蛋白尿、低蛋白血癥、水腫和高脂血癥等[1-3]。腎病綜合征往往伴有腎小球濾過膜損傷、腎小球基膜通透性增加等病理生理狀態,其病因復雜多變,患病率和發病率也呈逐年增長趨勢[4-5]。micro RNAs是一種小型非蛋白質編碼的單鏈RNA,在組織中轉錄調控目標基因表達。相關資料記錄到,microRNA參與了包括細胞發育、凋亡和自噬在內的一系列過程[6-7]。現有研究表明,miR-141與HMGB1/Beclin-1間的平衡是影響腎病綜合征發生發展的重要原因[8]。腎病綜合征的治療以糖皮質激素、烷基化劑及環孢霉素等免疫抑制劑預防、延緩腎功能進行性惡化為主,這些療法雖能緩解臨床癥狀、預防并發癥,但均出現不良反應[9]。目前,中醫藥在治療腎病綜合征上具有一定的優勢。溫陽利水通絡法是中醫藥方,具有溫陽利水的功效,本文旨在研究溫陽利水通絡法調控HMGB1/Beclin-1信號通路對腎病綜合征的治療效果及作用機制。
1 材料與方法
1.1 材料
1.1.1 實驗動物30只小鼠[許可證號:SCXK(京)2016-0006;倫理號:IACUC-DWZX-2020-627],雄性,SPF級,體質量(30±2)g,購于醫學實驗動物基地,集體飼養,鼠籠安靜整潔,室內溫度保持在15~25℃,空氣流通干燥。
1.1.2 藥品及試劑茯苓30 g、黃芪30 g、銀杏葉20 g、附子15 g、白術15 g、赤芍15 g、紅參10 g、豬苓10 g、川芎10 g、干姜10 g、甘草6 g,置于涼水中浸泡1 h,煎煮30 min后濃縮為2 g/ml。鹽酸阿霉素(25316-40-9,深圳萬樂藥業有限公司),兔抗小鼠HMGB1抗體,山羊抗小鼠Beclin-1抗體,兔抗小鼠LC3(英國Abcam公司);TNF-α、IL-4、IL-8 ELISA Kits(北京百智生物科技公司)。
1.1.3 儀器全自動生化分析儀(BK-200,江蘇英諾華醫療技術有限公司);裂解液(NONE6960,上海申友生物公司);染色試劑盒(G1120-100,北京索萊寶科技有限公司);光學顯微鏡(XTL,美國Nikon公司);包埋機(BK-TEⅠ,LEICA公司);烤片機(E0991,Leica公司);切片機(E0974,Leica公司);酶標儀(BIOBASE-EL10A,上海閃譜生物科技公司);蛋白電泳儀(112-0830,美國Bio-Rad公司);轉膜儀(TY-20101,上海天能科技有限公司);高速離心機(TG-16W-Ⅰ,Eppendorf公司);凝膠成像儀(LGDL-96,美國Life Technology公司)
1.2 方法
1.2.1 動物造模模型組和溫陽利水通絡法組小鼠采用尾靜脈注射6.5 mg/kg鹽酸阿霉素建立腎病綜合征模型,小鼠24 h尿蛋白明顯增加即為建模成功,對照組小鼠注射等劑量生理鹽水。造模結束后第5天開始用藥,溫陽利水通絡法組小鼠20 g/(kg·d)灌胃(溫陽利水通絡法共煎制200 g)。根據臨床實際,選擇小鼠與人的等效劑量的倍數為5.98。處方總劑量200 g,如果給體質量60 kg的成人每日服用1劑,即成人劑量3.33 g/(kg·d),則小鼠等效劑量為19.93 g/(kg·d),約為20 g/(kg·d),對照組、模型組小鼠采用同劑量蒸餾水灌胃,1次/d,連續3周。
1.2.2 檢測小鼠腎功能指標取小鼠血、尿樣,檢測肌酐(creatinine,CRE)、尿素氮(blood urea nitro?gen,BUN)及24 h尿蛋白量。
1.2.3 HE染色觀察小鼠腎組織病理變化給藥停止24 h后,小鼠腹腔注射戊巴比妥斷頭處死,取其腎組織,在10%福爾馬林中固定48 h,經過脫蠟、包埋、切片,切片水化后制成玻片標本,加入Mayer's蘇木精在室溫下孵育10 min,加入0.5%曙紅溶液室溫下孵育3 min,鏡下觀察。
1.2.4 腎組織病理評分0分:腎組織各部分正常,沒有腫大及炎癥;1分:腎組織各部分不清晰,出現輕微腫大及炎癥情況;2分:腎組織出現嚴重腫大,炎癥反應明顯;3分:腎組織損傷明顯,邊界不明,炎癥加劇。
1.2.5 小鼠TNF-α、IL-4、IL-8表達血樣離心取上清液,檢測TNF-α、IL-4、IL-8水平。
1.2.6 Western blot檢測小鼠腎組織相關蛋白表達水平腎組織裂解緩沖,測定總蛋白。電泳分離等量蛋白質,4℃下添加一抗孵育過夜,洗滌后添加二抗,顯影后分析蛋白水平。
1.3 統計學分析采用統計學軟件SPSS21.0分析數據,以±s記錄,采用t或F檢驗,P<0.05表示差異具有統計學意義。
2 結果
2.1 腎功能指標模型組小鼠CRE、BUN、24 h尿蛋白量高于對照組;溫陽利水通絡法組CRE、BUN、24 h尿蛋白量低于模型組,見表1。
表1 腎功能指標水平(±s,n=10)Tab.1 Renal function index level(±s,n=10)

表1 腎功能指標水平(±s,n=10)Tab.1 Renal function index level(±s,n=10)
Note:Compared with control group,1)P<0.05;compared with model group,2)P<0.05.
Groups Control Model Wen Yang Li Shui Draining F P CRE/(mg·dl-1)0.53±0.06 1.49±0.201)0.72±0.092)150.614 0.000 BUN/(mg·dl-1)18.02±2.31 47.06±4.631)24.93±4.022)160.617 0.000 24 h urine protein level/(mg·dl-1)24.02±3.03 79.35±4.711)35.85±3.632)571.416 0.000
2.2 腎組織病理對照組小鼠腎小球,腎小囊清晰可見,無異常(圖1A);模型組小鼠腎小球形態異常腫大,腎小囊皺縮,基底膜加厚伴系膜基質變多,邊界模糊(圖1B);溫陽利水通絡法組小鼠腎小球形態改善,腫大減小,腎小囊皺縮緩解(圖1C)。
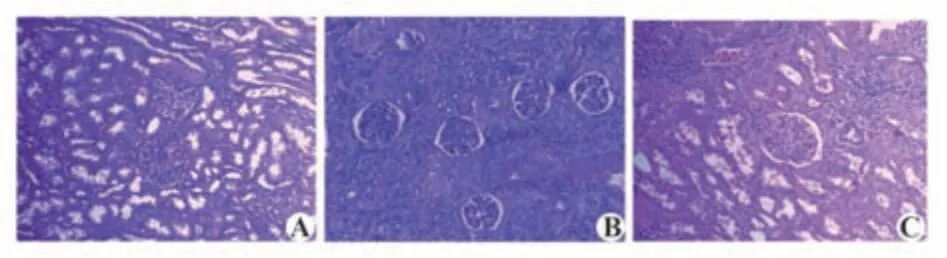
圖1 腎組織病理變化(×200)Fig.1 Pathological changes of kidney tissue(×200)
2.3 腎組織病理評分模型組小鼠腎組織病理評分增加高于對照組;溫陽利水通絡法組腎組織病理評分低于模型組,見表2。
表2 腎組織病理評分(±s,n=10)Tab.2 Renal histopathological score(±s,n=10)

表2 腎組織病理評分(±s,n=10)Tab.2 Renal histopathological score(±s,n=10)
Note:Compared with control group,1)P<0.05;compared with model group,2)P<0.05.
Groups Control Model Wen Yang Li Shui Draining F P Renal histopathological score 0.19±0.08 2.66±0.321)0.87±0.212)321.654 0.000
2.4 TNF-α、IL-4、IL-8水平模型組小鼠TNF-α、IL-4、IL-8表達高于對照組;溫陽利水通絡法組TNF-α、IL-4、IL-8表達低于模型組,見表3。
表3 TNF-α、IL-4、IL-8水平(±s,n=10)Tab.3 Levels of TNF-α,IL-4 and IL-8(±s,n=10)

表3 TNF-α、IL-4、IL-8水平(±s,n=10)Tab.3 Levels of TNF-α,IL-4 and IL-8(±s,n=10)
Note:Compared with control group,1)P<0.05;compared with model group,2)P<0.05.
Groups Control Model Wen Yang Li Shui Draining F P TNF-α/(ng·ml-1)0.21±0.14 1.35±0.181)0.51±0.122)161.758 0.000 IL-4/(ng·ml-1)0.19±0.08 1.12±0.361)0.38±0.132)48.231 0.000 IL-8/(ng·ml-1)0.32±0.17 1.55±0.311)0.56±0.212)73.779 0.000
2.5 腎組織相關蛋白表達模型組小鼠HMGB1、LC3、Beclin-1蛋白表達高于對照組;溫陽利水通絡法組HMGB1、LC3、Beclin-1蛋白表達低于模型組,見表4、圖2。

圖2 相關蛋白表達Fig.2 Expression of related proteins
表4 相關蛋白表達(±s,n=10)Tab.4 Related protein expression(±s,n=10)

表4 相關蛋白表達(±s,n=10)Tab.4 Related protein expression(±s,n=10)
Note:Compared with control group,1)P<0.05;compared with model group,2)P<0.05.
Groups Control Model Wen Yang Li Shui Draining F P HMGB1 0.11±0.05 0.71±0.151)0.34±0.112)75.436 0.000 LC3 0.19±0.11 0.82±0.281)0.40±0.132)28.288 0.000 Beclin-1 0.20±0.09 0.95±0.101)0.47±0.232)60.979 0.000
3 討論
腎病綜合征是表現為蛋白尿、低蛋白血癥、水腫、高脂血癥的腎臟疾病的臨床綜合征,該病的發病原因多種多樣,發病機制也不盡相同,涉及炎癥反應、微循環障礙、代謝異常等多個方面[10-12]。現今的臨床治療以激素類藥物為主,多數患者療效不佳,并且一部分患者長期服用激素類藥物還會產生較大的依賴性,一旦停止服藥,病情就會加劇反彈[13]。腎臟相關的疾病大多與腎間質的損傷密切相關,其中腎臟損害、腎功能減退的主要表現是尿蛋白,同時也是腎病綜合征的顯著表現,并會導致腎小管間質損傷[14]。中醫學將腎病綜合癥歸屬于“水腫”“虛勞”等范疇,其發病機制主要是肺、脾及腎臟功能失調,其本質是腎元虧虛,治療原則當屬疏風行水、運脾化濕、活血化瘀、利濕解毒等[15]。人體的水液代謝與腎、脾、肺的氣化調節密不可分,氣為陽,腎主水,水液代謝與腎陽的盛衰緊密相關,溫陽利水通絡法能夠治療脾腎陽虛型水腫,其臨床療效得到廣泛肯定。研究表明,miR-141與HMGB1/Beclin-1間的平衡是影響腎病綜合征發生發展的重要原因[8]。本文旨在研究溫陽利水通絡法調控HMGB1/Beclin-1信號通路對腎病綜合征的治療效果及作用機制。
自噬這一過程在機體內廣泛進行,自體細胞或細胞部分被吞噬后被攜裹至囊泡中,溶酶體與其結合為自噬溶酶體,滿足細胞自體代謝及更新,保證內環境與細胞代謝互相制衡[16]。相關資料記載,miR-141能夠與HMGB1結合,通過靶向抑制HMGB1的表達截斷HMGB1/Beclin-1信號通路,減輕急性腎損傷誘導產生的腎病綜合征,生理情況下的自噬并不會誘導腎病綜合征的發生發展[15]。但患者體內出現炎癥反應時,外周血中各種類型白細胞的比值會產生變化,嚴重時會導致免疫失衡[17]。相關資料表明,在TNF-α、IL-4、IL-8的調節控制下多個信號通路對炎癥反應起作用[18-19]。本文通過實驗對溫陽利水通絡法、腎病綜合征及HMGB1/Beclin-1信號通路、TNF-α、IL-4、IL-8進行探索。留取小鼠靜脈血以及尿液來檢測小鼠腎功能指標發現,模型組小鼠CRE、BUN、24 h尿蛋白量水平明顯高于對照組,證明造模后小鼠腎功能損傷,通過檢測發現,模型組小鼠TNF-α、IL-4、IL-8水平升高,病理圖也證實模型組小鼠腎組織出現損傷,腎小球腫大,腎小囊皺縮,邊界不清晰,是明顯的炎癥反應,腎組織病理評分也出現異常升高,這提示小鼠模型建立成功,經過溫陽利水通絡法治療后,小鼠腎功能指標水平下降,腎組織炎癥反應得以緩解,腎小球腫脹縮小,腎小囊皺縮減弱,腎組織病理評分下降,TNF-α、IL-4、IL-8也下降,提示溫陽利水通絡法能夠改善小鼠腎功能異常情況,緩解腎組織炎癥反應,可通過調控腎病綜合征大鼠的機體免疫改變,發揮抗炎作用。
Beclin-1是自噬基因[20]。HMGB1與細胞核內轉錄、復制、重組和基因組穩定性等密切相關,對于炎癥、免疫反應、自噬及癌癥也有調節控制作用[21]。相關研究指出,HMGB1可以誘導Beclin-1于Beclin-2中分離,并促進Beclin-1與Ⅲ型磷酸肌醇3激酶結合,激活自噬[22]。miR-141能夠在HMGB1 mRNA的啟動子上結合HMGB1受體從而阻斷其表達,進而抑制HMGB1/Beclin-1通路阻斷激發自噬體過程,但其在腎病綜合征中是否也存在尚不可知[23]。實驗發現,腎病綜合征小鼠造模完成后,小鼠腎組織出現明顯炎癥變化,且蛋白表達上升,表明HMGB1/Beclin-1信號通路與腎病綜合征密切相關,而經過溫陽利水通絡法治療后,小鼠腎組織中HMGB1、LC3、Beclin-1蛋白表達下降,證明溫陽利水通絡法能夠調控HMGB1/Beclin-1信號通路,對于腎病綜合征中腎臟的損傷、炎癥情況及臨床癥狀都具有重要意義。
綜上所述,溫陽利水通絡法能夠調節控制HMGB1/Beclin-1信號通路作用于TNF-α、IL-4、IL-8水平,對于腎臟功能、腎臟損傷、炎癥反應等也具備調節控制作用,同時指出miR-141可能與腎病綜合征關系密切,需進一步深入討論。

