白內障超聲乳化摘除術聯合小梁切除術治療伴白內障的持續高眼壓狀態閉角型青光眼的療效
韓光杰,黃紅波,陳秋菊
(廣西柳州市紅十字會醫院眼科,廣西柳州 545001)
青光眼合并白內障是臨床上常見的致盲性眼病,兩者有密切聯系,很多閉角型青光眼同時伴有年齡相關性白內障,而年齡相關性白內障膨脹期易誘發閉角型青光眼的急性發作[1]。隨著白內障超聲乳化技術的成熟和普及,青光眼合并白內障的手術方式和治療效果得到很大的改善及提高。現將我院2017年2月至2020年1月收治的25例25眼伴有白內障的持續高眼壓狀態下的閉角型青光眼患者,行白內障超聲乳化摘除術+人工晶體植入術+小梁切除術治療的臨床療效總結報告如下。
1 資料與方法
1.1 一般資料全部對象均為2017年2月至2020年1月在柳州市紅十字會醫院(柳州市眼科醫院)眼科接受白內障超聲乳化摘除術+人工晶體植入術+小梁切除術治療的伴白內障的持續高眼壓的閉角型青光眼患者,其中男性8例(8眼),女性17例(17眼),年齡52~77歲,平均65.3歲。所有患者經局部和全身降眼壓藥物及前房穿刺治療3天眼壓仍>30 mmHg,即行白內障超聲乳化摘除術+人工晶體植入術+小梁切除術聯合手術。
1.2 手術方法常規術前檢查及準備,術前1 h口服醋甲唑胺片500 mg、快速靜滴200 g/L甘露醇125 mL。常規消毒、鋪巾,表面和局部浸潤麻醉,壓迫眼球降低眼壓,做11:00至2:00以穹隆部為基底的結膜瓣,充分止血后作以角膜緣為基底4 mm×5 mm、1/2厚板層鞏膜瓣,用鑷子夾住鞏膜瓣邊緣,盡量翻轉,向下方輕輕牽拉,利用新月形刀以幾乎平貼鞏膜的方向劃開鞏膜層間纖維,向前剖開至透明角膜緣內1 mm。于結膜瓣和鞏膜瓣下放置25~50 g/L的氟尿嘧啶5 min左右(具體視患者年齡、筋膜囊厚薄等情況而定)[2],隨后用100 mL生理鹽水沖洗干凈。2點位置角膜緣行側切口緩慢放出適量房水,前房注入黏彈劑后于10:30角膜做3.0 mm透明角膜切口,連續環形撕囊后水分離、分層,行白內障超聲乳化并人工晶狀體植入術,角膜切口縫合1~2針,前房予卡巴膽堿縮瞳。再常規切除小梁,縫合鞏膜瓣兩角,注意觀察濾過量,鞏膜瓣兩邊置2根鞏膜瓣可調縫線,連續縫合球結膜瓣。術畢于側切口注入少量生理鹽水使前房深度正常。球結膜下注射地塞米松注射液2 mg,予妥布霉素地塞米松眼膏后包扎術眼。術后每日常規予抗炎、散瞳等治療,每日觀察視力、眼壓、前房深度、濾過泡形態及眼內炎癥反應等情況,根據前房深度及眼壓情況拆除可調縫線,根據眼內反應輕重加強結膜下注射地塞米松。
1.3 手術成功標準(1)完全成功:不用任何抗青光眼藥物,眼壓穩定在6~21 mmHg。(2)部分成功:局部加用1~3種抗青光眼藥物,眼壓穩定在6~21 mmHg。(3)手術失敗:局部使用3種以上抗青光眼藥物眼壓仍>21 mmHg。
1.4 觀察項目和隨訪時間手術前系統的眼科檢查,如視力、眼壓、裂隙燈、眼底、視野等,術后每個隨訪點(1周、1個月、2個月、3個月、6個月、1年)重點觀察并登記手術成功率、最佳矯正視力、眼壓(Icare眼壓計)、濾過泡、手術并發癥等。
1.5 統計學方法應用SPSS 13.0統計學軟件對有關臨床數據進行統計分析。術后各個時間點的眼壓與術前眼壓的比較采用Dunnett-t檢驗,患者隨訪滿1年時的眼壓與術前眼壓差異的比較采用配對t檢驗;手術前后視力變化的比較采用等級資料的秩和檢驗。檢驗水準:α=0.05,雙側檢驗。
2 結 果
2.1 手術成功率術后1周手術的完全成功率為100.0%(25眼);隨訪滿1年手術的完全成功率為56.0%(14眼),部分成功率為24.0%(6眼),總成功率為80.0%。見表1。
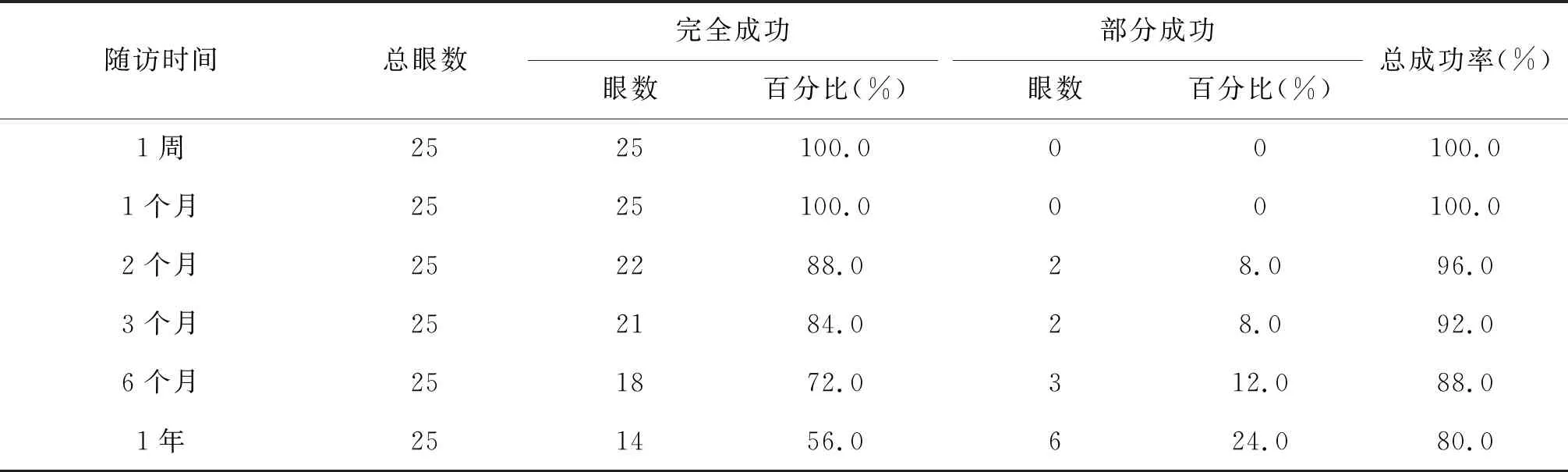
表1 青白聯合手術治療后不同隨訪時間點的手術成功率(n,%)
2.2 手術前后視力的變化隨訪至1年時有3只眼視力下降,15只眼視力提高,7只眼視力保持不變,術后大部分患者的視力較術前改善或保持穩定。經兩頻數表資料比較的秩和檢驗,術后1年的視力較術前提高,差異有統計學意義(Z=-2.118,P<0.05)。見表2。
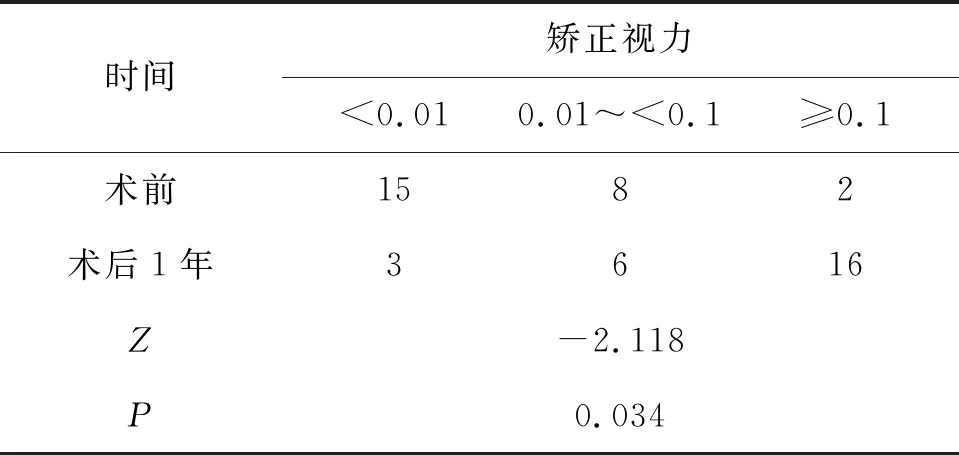
表2 青白聯合手術治療前后最佳矯正視力變化頻數分布比較
2.3 手術前后眼壓的變化本組患者術前眼壓為30~66 mmHg,平均(43.19±10.13)mmHg,術后1年的眼壓為13~35 mmHg,平均(19.75±8.36)mmHg,術前與術后1年眼壓比較采用配對t檢驗,差異有統計學意義(t=7.550,P<0.001)。術后各個隨訪點的眼壓與術前眼壓比較,差異均有統計學意義(P<0.001)。見表3。5眼術后1年時使用最大限量抗青光眼藥物治療后眼壓仍大于21 mmHg,為手術失敗。
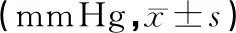
表3 青白聯合手術治療前后眼壓變化的比較
2.4 濾過泡形態根據Kronfeld分級標準分為:Ⅰ型為微小囊泡型,薄壁無血管,多囊狀的濾過泡;Ⅱ型為彌漫扁平型;Ⅲ型為失敗濾過泡,濾過泡缺如或包裹。術后1年復診時,有15例表現為Ⅰ型或Ⅱ型濾過泡,其余10例表現為Ⅲ型瘢疤型濾過泡。
2.5 手術并發癥3眼于術中操作眼壓降低后出現少量前房積血,于術后4~7 d完全吸收;全部術眼術后均有不同程度的前房炎癥反應,表現為前房滲出、房水閃輝、瞳孔后粘連等,經局部及全身激素抗感染治療,前房滲出和房水閃輝消失,但殘留有部分瞳孔后粘連、周邊虹膜前粘連和瞳孔固定散大;術后2個月~1年有5例眼壓失控,經藥物、間斷性的針刺分離未能控制眼壓,最后行睫狀體光凝術后眼壓控制平穩;所有患者無眼內感染、大泡性角膜病變、惡性青光眼和脈絡膜上腔出血等嚴重并發癥發生。
3 討 論
閉角型青光眼急性大發作時如眼壓未能及時控制,可在短期甚至數日內失明。為了減少術中和術后并發癥,理論上閉角型青光眼需將眼壓降至正常再進行手術[3],但臨床上時而可以看到一些閉角型青光眼急性發作期的患者,應用多種抗青光眼藥物也不能將眼壓控制正常,這樣日復一日,往往因為在等待眼壓下降后再手術而延誤寶貴的治療時機,導致視功能受損甚至完全失明[4]。為了避免高眼壓對視神經功能造成進一步損害,有必要在高眼壓持續的狀態下采用手術治療,降低眼壓。而完善的術前準備,術中精心的操作,術后精心的護理,高眼壓下的青光眼手術是必要、安全、有效的[5]。
伴有白內障的青光眼患者手術方式主要有白內障超聲乳化摘除術+人工晶體植入術、小梁切除術、白內障超聲乳化摘除術+人工晶體植入術+房角分離術和白內障超聲乳化摘除術+人工晶體植入術+小梁切除術等。白內障超聲乳化摘除術+人工晶體植入術+小梁切除術的指征包括符合濾過性手術指征的白內障患者,其中濾過性手術的適應證主要包括:急性或慢性前房角關閉、前房角粘連閉合范圍>180°、藥物無法控制眼壓升高或視神經損害較重[3]。晶狀體在原發性閉角型青光眼病情進展中發揮重要作用,會隨年齡的增長而逐漸增厚從而加重瞳孔阻滯,促進房角急性關閉,白內障手術摘除較厚晶狀體可有效緩解瞳孔阻滯帶來的急性閉角型青光眼發作的風險[6]。閉角型青光眼本身存在前房偏淺,而白內障的發展會使前房變得更淺,再加上高眼壓持續狀態,如果單純行小梁切除術會增加術后惡性青光眼等并發癥的發生率;如果行白內障超聲乳化摘除術+人工晶體植入術+房角分離術,由于術前在使用降眼壓藥物的同時眼壓仍持續增高,房角結構破壞較重,術后降眼壓效果欠佳。通過白內障超聲乳化手術植入厚度不足1 mm的人工晶體取代厚約5 mm的晶狀體,這樣就可以使晶體虹膜接觸平面向后移,加深前房,從發病機制和解剖上有效處理原發性閉角型青光眼的發病原因,重建前房角(重新開放或改善)、提高房水流暢系數等[7],當然超聲乳化白內障手術為閉合手術,在手術過程中,前房內灌注液的壓力對房角也會產生沖擊作用,可引起房角再度開放或粘連減少。
術后眼壓下降幅度與術前前房角粘連范圍的確切關系目前尚無文獻支持,迄今尚無基于循證醫學的臨床研究能證實前房角粘連超過180°其前房角功能就不足以代償[8]。術前患者前房角功能受損的程度與術后小梁網功能的恢復可能決定了手術的預后。臨床觀察到術前眼壓越高、杯盤比越大、視野缺損越重,均意味著青光眼越晚期,間接提示前房角功能破壞越嚴重。如此情況下,單獨解除混濁晶狀體的瞳孔阻滯因素,理論上就不足以有效降低眼壓、控制青光眼進行性發展。于秀玲等[9]對32例(32眼)應用藥物治療不能降低眼壓(≥35 mmHg)的合并白內障的閉角型青光眼患者進行回顧性分析,其中16眼采用白內障超聲乳化摘除術+人工晶體植入術+小梁切除術,16眼采用濾過手術后根據眼壓的情況再擇期行白內障超聲乳化摘除術和人工晶體植入術治療,雖然兩組患者術中術后并發癥、術后1周視力提高幅度及眼壓降低效果均無顯著性差異,但擇期手術組面臨小梁切除術后人工晶體度數測量精準度不確定,以及術后散光和晶狀體膨脹加重淺前房等問題,說明白內障超聲乳化摘除術+人工晶體植入術+小梁切除術優于分期手術。該術式治療合并白內障的青光眼患者可有效降低眼壓,同時也可明顯開放房角,有助于更好地長期控制眼壓[9]。
本研究術后1年時手術總成功率達到80%,有15眼表現為Ⅰ型或Ⅱ型濾過泡,眼壓控制理想,另10眼表現為Ⅲ型瘢痕型無功能濾過泡,但其中5例眼壓控制良好,說明其內引流作用強,而其原因正是由于瞳孔阻滯的解除和房角的重新開放,另5例濾泡形態不好的患者眼壓失控,說明濾過手術失敗,同時其房角關閉并致小梁功能受損失去其代償能力。青光眼白內障聯合術可分為白內障聯合小梁切除或聯合房角分離,但哪種聯合手術方式治療白內障合并青光眼更有效、方便,且并發癥少是一項亟待解決的臨床課題[10]。徐文生等[11]對比觀察在超聲乳化白內障吸除術的基礎之上,聯合小梁切除術或房角分離術治療急性閉角型青光眼合并白內障的臨床療效,結果顯示:聯合房角分離術組的臨床療效優于聯合小梁切除術組。兩組術前的視力、眼壓等比較無統計學意義,術后1個月兩組視力、眼壓及前房深度均顯著改善,但前者改善更明顯。我們的觀察發現術后部分病人當濾過泡形態不好時其降壓效果亦不佳,說明其房角未開放或開放后小梁功能不好,再加之術前無法判斷哪些病人術后房角會重新開放或小梁功能已嚴重受損害,所以具備有功能濾過泡的青光眼白內障聯合術是更為保險的選擇,但近2年在絲裂霉素緊缺的情況下,我們在小梁切除術中于結膜瓣和鞏膜瓣下放置25~50 g/L的氟尿嘧啶約5 min,此抗代謝藥物的使用保證了本項研究的高成功率。
術前持續性高眼壓,術前醋甲唑胺口服、甘露醇靜滴、術中球后阻滯麻醉及按摩后均可使眼壓部分下降[12-13],角膜恢復部分透明性,即便仍有部分水腫,仍可順利完成白內障手術操作。但高眼壓狀態下摘除白內障要面臨的風險也明顯增高,如術后角膜水腫、炎癥反應及潛在的眼內出血等可能[8]。當然,由于白內障難度增大,需要術者有嫻熟的手術操作技巧,術中盡量操作輕柔,對內皮數目較少患者使用軟殼技術,以降低對角膜內皮的進一步損害,個別患者出現纖維滲出等反應,術后給予相應的激素治療后得到控制[14]。因此,對于該類患者選擇青白聯合手術,規范、精細的手術技巧是前提[8]。

