基于CTA的血管3D可視化技術在保留左結腸動脈的腹腔鏡直腸癌根治術患者中的應用效果
袁瑜,郭敏,廖凱,張威
宜春市人民醫院普外二科 (江西宜春 336000)
近年來,消化系統惡性腫瘤發病率逐漸增加,特別是結直腸癌。在我國,直腸癌發病率大于結腸癌,低位直腸癌發病率約占70%[1]。臨床治療直腸癌患者的方案包括根治術、化學治療、放射治療等,其中手術治療的效果最佳[2]。臨床要延長直腸癌患者的生存時間,需提高手術安全性與腫瘤根治率,盡可能保留患者腸道的生理功能,從而提升患者術后生命質量。保留左結腸動脈(left colic artery,LCA)的腹腔鏡直腸癌根治術是近年來臨床爭議的熱點[3]。一般認為,腹腔鏡直腸癌根治術中保留LCA可改善吻合口血供,降低術后吻合口瘺發生率及術中造口率[4-5]。但美國結直腸外科醫師協會提出,術中應根據腸系膜下動脈(inferior mesenteric artery,IMA)的結扎方式選擇是否保留LCA[6];另外,劉洪等[7]也根據IMA的不同分型提出保留LCA的方式。因IMA分支變異較大,術前需明確分型及相對位置關系以有助于手術醫師決定是否將其保留。目前,國內雖已有學者將三維CT重建技術應用于腹腔鏡結直腸癌根治術中,并證實其具有前瞻性指導價值[8],但將血管三維重建與3D可視化技術相結合的應用研究不多;同時,關于該術式對患者腸道功能影響的研究更少。基于此,本研究旨在探討基于CTA的血管3D可視化技術輔助保留LCA腹腔鏡直腸癌根治術在直腸癌患者中的應用效果,并分析該術式對機體腸道功能的影響。
1 資料與方法
1.1 一般資料
選擇2020年1月至2021年4月我院診治的60例直腸癌患者為研究對象,按隨機數字表法將其分為對照組與試驗組,各30例。兩組一般資料比較,差異無統計學意義(P>0.05),具有可比性,見表1。患者及家屬對本研究知情同意。本研究經醫院醫學倫理委員會審核批準。

表1 兩組一般資料比較
納入標準:符合《直腸癌規范化診療指南(試行)》[9]中直腸癌的診斷標準;經綜合檢查確診為直腸癌;入組前無腸梗阻,腫瘤未浸潤周圍器官;術后接受隨訪;臨床資料完整;術前未接受過放化療。排除標準:未成年患者;存在麻醉禁忌證;腫瘤發生腹腔、遠處轉移,術前臟器位置已發生改變;術中因病情復雜,需中轉開腹;LCA不存在;既往有腸道手術史或其他腹部重大手術史;急診手術。
1.2 方法
所有患者入院后均接受盆腔MRI等專業檢查及血、尿等檢查,對合并高血壓、糖尿病等基礎疾病的患者進行治療;術前對患者進行完善的營養狀況評估,排除有手術禁忌證的患者;協助患者進行備皮等一系列術前準備。
對照組采用保留LCA的腹腔鏡直腸癌根治術:患者行全身麻醉后,取頭低足高體位;在臍上穿刺觀察孔,長度為12 mm;在左、右臍旁腹直肌外緣穿刺切口,長度為5 mm;在右下腹穿刺主要手術孔,長度為12 mm;在左下腹再做一個切口,長度為5 mm;然后將乙狀結腸系膜右側分離,術中保護兩側輸尿管,分離裸露的腸系膜下動靜脈,并進行根部淋巴組織清掃,將IMA及周圍靜脈結扎;將直腸固有筋膜與骨盆壁筋膜間隙分離,當直腸腫瘤位于低位時,分離至尾骨末端;打開直腸腹膜后皺襞,解剖直腸前壁與精囊(女性患者在直腸生殖隔膜水平完成分離),切斷兩側的外側韌帶并將其小心分離(注意保護盆腔自主神經);之后沿著直腸游離至腫瘤下方至少3 cm處,當位于腫瘤下方2 cm處時,用腹腔鏡切割器切斷;在下腹部做一小切口,長度為5.0 cm,將含腫瘤的結腸段移游離至腹腔外(注意保護切口),并將其切除;將大小合適的環形吻合器置入結腸近端,重建氣腹,用腹腔鏡將結腸與直腸斷裂面相連接;確保連接處無張力與變形發生,如出現發紺、缺血等現象,需擴大切除范圍,將連接處重新吻合;若腸道呈暗紫色,懷疑連接處發生了血液供應不良,應進行預防性回腸造口術;清洗盆腔,再次檢查,確保連接處無出血后,在連接處兩側放置兩根引流管;關閉手術切口。
試驗組采用基于CTA的血管3D可視化技術輔助保留LCA的腹腔鏡直腸癌根治術。(1)基于3D的CTA技術:使用64排CT(GE Light Speed VCT XT)進行腹部增強掃描;檢查前,調整好掃描參數(電壓為120 kV,電流為400 mAs,層厚為0.625 mm,層間距為0.625 mm,探測器準直為0.625 mm×64 mm),患者禁食8 h;入室后,患者取仰臥位,掃描區域從膈頂至坐骨結節平面;完成常規平掃后,經肘靜脈注入碘帕醇[上海博萊科信誼藥業有限責任公司,國藥準字H20073013,規格60 g(I)/200 ml/瓶](濃度為350 mgI/ml);掃描完成后,收集CTA原始dicom數據,拷貝光盤。(2)血管3D模型重建:將上述光盤數據導入3Dslicer 14.11.0版本中,采用閾值分割腹部三維血管模型,辨認后,提取IMA和LCA的三維模型,將其以STL格式輸出。(3)IMA和LCA的3D可視化:引進C3D視窗技術,將血管模型建成三維可視化應用,依據IMA分型與LCA的關系制訂手術方案,精準指導術中操作。(4)血管3D可視化輔助手術操作:手術方式同對照組,在保留LCA時,依照三維化的設計方案與術中實際情況進行操作。
1.3 評價指標
(1)圍手術期指標:統計兩組手術時間、術中出血量、腹腔引流量、拔除引流管時間及住院時間。(2)手術效果:統計兩組LCA保留成功率及總淋巴結清掃數。(3)術后病理情況:統計兩組術后腫瘤組織學類型、腫瘤TNM分期、253組淋巴結清掃數量及轉移率。(4)術后并發癥:統計兩組術后并發癥發生率,包括吻合口瘺、切口感染等。(5)腸黏膜損傷程度:術后,參考相關文獻[10]對兩組腸黏膜損傷程度進行分級;其中,腸黏膜存在脫落現象為0級,腸黏膜隱窩受損面積≤1/3為1級,腸黏膜隱窩受損面積≥1/3為2級,腸黏膜下層及腔壁呈壞死為3級,全層壞死為4級。(6)胃腸道功能:統計兩組術后腸鳴音恢復時間、正常排氣時間;分別于術前及術后抽取兩組3 ml外周靜脈血,以3 000 r/min對血液標本行離心處理(時間為10 min),分離血清標本后,采用電化學發光法檢測血清胃動素及胃泌素水平。
1.4 統計學處理
2 結果
2.1 圍手術期指標
兩組腹腔引流量、拔除引流管時間及住院時間比較,差異無統計學意義(P>0.05);試驗組手術時間短于對照組,術中出血量低于對照組,差異有統計學意義(P<0.05),見表2。
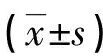
表2 兩組圍手術期指標比較
2.2 手術效果
兩組LCA保留成功率比較,差異無統計學意義(P>0.05);試驗組總淋巴結清掃數大于對照組,差異有統計學意義(P<0.05),見表3。

表3 兩組手術效果比較
2.3 術后病理情況
兩組253組淋巴結轉移率、TNM分期及組織學類型比較,差異均無統計學意義(P>0.05),試驗組253組淋巴結清掃數大于對照組,差異有統計學意義(P<0.05),見表4。

表4 兩組術后病理情況比較
2.4 術后并發癥
兩組術后切口感染、吻合口瘺、腸梗阻及泌尿功能障礙發生率比較,差異均無統計學意義(P>0.05),見表5。

表5 兩組術后并發癥發生情況比較[例(%)]
2.5 腸黏膜損傷程度
試驗組腸黏膜損傷程度低于對照組,差異有統計學意義(P<0.05),見表6。

表6 兩組腸黏膜損傷程度比較(例)
2.6 胃腸道功能
術前,兩組血清胃動素、胃泌素水平、術后正常排氣時間比較,差異無統計學意義(P>0.05);術后,試驗組血清胃動素、胃泌素水平均高于對照組,術后腸鳴音恢復時間短于對照組,差異有統計學意義(P<0.05),見表7。
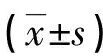
表7 兩組胃腸道功能比較
3 討論
直腸癌的發病與飲食、致癌物質、慢性炎癥等因素有關[11]。新輔助放化療的應用使得直腸癌患者的生存期逐漸延長,但以全直腸系膜切除術為基礎的手術仍是直腸癌治療的金標準。近年來,隨著腹腔鏡技術的不斷發展,有學者提出在直腸癌手術中保留LCA低位結扎腸系膜下動脈。研究發現,低位結扎可更好地保留斷端血運,降低接口處瘺與自主神經功能障礙發生率[12-13]。但目前絕大多數腹腔鏡手術均是在二維術野平面完成的,特別是基層醫院。二維術野平面無法立體展示細微的神經、細小血管等解剖結構,不僅增加了手術醫師的操作難度,且易增加術中副損傷。因而,為了提高保留LCA的技術水平,本研究引入血管三維可視化技術,明確IMA分型與LCA的關系,并指導術中進行保留LCA的操作,具有一定的創新性和應用前景。
目前,基于CTA的血管3D可視化技術在消化道血管評估中應用廣泛,與數字減影造影相比,該技術具有侵襲性小等優點,可更好地展現血管與腫瘤的相鄰關系,利于醫師判斷IMA血管的分型及變異,降低血管損傷及缺血等并發癥發生率[14-15]。
本研究結果顯示,試驗組手術時間短于對照組,術中出血量低于對照組,差異有統計學意義(P<0.05);提示,基于CTA的血管3D可視化技術可減少手術時間。其原因為,相較于單純的腹腔鏡手術,基于CTA的血管3D可視化技術可為外科醫師提供三維立體操作平面,并在不損失圖像清晰度的情況下,立體顯示毗鄰結構、血管壁及血管腔內的情況,更有利于術中操作,節省手術時間[16]。但本研究中兩組腹腔引流量、拔除引流管時間及住院時間比較,差異無統計學意義(P>0.05)。其原因可能為,本研究納入的樣本量較小,且手術醫師具備良好的腹腔鏡直腸癌根治術經驗,可更好地保證手術的安全性;若手術醫師缺乏腹腔鏡技術經驗,則上述指標可能出現一定的差異性,故后續需擴大樣本量,進行更深入的研究;另外,兩組術后切口感染、吻合口瘺、腸梗阻及泌尿功能障礙發生率比較,差異均無統計學意義(P>0.05),與陸王鋒[8]等的研究結果一致。
沿IMA起始至LCA起始之間分布的淋巴結被稱為第3站淋巴結,是進展期直腸癌轉移的主要途徑,故徹底清除IMA根部的淋巴結也是提高直腸癌根治術效果的重要指標[17-18]。本研究結果顯示,試驗組總淋巴結清掃數大于對照組,差異有統計學意義(P<0.05);兩組253組淋巴結轉移率、TNM分期及組織學類型比較,差異均無統計學意義(P>0.05);試驗組253組淋巴結清掃數大于對照組,差異有統計學意義(P<0.05);提示,基于CTA的血管3D可視化技術在腹腔鏡結直腸癌根治術中的應用有利于準確評估病理分型,提高淋巴結清掃率,從而達到根治腫瘤的效果,本研究結果與鄭恢超[16]等的研究結果一致。直腸固有筋膜與側方組織分界缺少顯著的解剖結構標志,在進行常規腹腔鏡直腸癌根治術過程中,往往需要手術醫師具備豐富的手術經驗;而借助基于CTA的血管3D可視化技術可為手術醫師提供三維立體感官及圖像放大效應,幫助其更為準確地的進行手術操作。本研究中,手術醫師普遍認為,借助血管3D可視化技術更加容易找到手術部位,從而可提高LCA保留率,更為全面地清掃淋巴結;直腸癌術后患者常出現不同程度的腸梗阻等并發癥,嚴重影響患者的生命質量;而腸梗阻多由手術損傷引起[19-20],腹腔鏡直腸癌根治術可在術中為手術醫師拓寬視野,并可通過增加氣腹壓力,促使患者腹腔內的器官分離,以方便手術進行。但在實際應用過程中發現,氣腹壓力的增加可在一定程度上增加人體內臟的負擔,從而對腸道造成損傷[21]。目前,在基于CTA的血管3D可視化技術的應用研究中,涉及腸道功能的研究多以腸鳴音恢復時間、肛門排氣時間為主要判斷指標,但上述指標難以客觀反映患者腸黏膜受損情況及腸道功能恢復情況,故本研究對患者腸黏膜受損程度及血清胃泌素、胃動素水平進行了研究。本研究結果顯示,試驗組腸黏膜損傷程度低于對照組,差異有統計學意義(P<0.05);試驗組術后血清胃動素、胃泌素水平均高于對照組,術后腸鳴音恢復時間短于對照組,差異有統計學意義(P<0.05)。該結果表明基于CTA的血管3D可視化技術可減輕患者腸黏膜損傷程度,促進其胃腸道功能恢復。其原因為,基于CTA的血管3D可視化技術可為手術醫師提供三維立體視野,使其更容易辨認組織層次,避免術中增加氣腹壓力,減少組織牽拉和局部創傷,進而可減少對患者腸道功能的影響。
綜上所述,基于CTA的血管3D可視化技術在保留LCA的腹腔鏡直腸癌根治術患者中的應用效果確切,可縮短患者手術時間,降低術中出血量,提高淋巴結清掃率,還可減輕腸黏膜損傷程度,促進患者胃腸道功能恢復,且不增加術后并發癥及腫瘤轉移風險。

