脂多糖抑制海馬神經前體細胞增殖
梁倩 高虹 李海
(1廣西醫科大學附屬武鳴醫院,廣西 南寧 530100;2寧波衛生職業技術學院醫學技術學院基礎醫學教研室;3右江民族醫學院組織學與胚胎學教研室)
人和大多數哺乳動物的部分腦區產生新神經元的過程謂之神經發生〔1〕,海馬齒狀回(DG)的顆粒下層是目前研究最多的神經發生區之一。研究表明,外周注射脂多糖(LPS)抑制DG區海馬的神經發生〔2~4〕。但是,LPS抑制DG區海馬神經發生的機制卻鮮有報道,本研究擬從在離體和體內水平觀察LPS對海馬DG神經發生的影響,一方面原代培養海馬神經前體(NPCs)細胞,鏡下觀察神經球減少的數目,另外在體水平上大鼠腹腔注射LPS,用5溴脫氧尿嘧啶(BrdU)標記DG區的增殖細胞、雙皮質醇(DCX)標記神經元、膠質纖維酸性蛋白(GFAP)標記星形膠質細胞、鈣接頭蛋白分子(Iba1)標記小膠質細胞變化的數目以追蹤觀察這些細胞的存活和分化狀況,探討增殖細胞減少的可能機制。
1 材料與方法
1.1實驗動物及分組 48只少年期雄性SD 大鼠,體重100~200 g,由右江民族醫學院實驗動物中心提供。隨機分成實驗組(LPS組,n=30)、生理鹽水對照組(NS組,n=18),按腹腔注射LPS和BrdU的先后時間,實驗組分為:①先注射LPS后BrdU標記(下簡稱先LPS后BrdU)組;②先Brdu標記后注射LPS(下簡稱先BrdU后LPS)組;③僅注射LPS組。對照組分為④先注射生理鹽水(NS)后BrdU標記(下簡稱先NS后BrdU)組;⑤先BrdU標記后注射NS(下簡稱先BrdU后NS)組;⑥僅注射NS組。每組分1、3、5、7 d四個時程。
1.2主要試劑 DMEM/F12培養基、B27(Gibco公司);表皮生長因子(EGF)、多聚賴氨酸、LPS、BrdU、BrdU抗體(Sigma公司);鈣接頭蛋白分子(Iba-1)抗體、膠質纖維酸性蛋白(GFAP)抗體、雙皮質醇(DCX)抗體、神經上皮干細胞蛋白(Nestin)抗體、Toll樣受體(TLR)4抗體(Abcam公司)。
1.3LPS誘發炎癥 NS組與LPS組均分別進行腹腔注射NS或LPS 1.0 mg/kg (溶于無菌生理鹽水),觀察LPS誘導的炎癥對NPCs存活與分化的影響和小膠質細胞的影響。
1.4大鼠發育變化觀察 腹腔注射生理鹽水或LPS前3天開始,每天用電子天平稱量大鼠體重,連續觀察9 d。
1.5BadU標記 NS組與LPS組均分別行腹腔注射NS或LPS后第1、3、5、7天進行BrdU 200 mg/kg (溶于無菌生理鹽水)2 h,后于相應的時間點分別處死動物。
1.6組織切片制備 動物麻醉后,依次用(0.01 mol/L)PBS和4%多聚甲醛溶液(PFA)灌流,斷頭取腦,將腦組織置于4% PFA 中后固定6~8 h后,轉移到20%的蔗糖溶液中4℃過夜至腦塊自然下沉。冰凍切片,自前囟后2.3 mm把含有齒狀回的海馬部分做連續冠狀切片,片厚40 μm,每6張切片取1張用于免疫組織化學染色。
1.7NPCs的分離和培養沿用本實驗室分離和培養NSCs的方法,將新生SD大鼠(0~2 d)置于75%的乙醇中浸泡消毒1~2 min后斷頭取腦,在超凈臺內用4℃平衡鹽溶液(HEBSS)洗兩次。在解剖顯微鏡下剝離腦膜和血管,切取海馬組織塊,制成單細胞懸液。1 000 r/min離心5 min,去除上清液,加入培養基(1∶1 DMEM/F12,2%B27),添加EGF 20 ng/ml,調整細胞密度為1×105個/ml,接種于25 cm2培養瓶內,在CO2培養箱懸浮培養。以后每3 d半量換液一次,并添加新鮮的EGF。細胞培養5~7 d后形成原代神經球。將原代神經球機械分離制成單細胞懸液,再培養5~7 d形成次代神經球。取次代神經球進行實驗。
1.8免疫組織化學和免疫熒光染色
1.8.1BrdU免疫組織化學 冰凍切片經2 mol/L鹽酸(37℃,30 min) 變性、0.1%胰酶(37℃,20 min)消化后,2%~3%的BSA室溫封閉30 min,棄液后直接加入小鼠抗BrdU單克隆抗體(1∶200)室溫孵育20 h,加入生物素化的羊抗鼠二抗IgG(1∶200),室溫孵育2 h,隨后加入ABC(1∶200)室溫下孵育2 h,最后將切片放入含終濃度為0.03%過氧化氫的0.05%二氨基聯苯胺(DAB)溶液中顯色5~8 min,用磷酸鹽緩沖液(PBS)終止顯色。各步驟間均用0.01 mol/L PBS漂洗3次。常規貼片,風干,乙醇梯度脫水,二甲苯透明,中性樹膠封片。
1.8.2BrdU和DCX或GFAP免疫熒光雙標 冰凍切片同上進行變性、消化、封閉后,同時加入小鼠抗BrdU單克隆抗體(1∶200)和兔抗DCX多克隆抗體(1∶500),室溫下共同孵育20 h,經PBS充分漂洗后同時加入Alexa Fluor 594標記的驢抗小鼠熒光二抗(1∶500)和Alexa Fluor 488標記的驢抗兔熒光二抗(1∶500),避光、室溫下共同孵育2 h,PBS漂洗后用50%緩沖甘油封片,在共聚焦顯微鏡下觀察陽性細胞的表達并拍照。
1.8.3TLR4、Iba1免疫組織化學染色冰凍切片至室溫后放入3%過氧化氫,避光 30 min;PBS清洗后,加兔抗TLR4抗體(1∶200)、羊抗Iba1(1∶1 000)孵育,4℃過夜。次日復溫和清洗3次后加入滴加熒光二抗,室溫避光孵育2 h,封片劑封片。
1.8.4Nestin、TLR4免疫細胞化學染色檢測將次代神經球移至PLL包被的24孔培養板內繼續培養4 h后吸去培養液用4%多聚甲醛固定15 min 0.01 mol/L PBS(pH7.4)漂洗3遍加入1∶2 000的兔抗nestin單抗、兔抗TLR4抗體(1∶200)4℃孵育過夜,漂洗3遍后加入二抗(生物素標記羊抗兔IgG,1∶200),室溫孵育2 h后,漂洗3遍后用DAB顯色,梯度乙醇脫水,二甲苯透明后中性樹脂封片。
1.9統計學方法 采用SPSS20.0軟件進行t檢驗。
2 結 果
2.1LPS對大鼠體重的影響 NS組自給生理鹽水前3 d開始,連續觀察9 d其體重呈直線上升趨勢。LPS組注射LPS 1 d體重突然減輕,第2天馬上恢復至給藥前水平,之后其體重平穩增長,見表1,體重增長曲線與NS組相平行。LPS誘發炎癥7 d,大鼠日均體重生長較NS組低,差異有統計學意義(P<0.05),即大鼠受到LPS刺激后,其生長發育減慢。

表1 腹腔注射LPS對大鼠體重的影響
2.2LPS影響DG區小膠質細胞的形態變化 光學顯微鏡下發現,NS組DG區小膠質Iba1陽性細胞為纖細分支狀,胞體小,具有伸向各個方向的細胞突起;LPS組腹腔注射LPS后第1天DG區小膠質Iba-1陽性細胞數量增多,細胞變為高分支狀,表現為胞體變大,突起及其分支變短且增多、增長增粗,著色最深;隨著誘發炎癥時間的延長,實驗組Iba1陽性細胞數逐漸減少,胞體縮小,突起變短變細,分支減少,著色漸漸變淡。見圖1。

圖1 LPS誘發炎癥影響小膠質細胞的形態變化(免疫組化染色)
2.3LPS對海馬DG顆粒下層(SGZ)區神經前體細胞增殖影響的時程變化 NS組1、3、5、7 d BrdU陽性細胞數目分別為(118.6±8.85)個,(107.4±9.5)個,(105.4±9.3)個,(106.3±11.4)個。LPS組注射后1 d,細胞數減少到(88.7±9.5)個;之后開始漸漸恢復,至第3天為(95.8±6.5)個;5、7 d,陽性細胞數目保持在正常水平為(106.7±6.2)個和(104.3±8.7)個。與NS組相比,LPS組BrdU免疫反應陽性細胞數第1天明顯減少(P<0.05)。見圖2。

圖2 兩組注射后各時間點BrdU陽性細胞(免疫組化染色,×40)
2.4海馬DG顆粒下層BrdU標記的細胞被LPS刺激持續刺激7 d其增殖和分化 注射LPS 2 h后再注射BrdU 7 d,與NS組相比,LPS組BrdU陽性細胞數顯著減少(P<0.05)。見表2、圖3、圖4。

圖3 海馬DG顆粒下層BrdU標記的細胞被LPS持續刺激7d,共聚焦結果顯示DG區BrdU+/DCX+細胞的表達(免疫熒光雙標,×200)

圖4 海馬DG顆粒下層BrdU標記的細胞被LPS持續刺激7 d,共聚焦結果顯示DG區BrdU+/GFAP+細胞的表達(免疫熒光雙標,×200)
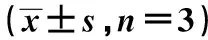
表2 兩組BrdU+細胞及共聚焦結果顯示DG區BrdU+/DCX+細胞及BrdU+/GFAP+細胞的表達
2.5BrdU 和DCX、GFAP的共表達 免疫熒光雙標結果顯示,注射LPS 2 h后再注射BrdU 7 d,海馬顆粒細胞層發現少量BrdU 和DCX、GFAP雙陽性細胞,大多數的BrdU陽性細胞都表達DCX。NS組BrdU和DCX雙標陽性細胞數為(84.8±5.4)%, BrdU和GFAP陽性細胞數為(3.7±0.7)%;LPS組BrdU和DCX雙標陽性細胞數為(86.3±7.1)%,BrdU和GFAP陽性細胞數為(4.1±1.2)%;兩組差異無統計學意義(P>0.05)。
2.6LPS的受體TLR4在神經干細胞/神經前體細胞上的表達 細胞免疫組化和組織免疫熒光的結果顯示,離體培養的海馬神經干細胞和大鼠海馬DG顆粒細胞下層都發現TLR4陽性細胞,見圖5。提示BrdU 陽性細胞數目的減少可能與LPS刺激引起的TLR4信號傳導通路的激活有關。

a:TLR4 在DG的表達(免疫熒光染色);b:神經球Nestin 的表達; c:神經球TLR4表達(免疫細胞化學染色)圖5 TLR4在DG、原代培養神經球的表達(×200)
3 討 論
傳統的觀念認為,中樞神經系統是一個能夠逃離免疫監視的一個特殊區域。然而,近來的研究發現,內源性的NPCs在炎癥反應和促進組織修復的退行性傷害過程中,NPCs調節自身的遷移和分化潛能〔5〕,激活的小膠質細胞提供的炎癥信號和抗原特異性T細胞調控著胚胎CNS區域神經發生和膠質細胞的發生〔6~8〕。
本實驗說明正常情況下,處于靜止狀態的小膠質細胞具有一定的遷移能力,在炎癥激活過程中,小膠質細胞作為定居于大腦中的巨噬細胞,開始改變形態而被激活。在大腦的其他區域如:丘腦、皮層、海馬沒有觀察到小膠質細胞的激活,說明DG區小膠質細胞的激活是特異性的。GFAP在形態和數目上并沒有變化說明LPS并不誘導GFAP的激活,說明小膠質細胞是LPS優先選擇的細胞目標。LPS誘導DG區小膠質細胞形態和數量的改變,說明海馬DG區神經發生的環境已經發生改變。
BrdU 是一種合成性胸腺嘧啶類似物,它能在細胞分裂的DNA 合成期(S 期)有效地摻入DNA 中,使新生細胞可通過BrdU 免疫組織化學染色法顯示。有研究報道,成年大鼠SGZ區神經前體細胞增殖周期為25 h,5、7 d處于有絲分裂后時期〔9〕,本實驗說明,LPS對DG區前體細胞的作用僅僅發生在增殖階段,LPS誘使BrdU陽性細胞數目的減少是急性的,短時間的。一些研究表明外周注射LPS 1 w以內,能夠抑制DG的神經發生〔3,4〕,本研究表明內毒素能誘發快速的抑制效應,LPS注射24 h能顯著抑制BrdU陽性細胞數目,另外注射LPS 2 h后再注射BrdU 7 d,海馬DG顆粒下層BrdU標記的細胞被LPS刺激持續刺激7 d,BrdU陽性細胞數目顯著減少也說明了這一點。這個結果與大鼠和猴一些心理應激的結果是一致的〔10,11〕。也不排除LPS誘導的炎癥導致細胞死亡的可能性,有文獻報道,BrdU陽性細胞的減少可能是因為新生細胞的死亡〔12〕。Bain等〔13〕證實急性應激減少大鼠BrdU陽性細胞數,而相同的應激卻增加小鼠BrdU陽性細胞數。LPS已經被證實能夠產生普遍的應激反應,如發熱〔14〕、腦內細胞因子〔15,16〕的產生、下丘腦-垂體-腎上腺〔17,18〕的激活,下丘腦-垂體-性腺〔17,19〕的抑制,在大鼠和小鼠身上,LPS對BrdU陽性細胞的不同效應說明了LPS對神經發生種屬特異性。
本實驗結果說明,LPS誘導的急性炎癥過程不能改變成年大鼠DG區新生神經前體細胞分化。然而,有研究發現LPS能抑制神經前體細胞向神經元的分化,但不改變其向GFAP分化的命運推測結果不同的原因有:①本實驗僅注射1次BrdU(200 mg/kg),后者連續3次每隔8 h(200 mg/kg)或者8次每隔2 h(50 mg/kg)注射BrdU,海馬神經發生是不斷進行的持續過程,單次進行BrdU標記的細胞只能標記某個時間點的處于細胞分裂周期S期的細胞;多次BrdU標記能將持續進行細胞分裂和增殖的神經前體細胞標記。所以本實驗BrdU陽性細胞數目少于其他研究結果。本實驗結果與其他研究結果不一致可能來源于單次BrdU標記的陽性細胞數太少造成的結果不一致。②在小鼠上,另一方面,注射LPS 7 h內不影響BrdU陽性細胞數目,但是在7 h和28 d后能減少BrdU陽性細胞數〔20〕,本實驗表明LPS誘發炎癥效應在短短2 h內還不足以影響BrdU標記的神經前體細胞的分化走向,LPS誘發炎癥效應對神經發生的抑制效用需要更長時間。也不排除不一致可能與LPS與BrdU在體內攝取效率不同有關。在嚙齒動物成年海馬神經發生區域的NPCs感受入侵的炎癥代理(可能通過TLRs)調節自身的增殖和分化能力是目前研究的熱點之一。了解炎癥發應對NPCs的增殖和分化能力的影響有利于通過細胞移植治療急性或慢性疾病。本實驗結果說明TLR4可能調節著神經干/前體細胞上的神經發生。而在體的實驗也同樣發現在少年期正常大鼠DG區低表達TLR4。
綜上,LPS誘導的炎癥效應能夠抑制神經前體細胞的增殖,但是并不影響新生的神經前體細胞分化。LPS的這種效應可能通過激活TLR4途徑抑制神經前體細胞的增殖。TLRs不僅參與識別廣泛的入侵分子(如細菌、真菌和病原體的微生物產品)同樣監視著損傷和啟動組織修復,可以設想NPCs同樣參與保護大腦免受損傷的信號傳導過程。

