缺氧調控耳蝸聽神經元電壓門控性鉀通道的表達*
馮 爽,劉少鋒,周佳霖,黃振云,羅仁忠,孫昌志
(廣州市婦女兒童醫療中心耳鼻咽喉科,廣東 廣州 510120)
耳蝸缺氧性損傷是新生兒缺氧性腦病常見的并發癥,可引起中到重度感音神經性耳聾。此外,耳蝸組織缺血缺氧,同樣是眾多感音神經性耳聾,如噪音性聾、突發性聾、藥物性聾等的病理生理學機制之一。因此,探索缺氧后耳蝸損傷的機制,對耳聾防治具有重要的臨床治療指導意義。已知聽神經元對缺氧十分敏感,缺氧程度越重,持續時間越長,對聽神經元不可逆的損害越嚴重,聽力恢復也越困難。缺氧后可導致耳蝸螺旋神經節神經元(spiral ganglion neurons,SGN)水腫、壞死,聽神經傳入纖維大量崩解及缺失,損傷SGN。SGN的損傷程度與缺氧時間呈正比[1]。可見SGN是缺氧引起耳蝸損傷的靶器官之一。最近研究還發現,缺氧后可影響聽神經元的興奮性。SGN急性缺氧后,可增強其外向鉀電流,促進鉀離子外流到細胞外,使SGN細胞膜電位超極化,影響聽神經動作電位發放頻率[2]。可見,缺氧可影響聽神經動作電位。缺氧對SGN外向鉀電流的促進過程,主要通過TEA敏感的大電導鈣激活鉀通道電流(BKCa)介導,但對SGN電壓門控性鉀通道(Kv)電流無明顯影響,可能并不作用于Kv電流。然而,在中樞神經缺氧后可影響Kv的表達及功能,而且該作用具有亞型特異性的特點,不同的Kv亞型有不同的表現,如缺氧可增大Kv2.1的電流大小,并使其在神經元的表達定位發生變化,使細胞膜電位超極化而抑制神經元的興奮性;對于Kv4.2和Kv4.3,缺氧后則降低其在神經元的表達,并抑制電流大小,促進細胞膜去極化而增強神經元興奮性[3-5]。目前尚不明確缺氧后對SGN Kv表達的作用特點。已知Kv1.1、Kv1.2和Kv3.1均在SGN表達,可介導聽神經動作電位的產生和傳導,確保維持正常聽力[6]。因此,本研究將探討缺氧后SGN Kv1.1、Kv1.2和Kv3.1表達的特點,明確缺氧對SGN Kv表達的影響。
1 材料與方法
1.1材料 SD大鼠由南方醫科大學動物中心提供,出生后3~5 d,不論雄雌。
1.2方法
1.2.1SGN的原代培養 大鼠斷頭處死后,取出耳蝸,迅速置于4 ℃ Hank′s平衡鹽溶液中,在立體顯微鏡下,打開耳蝸,剝離螺旋韌帶、血管紋及Corti′s器,將螺旋神經節組織切碎,置入0.25%胰蛋白酶中,37 ℃下孵育10 min。吸去胰酶并終止消化,吹打后收集上清液,離心后再棄去上清液,細胞重懸后,種植到裝有預熱好的DMEM/F12+10%FBS培養皿中。培養24 h后,給予缺氧處理。
1.2.2缺氧處理及分組 將載有SGN的培養皿隨機分為對照組和實驗組。對照組置于37 ℃、5%CO2培養箱中培養。實驗組置于缺氧罐內(“無氧環境”下)培養24 h(37 ℃,氣體濃度為95%N2、5%CO2、O2<0.5%)。
1.2.3實時熒光定量聚合酶鏈反應(qPCR) 利用Trizol法分別提取對照組和實驗組細胞的總RNA,隨后將提取到的RNA進行逆轉錄,以ACTB為內參,在PCR儀上進行擴增,ACTB的上游引物序列為5′- TCAGCAAGCAGGAGTACGATG-3′;下游引物序列為5′- GTGTAAAACGCAGCTCAGTAACA-3′,擴增產物為88 bp。Caspase-3上游引物序列為5′- GAGCTTGGAACGCGAAGAAA-3′,下游引物序列為5′-AGTCCATCGACTTGCTTCCA-3′,擴增產物為112 bp。Kv1.1α亞單位的上游引物序列為5′-GCCGCAGCTCCTCTACTATC-3′,下游引物序列為5′-CCTGCCTGTAGTGGGCTATG-3′,擴增產物為84 bp。Kv1.2α亞單位的上游引物序列:5′-AGTGAGAAGATGTGACGGGAC-3′,下游引物序列為5′-GGAGCTGAGGTTCTCTTCCTTG-3′,擴增產物為85 bp。Kv3.1α亞單位的上游引物序列為5′-TACGGACCCTGCTTCCTCTT-3′,下游引物序列為5′-TGCAAAGATCCTTTCTCATTCCT-3′,擴增產物為76 bp。將擴增完畢的cDNA,按照qPCR法進行定量分析,結果重復3次。
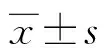
2 結 果
2.1缺氧對caspase-3在SGN表達的影響 原代培養的SGN進行無氧處理24 h后,收集細胞。提取全部RNA后,qPCR結果顯示凋亡執行因子caspase-3 mRNA在SGN的表達出現明顯上調,與對照組相比增加78.3%(n=5,P<0.05),見圖1。

注:aP<0.05。圖1 無氧處理24 h后SGN caspase-3 mRNA表達上調
2.2缺氧對Kv在SGN表達的影響 進一步實驗發現,在無氧環境下,SGN Kv1.1、Kv1.2及Kv3.1α亞單位mRNA表達水平均顯著上調;與對照組相比,其相對表達量分別增加3.71倍(n=5,P<0.05)、3.59倍(n=5,P<0.05)及4.33倍(n=5,P<0.05),見圖2~4。

注:aP<0.05。圖2 無氧處理24 h后SGN Kv1.1 α亞基 mRNA表達上調

注:aP<0.05。圖3 無氧處理24 h后SGN Kv1.2 α亞基 mRNA表達上調

注:aP<0.05。圖4 無氧處理24 h后SGN Kv3.1 α亞基 mRNA表達上調
3 討 論
Kv主要由α和β兩種亞單位構成。關于Kv的分類,曾有多種不同分類方法,但各有缺陷。按照最新的分類方法,根據通道蛋白結構和種系發生特點,將Kv分為3大類38種亞型[7]。在中樞神經系統,神經元對缺氧十分敏感。當出現缺氧后,神經元出現短暫的超極化后,神經元迅速顯著地去極化,并伴隨鈣離子內流,從而使神經元過度興奮,加重缺氧引起的神經元損傷。有研究發現,缺氧后出現短暫超極化,主要是由于缺氧早期后,大量消耗ATP,對ATP十分敏感的ATP敏感型鉀通道開放,鉀離子外流,細胞膜超極化,這可能有助于防止神經元過度興奮而損傷。然而,隨著缺氧的持續,神經元逐漸去極化,出現興奮毒性作用,此過程較為復雜,主要包括兩方面,抑制Kv,減少鉀離子外流,以及促進鈉離子通過電壓門控性鈉通道或其他離子通道大量內流。如在海馬神經元,缺氧后可使Kv2.1發生快速可逆的磷酸化反應,鉀離子外流減少,使NMDA受體出現過度興奮,介導以鈣離子及鈉離子內流為主要特征的興奮毒性作用。因此,有觀點認為,激活Kv有助于防止缺氧后對神經元造成的興奮毒性損傷。研究發現,氟吡啶作為Kv通道開放劑,可減輕缺氧導致的神經組織損傷,部分恢復由缺氧引起的學習及記憶能力受損[8]。然而,另有研究發現,缺氧后可使有活性的Kv離子通道增加,電流密度增加[9]。可見在不同部位神經元,缺氧后Kv的表現差異較大。
現已發現所有Kv的亞型均在SGN上表達,其中Kv1.1、Kv1.2和Kv3.1在SGN是高表達,主要定位于基底回[6]。Kv1.1、Kv1.2主要介導低電壓激活的外向鉀電流,具有快速激活、快速失活的特點,使細胞膜電位保持在接近動作電位閾值的狀態,有助于聽神經元高頻放電[10]。Kv3.1是介導延時整流外向電流的主要成分,有助于SGN膜電位快速復極化,有利于動作電位的產生,因此也是確保聽神經元高頻放電的重要因素[11]。因此,Kv1.1、Kv1.2和Kv3.1在基底回高表達的原因,可能是有利于此處SGN易于高頻放電的原因。在本研究中,SGN處于無氧環境下處理24 h后,Kv1.1、Kv1.2和Kv3.1α亞單位mRNA表達均顯著上調,說明長時間嚴重缺氧,可上調Kv1.1、Kv1.2和Kv3.1在SGN的表達。由此可推測,增加神經元放電頻率,將影響聽神經動作電位的傳導,這可能是其引起聽力下降的機制之一。
然而,本研究結果與既往文獻報道的結果不同。有研究發現,急性缺氧(無氧處理5~15 min)后SGN的TEA敏感的BKCa電流大小增加,而4-AP敏感的Kv則無明顯改變,因此認為介導缺氧對外向鉀通道電流作用的主要是BKCa,認為Kv可能不參與此過程[2]。結合本研究結果,分析產生差異的原因,可能與缺氧處理時間不同有關。在本研究中,SGN持續處于無氧環境下24 h,屬于長期嚴重缺氧;而文獻報道的無氧狀態最長僅維持15 min,屬于短期急性缺氧。缺氧時間的不同,可能對SGN不同類型鉀通道有不同的作用。推測在缺氧早期,主要影響SGN BKCa的功能,隨著缺氧持續時間的延長,可能進一步影響Kv的表達,共同促使細胞膜電位超極化,抑制SGN放電,影響聽覺動作電位。
本研究還發現,缺氧后可以增加caspase-3的表達,這說明缺氧可促進SGN凋亡過程,導致SGN損傷。既往有研究發現,Kv與凋亡過程有關。如通過調控細胞膜表面Kv1.1及Kv1.3的表達及其電生理學特性,增加開放頻率,促進鉀離子外流,使胞質鉀離子濃度降低,細胞內容量降低,細胞皺褶,引起細胞凋亡過程[12]。另有研究也發現,敲除Kv1.1在細胞的表達,可增加抑制-Bcl的表達;而敲除Kv1.3,則減少caspase-3和促凋亡因子Bad的表達。可見在凋亡過程中,Kv可影響caspase-3等凋亡相關因子的表達,從而影響凋亡過程[13]。因此,推測缺氧后SGN Kv1.1、Kv1.2和Kv3.1表達增加,增加鉀離子外流,可能引發caspase-3介導的細胞凋亡過程,加重SGN的損傷,這有待進一步研究證實。

