植物長鏈非編碼RNA調控發育與脅迫應答的研究進展
李建建 賀宸靖 黃小平 向太和
(1.杭州師范大學哈爾科夫學院,杭州 311121;2.杭州師范大學生命與環境科學學院,杭州 311121)
全基因組和轉錄組分析表明,超過75%的人類基因組和50%的擬南芥基因組轉錄成RNA;其中,mRNAs 僅占約1.5%,更多的是缺乏蛋白質翻譯潛力的非編碼RNAs(non-coding RNAs,ncRNAs)。非編碼RNAs 包括管家ncRNAs(rRNAs,tRNAs,snRNAs 和snoRNAs)和調控ncRNAs;早期研究更多關注在真核生物轉錄和轉錄后調控方面發揮功能的microRNAs 和小干擾RNAs[1-2]。但是,近期研究鑒定了越來越多的長鏈非編碼RNAs(long noncoding RNAs,lncRNAs),其在調控真核生物的生長發育過程發揮重要作用[3]。
由于lncRNAs 表達水平和保守性低,一度被認為是轉錄副產物。伴隨高通量測序技術的快速發展,傳統中心法則和基因調控理論受到前所未有的挑戰,許多具有關鍵調控功能的lncRNAs 被鑒定。相對動物lncRNAs,植物lncRNAs 的研究仍處于探索階段。本文主要針對植物lncRNAs 的來源及分類、作用機制、植物中已鑒定的lncRNAs 及其生物學功能進行綜述,為lncRNAs 在作物生產育種中的應用研究提供參考。
1 lncRNAs 的來源及分類
與蛋白編碼基因mRNAs 一樣,大多數lncRNAs具有5'-帽子、3'-poly(A)尾巴和選擇性剪接位點等結構。另外,lncRNAs 主要被RNA 聚合酶Pol II轉錄,少數也可由RNA Pol IV 和Ⅴ轉錄產生。但是,目前對于lncRNAs 的起源尚無明確定論,其可能的來源主要有以下5 種:(1)蛋白編碼基因在轉錄過程中結構發生中斷形成lncRNA;(2)非編碼基因在復制過程發生反移位形成lncRNA;(3)在染色質重組過程中,未轉錄基因與其他獨立基因形成串聯,產生lncRNA;(4)在基因組序列中插入轉座子形成lncRNA;(5)局部復制子結構發生串聯產生lncRNA。
根據lncRNA 與蛋白編碼基因的相對位置,可以將lncRNA 分為5 類,包括正義lncRNA(sense lncRNA)、反義lncRNA(antisense lncRNA)、基因間lncRNA(intergenic lncRNA)、內含子lncRNA(intronic lncRNA)和雙向lncRNA(bidirectional lnc-RNA)[2]。
2 lncRNAs 的作用機制
大多數lncRNA 沒有蛋白質編碼能力,但有些lncRNA 具有小的開放閱讀框,能夠編碼短肽。另外,lncRNA 可以通過調控基因轉錄、組蛋白修飾、RNA加工、以及與小RNA 作用發揮功能。有文獻報道lncRNA 主要以信號分子、誘餌分子、引導分子和支架分子4 種形式參與生物學過程(圖1)[4]。
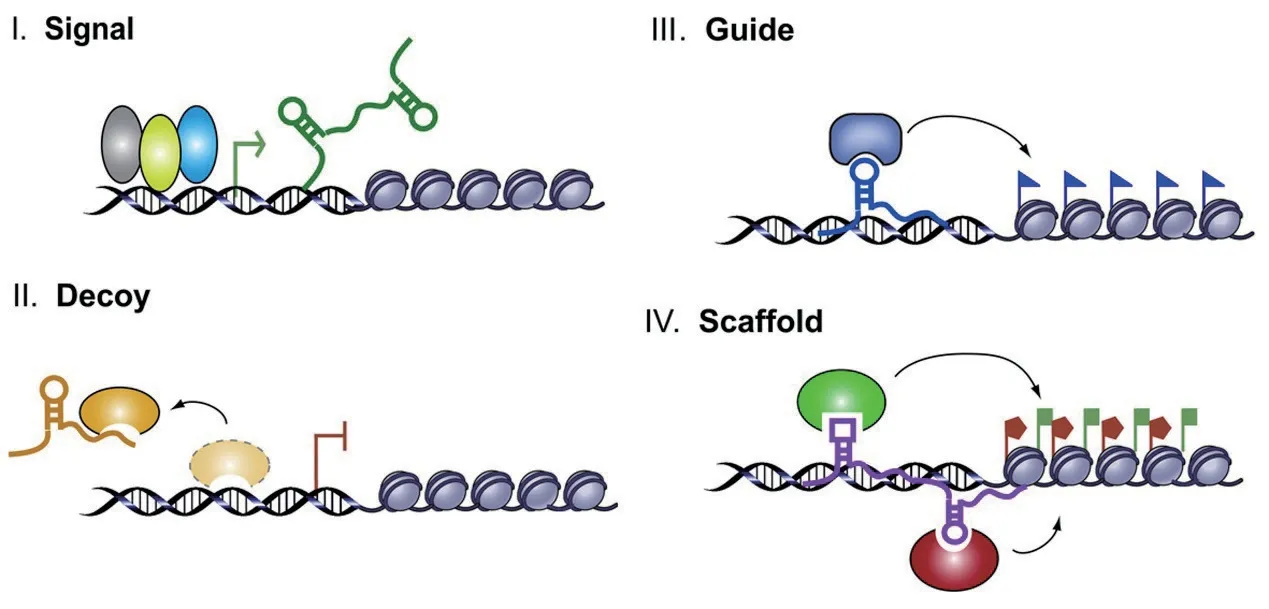
圖1 lncRNA 四種作用機制示意圖Fig.1 Schematic diagram of the four archetypes of lncRNA mechanism
在春化作用研究中,開花基因FLC的表達受lncRNA(COOLAIR和COLDAIR) 的調控,而COLDAIR的表達變化影響擬南芥應答春化[5];另外,有研究報道了一個光敏育性相關lncRNALDMAR,其序列產生C-G 的單堿基突變導致其表達水平降低,花藥PCD 提前,造成光敏雄性不育[6],表明lncRNA 是植物生長發育的一個信號標志。
LncRNA 作為誘餌分子競爭性結合RNA 結合蛋白調控目的基因的表達[4]。此外,lncRNA 作為miRNA 的偽靶標基因與miRNA 相互作用調控靶基因的表達[7]。擬南芥lncRNAIPS1競爭性結合miRNA399 造成其靶基因PHO2大量積累,降低特異性磷轉運基因Pht1;8和Pht1;9的表達,導致根部對磷吸收減少[8]。
LncRNA 作為引導分子指導核糖核蛋白復合體定位在特定位點。LncRNA 通過cis-/trans-調控基因表達。研究表明苜蓿根瘤基因Enod40編碼的lncRNA 能直接與MtRBP1 蛋白結合,參與MtRBP1從細胞核至細胞質中的定位過程[9]。
除了上述3 種作用形式之外,lncRNA 還可以作為骨架分子結合不同蛋白質或者轉錄因子形成蛋白復合體,調控基因上下游效應元件從而激活或者抑制基因轉錄。比如,植物lncRNA 與AGO4 蛋白互相作用,指導siRNA-AGO4 復合體轉移至相關染色質目的位點進行RNA 介導的DNA 甲基化。這類lncRNA 功能復雜,尚不清楚這些骨架復合體如何實現組織和調控。
3 植物lncRNAs 的功能
3.1 lncRNAs調控植物營養器官發育
根、莖、葉等營養器官參與維持植物生命活動。有研究報道,楊樹Lnc12和LncWOX11調控相關mRNAs 的表達從而抑制楊樹不定根的形成與發育[10]。在擬南芥中,lncRNAENOD40或lnc351與核斑RNA 結合蛋白AtNSRs 結合,調控NSR 對下游生長素應答基因的可變剪接,參與側根發育[11]。另外,在大豆[12]、水稻[13]、苜蓿[14-15]中均鑒定了一種與根瘤特異性表達和共生固氮根瘤形成有關的lncRNAENOD40。
與同期野生型棉花相比,過表達靶基因whole_GLEAN_10025325植株的纖維細胞含量減少,韌皮纖維明顯增多;將lncRNALTCONS_00034183及其靶基因共轉化發現,轉基因植株纖維細胞含量減少,纖維含量減少[16]。有研究分析不同發育時期棉花纖維轉錄組數據鑒定了5 個優勢表達lncRNAs,其中lncRNAGhir_A01G011040-RNAi 轉基因株系的纖維顯著變短[17]。另外,Zhao 等[18]發現異源四倍體棉花A 亞基因組中lncRNAXLOC_409583在多倍體化后被激活并參與調控棉花株高。
在紅苞鳳梨中,lncRNAlncABCG11順式調控PORB的表達調控葉色[19]。Wang 等[20]鑒定了一個持續紅光條件下促進擬南芥光形態發生的lncRNAHID1,其能和抑制光形態的光敏色素互作因子PIF3相互作用;在hid1突變體中HID1敲低表達導致PIF3顯著上調表達,促進下胚軸的伸長發育。另外,Liu 等[21]鑒定了一種由R2R3 MYB轉錄因子OsMYB60反義鏈轉錄產生的反義lncRNATWISTED LEAF(TL),TL-RNAi 株系和過表達OsMYB60轉基因株系葉片扭曲,在TL-RNAi 轉基因株系中OsMYB60顯著上調表達,表明反義lncRNATL順式調控OsMYB60參與葉形態發育。植物營養器官的正常發育被認為是轉向生殖發育的基礎,上述研究揭示了lncRNAs 調控植物營養器官的重要作用。
3.2 lncRNAs調控植物生殖器官發育
3.2.1 lncRNAs 調控植物開花 成花轉變是植物生殖發育的一個重要環節,受到包括春化作用在內的多種途徑調控。在春化過程中,開花抑制因子FLC 的表達受表觀遺傳學負向調控,促進FLC上H3K4me3 去組蛋白修飾和H3K27me3 組蛋白修飾,抑制FLC 的表達,解除其對下游開花基因的抑制作用實現開花轉變[22]。研究證實,3 個擬南芥lncRNAs(COOLAIR、COLDAIR、COLDWRAP)均能調控FLC的表達參與開花[5,23-24]。
Zhao 等[3]鑒定了一個自然反義長鏈非編碼RNAMAS,其轉錄于FLC家族成員基因MAF4的反義鏈;相較于野生型,轉基因株系maf4-1及amiRMAS-1/2均提前開花。在擬南芥中,編碼核外泌體組分的兩個基因AtRRP6L1和AtRRP6L2突變導致關鍵開花抑制因子FLC去阻遏,促使早開花生態型擬南芥延遲開花;此外,AtRRP6L 蛋白質影響lncRNAASL的表達進而負調控FLC,影響植物開花進程[25]。全基因組分析鑒定了14 個擬南芥反義lncRNAs,其中lncRNA npc48 過表達轉基因株系開花推遲[26]。Henriques 等[27]鑒定了CDF5的天然反義轉錄本lncRNAFLORE;其中,CDF5 蛋白直接抑制FT基因的轉錄從而延遲開花,FLORE通過抑制CDF1、CDF3和CDF5等幾個基因和增加FT的轉錄促進開花。
在六倍體小麥中,一個轉錄自TaVRN1正義鏈的lncRNAVAS過表達轉基因冬小麥提前開花[28]。開花是高等植物由營養生長向生殖生長轉換的一個關鍵過程,上述研究暗示lncRNA 在植物開花方面的重要性。
3.2.2 lncRNAs 調控有性生殖及花粉發育 花粉發育是植物生殖發育過程中至關重要的部分。Fan 等[29]鑒定了一個光敏不育性位點Pms1編碼一個優先在水稻幼穗中表達的lncRNAPMS1T,其與miR2118結合產生一個長日照條件下優先在光敏雄性不育水稻積累的21 nt phasiRNAs,進而參與水稻生殖發育。另外,LDMAR次級結構的改變會增強LDMAR啟動子區域甲基化修飾水平,導致LDMAR的轉錄顯著受阻,最終造成花藥過早程序性細胞死亡,形成光敏雄性不育[6]。Zhang 等[30]對水稻花藥、雌蕊和授粉后5 d 的種子進行高通量測序,鑒定了多個水稻生殖相關的lncRNAs;其中lncRNAXLOC_057324突變體開花提前,育性顯著降低。
Song 等[31-32]發現lncRNABcMF11表達水平降低造成異常的花粉發育,包括絨氈層降解、小孢子非同步分離及花粉粒的異常發育,最終導致敗育表型。在菜心研究中,過表達lncRNABrLMaP導致花粉發育異常[33]。Huang 等[34]對5 個發育階段的油菜進行RNA-Seq 分析,鑒定了12 051 個lncRNAs;其中lncRNAsbra-eTM160-1和bra-eTM160-2是bramiR160-5p的潛在eTM,其過表達轉基因株系花器官外表正常,但花藥內一半花粉粒小且皺縮,沒有育性、無細胞核及花粉內壁缺失。
在玉米花藥中,敲低lncRNAZm401顯著影響與花粉發育相關基因(ZmMADS2、MZm3-3和ZmC5)的表達,導致小孢子和絨毛層的發育異常,最終造成玉米雄性不育[35]。上述研究結果表明,現已研究的lncRNAs 與植物有性生殖密切相關,相信進一步的研究將發現更多調控植物生殖的lncRNA。
3.2.3 lncRNAs 調控植物成熟與衰老 除了參與花粉發育,lncRNA 也調控植物果實成熟與衰老。Li 等[36]采用CRISPR-Cas9 技術敲除lncRNA1459導致西紅柿果實成熟進程受到抑制,乙烯和番茄紅素的產生受抑制,大量乙烯和類胡蘿卜素相關基因表達水平降低,果實成熟相關基因表達水平顯著性改變。此外,研究報道西紅柿lncRNA1840沉默株系的果實明顯延遲成熟[37]。
眾所周知,水稻高產和早熟是一對影響水稻產量提高的重要矛盾。Fang 等[38]鑒定了一個OsSOC1基因的長非編碼RNA 反義轉錄本Ef-cd;實驗結果表明Ef-cd能夠促進氮利用及提高光合作用速率,進而參與調控水稻成熟。另外,Wang 等[39]從一個水稻產量性狀相關基因簇LRK 上游鑒定了一個反義lncRNALAIR;水稻LAIR過表達引起LRK基因簇部分基因的轉錄上調,改變LRK1基因組位點的組蛋白修飾狀態,導致水稻增產。
田蕓蕓[40]對河套密瓜4 個發育時期的中果皮進行轉錄組測序,鑒定了1 601 個差異表達lncRNAs;其中LNC-003610超表達株系的成熟天數較對照組推遲約7 d,表明LNC-003610是果實成熟的負調控因子。
有研究報道,lncRNA 作為一類新型非編碼RNA,其競爭性結合miRNA 和circRNA,進而調控mRNA 的表達水平。本課題組前期全基因組研究鑒定了水稻葉衰老非編碼lncRNAs 及其共表達靶基因mRNAs;探明衰老相關lncRNAs 既可通過調控其靶基因發揮功能也可通過競爭內源性RNA 網絡調控mRNAs 發揮功能;采用過表達和CRISPR-Cas9 技術的轉基因功能驗證實驗已完成,功能機制被進一步闡明[41]。
3.2.4 lncRNAs 調控種子及胚乳發育 種子休眠是植物生命循環中最關鍵的過渡時期之一,該時期受DOG1基因控制。Fedak 等[42]鑒定了一個反義lncRNADOG1,命名為asDOG1;在種子成熟階段,asDOG1順式負調控種子休眠導致DOG1等位基因特異性抑制并促進萌發。
此外,中山大學陳月琴團隊鑒定了一個母本來源、調控胚乳發育的lncRNAMISSEN;功能研究顯示,超表達MISSEN 導致合胞體階段游離胚乳細胞核數目減少、聚集以及后續細胞化受阻;而MISSENRNAi 導致胚乳細胞化的進程更快,導致種子出現明顯的“大肚子”表型[43],表明lncRNA 在胚乳發育過程發揮重要作用。
3.3 lncRNAs應答植物非生物脅迫
3.3.1 lncRNAs 應答植物鹽脅迫 植物在整個生命周期會遭受眾多不利的環境,包括鹽脅迫、干旱脅迫、低溫脅迫、營養脅迫等過程。在磷缺乏條件下,采用RNAi 技術敲低cis-NATPHO1;2表達導致PHO1;2 蛋白減少,損害磷酸鹽從根部向地上部的運輸,導致種子產量減少;相反,在磷供應充足條件下,trans-NATPHO1;2組成型過表達導致PHO1;2表達水平顯著增加;上述結果表明cis-NATPHO1;2在促進PHO1;2 蛋白翻譯、維持磷酸鹽穩態及植物健康方面發揮重要作用[44]。lncRNAMt4是苜蓿中最早被鑒定的磷酸鹽饑餓誘導基因,該基因在Pi 饑餓期間在根中下調表達[45-46]。在低磷脅迫下,擬南芥中的lncRNAIPS1充當miR399的靶標,競爭性結合miR399,增加miR399 靶基因PHO2的表達,維持植株在低磷狀態下的生長[8]。與IPS1一樣,AT4過度表達導致Pi 積累減少,同時IPS1和AT4過度表達均顯著抑制了miR-399對PHO2的切割,表明IPS1和AT4通過抑制miR-399的活性維持磷酸鹽穩態[8]。與野生型相比,過表達npc536擬南芥轉基因株系在鹽脅迫條件下促進根系生長[26]。
Zhang 等[47]發現過表達lncRNA973的擬南芥種子萌發率提高、鮮重增加、根長增加;采用病毒誘導的基因沉默技術敲低lncRNA973的轉基因株系葉片枯萎、黃化。此外,Liu 等[48]鑒定了一個擬南芥lncRNAT5120,過量表達T5120轉基因擬南芥促進硝酸鹽應答、增強硝酸鹽同化、提高生物量和根系發育;T5120可部分恢復硝酸鹽調節轉錄因子NLP7突變株的硝酸鹽信號和同化表型;上述結果表明T5120參與調控硝酸鹽脅迫響應。
在鹽脅迫條件下,過表達lncRNAThSAIR6顯著減輕檉柳細胞的受損程度,增強POD 和SOD 酶活性,降低植株體內H2O2和O2-的含量,提高活性氧的清除能力,有效提高剛毛檉柳的耐鹽性[49]。除此之外,過表達lncRNAThSAIR1-5轉基因株系同樣提高剛毛檉柳的耐鹽性[50]。總之,一定程度的鹽脅迫會引起滲透脅迫和次生氧化脅迫,導致植物養分失衡及抑制植物生長,表明lncRNAs 在鹽脅迫方面的作用至關重要。
3.3.2 lncRNAs 應答植物溫度脅迫 溫度是影響植物生長發育的最重要的環境因子之一,溫度的細微變化能極大地影響植物的生長和發育。
研究發現,超表達lncRNAHAL6擬南芥的萌發率和存活率顯著高于野生型,顯著增強高溫脅迫抗性;反之,RNAi 株系對高溫脅迫敏感,表明lncRNAHAL6參與調控植物高溫脅迫[51]。在擬南芥中,熱激轉錄因子HSFB2a過表達降低反義lncRNAasHSFB2表達水平,導致生殖發育階段的擬南芥生物量提高;反之,asHSFB2過表達抑制HSFB2a表達,導致生物量降低[52]。除此之外,在擬南芥基因組冷敏感區域鑒定了一個lncRNASVALKA,過表達SVALKA抑制CBF1表達調控植物的耐寒性[53],這些研究揭示了lncRNAs 在溫度脅迫響應過程的重要作用。
3.3.3 lncRNAs 應答植物干旱脅迫 水分缺失是植物生長的主要限制因素之一。植物遭受干旱脅迫時,消耗量大于吸收量,植物細胞內水勢和膨壓降低,導致葉片凋萎,甚至植株死亡。
與野生型擬南芥相比,lincRNA13853功能缺失突變體對外源ABA 的敏感性減弱、耐旱性降低、失水率加快及氣孔孔徑比增大;過表達lincRNA13853植株的氣孔孔徑比減小;上述結果表明lincRNA可能通過調節氣孔形態影響蒸騰速率,最終改變植物的耐旱性[54]。擬南芥過表達轉基因株系At5NC056820-3、At5NC056820-7和At5NC056820-8在干旱脅迫下長勢更好,游離脯氨酸含量是野生型的2-2.5 倍;表明lncRNAAt5NC056820在一定程度上可以提高擬南芥的耐旱性[55]。擬南芥lncRNADRIR在非脅迫條件下表達水平很低,在干旱脅迫下被顯著激活;過表達lncRNADRIR轉基因株系提高干旱脅迫抗性[56]。這些研究表明,lncRNAs 在植物對干旱脅迫的響應中起著不可忽視的作用。
3.3.4 lncRNAs 應答植物其他非生物脅迫 除了鹽脅迫、高/低溫脅迫和干旱脅迫外,植物lncRNAs還參與了其他影響生長發育的脅迫應答。Sun 等[57]鑒定了一個受Fe 缺乏誘導表達的蘋果lncRNAMSTRG.85814;其正向促進SAUR32的表達并激活質子分泌以應答Fe 缺乏。
Wu 等[58]發現AtR8響應低氧脅迫和水楊酸脅迫;在低氧脅迫下,AtR8表達量降低,而在水楊酸脅迫下表達量升高。進一步的研究表明,在擬南芥atr8突變體中,低濃度SA 導致根長顯著變短[59]。
植物激素赤霉素在植物體內發揮重要的生長調節作用。王亞麗[60]鑒定了一個赤霉素響應lncRNAGARR2,采用CRISPR-Cas9 技術獲得的轉基因株系較野生型株高和第二葉鞘長極顯著增加,籽粒長和籽粒寬極顯著降低。
在真核生物基因組中,轉座子元件(transposable elements,TEs)廣泛存在。有研究報道擬南芥TElincRNA 11195突變體對ABA 敏感性降低,具有更長的根系及更高的地上部生物量[61]。
另外,擬南芥APOLO-RNAi 轉基因株系表現為延遲的向地性響應,在不影響側根密度條件下有更長的根系[62]。
3.4 lncRNAs應答植物生物脅迫
植物除了受到非生物脅迫,而且還會受到生物脅迫的作用,包括細菌、真菌、病毒和害蟲的侵害。
有研究報道,過表達lncRNA16397 和SIGRX的轉基因番茄在感染馬鈴薯晚疫病(Phytophthora infestans,P.infestans)后的癥狀和活性氧積累均較野生型更輕、更低,表現為對P.infestans增強的抗性[63]。過表達lncRNA23468的轉基因番茄中miR482b 表達水平顯著降低,miR482b 靶基因NBSLRRs顯著上調表達,導致對P.infestans抗性增強;反之,沉默lncRNA23468轉基因番茄的抗性減弱[64]。經啟動子-β-GUS 融合和酵母單雜交試驗證明lncRNA33732能與WRKY1 啟動子元件相互作用,激活lncRNA33732的表達;lncRNA33732過表達和沉默的轉基因株系誘導RBOH基因的表達,增加H2O2的積累,導致對P.infestans抗性增強;當RBOH基因表達受到抑制時,H2O2積累降低,對病原菌的抗性減弱[65]。過表達lncRNA39026轉基因番茄表現的增強P.infestans抗性;相反,沉默lncRNA39026的轉基因株系抗性減弱[66]。
番茄黃化曲葉病毒(TYLCV)是一種通過煙粉虱快速傳播的毀滅性番茄病害。Wang 等[67]鑒定了一個番茄lncRNAS-slylnc0957,其沉默導致敏感番茄植株對TYLCV 的抗性增強。此外,番茄lncRNASILNR1不僅影響番茄葉片發育,而且在番茄TYLCV感染期間,與TYLCV 的非編碼基因間區衍生的病毒小干擾RNA 相互作用,從而調控疾病防御[68]。
另外,Yu 等[69]用增強子系統構建的T-DNA 插入株系表現增強的白葉枯抗性。Zhu 等[70]用尖孢鐮刀菌侵染擬南芥,發現lncRNATAR-197轉基因株系發病更早且癥狀更嚴重,TAR-212轉基因株系表現增強的疾病防御抗性。植物免疫應答是一個涉及基因表達轉錄和轉錄后調控的復雜過程。Seo 等[71]采用人工miRNA 技術敲低lncRNAELENA1,發現其轉基因株系表現為PR1 下調表達及對番茄DC3000細菌病原體丁香假單胞菌更敏感;相反,過表達ELENA1的轉基因株系表現為PR1 表達水平上調及增強的病原菌抗性。
Gao 等[72]發現皺縮病毒侵染lincRNALINCAP2過表達植株后其靶基因AP2 下調表達,發病癥狀更嚴重,包括花結構變形。Zhang 等[73]鑒定了兩個棉花lncRNAsGhlncNAT-ANX2和GhlncNAT-RLP7,沉默轉基因幼苗表現為增強的黃萎病和灰霉病抗性。總之,作為植物防御機制的一部分,lncRNAs 在植物病原體等生物響應方面發揮重要作用。
本文綜述了植物lncRNAs 發揮的主要生物學功能并總結了轉基因功能驗證的lncRNAs(表1)。

表1 參與植物發育和脅迫應答的已功能驗證的lncRNAsTable 1 Functional validated lncRNAs involving in plant development and stress response
4 展望
隨著高通量測序技術和生物信息學的快速發展,越來越多的植物和動物lncRNA 被廣泛鑒定。相較于早期研究,lncRNA 并不被認為是轉錄副產物,而是能在表觀遺傳、轉錄調控及轉錄后調控等層面參與基因表達調控的重要基因組分。眾所周知,lncRNA 參與了大量生物學過程,包括生長發育、脅迫、免疫反應、疾病防御等。然而,與mRNA 相關的數據庫相比,lncRNA 植物相關數據庫及其注釋還不夠完全,對其進行深入分析的難度較大;除此之外,lncRNA 的研究還存在一些問題:比如,lncRNA 作用機制復雜;許多lncRNA 的生物學功能無法闡明;非編碼轉錄產物是否有功能依然無法判斷等。
為了更好闡明lncRNA 的生物學功能和作用機制,可以從以下思路入手:采用納米孔測序技術獲得lncRNA 全長、通過單細胞轉錄組和表觀遺傳組建立lncRNA 與染色質之間的聯系、對lncRNA 靶基因進行預測并進行功能驗證;目前,采用過表達和CRISPR/Cas9 技術對lncRNA 及其靶基因的功能驗證仍顯不足,尤其是在植物中的研究。
除此之外,對lncRNA 的報道主要集中在分子機制的研究中,在育種方面鮮見報道。探索lncRNAs 對植物生長發育影響的分子機制的成熟,lncRNA 有望在農業育種、種質創新及品質改良方面發揮重要作用。

