植物多基因干擾載體體系構建與效用分析
周家燕 鄒建 陳衛英 吳一超 陳奚潼 王倩 曾文靜 胡楠 楊軍
(1.西華師范大學生命科學學院 西南野生動植物資源保護教育部重點實驗室,南充 637002;2.安陽工學院生物與食品工程學院,安陽 455000)
生物體的生長、發育以及衰老等生命活動受到眾多基因的調控。然而,調控這些生理生化過程的基因大多屬于多基因家族成員,在調控同一生理生化過程中,部分基因之間存在明顯的功能冗余。MADS-box 家族中的SEPALLATA(SEP)基因在花瓣、雄蕊、心皮發育中具有決定作用[1]。然而,擬南芥中的SEP基因,包括SEP1(AGL2)、SEP2(AGL4)、SEP3(AGL9)和SEP4(AGL3),其發生單突變或雙突變不會引起明顯的表型變化,而sep1/sep2/sep3三突變體則會喪失花器官發育的確定性,導致所有花器官轉變為萼片,在sep1/sep2/sep3/sep4四突變體中,不定花序的萼片被葉片所替代[2-3]。同時,Yoshida等[4]發現擬南芥AHG3(AtPP2CA)和ABI1均編碼蛋白磷酸酶2C(PP2C)蛋白,并參與ABA 信號的調節。然而擬南芥ahg3-1和abi1-1單突變體均表現出ABA 不敏感特性,而雙突變體ahg3-1/abi1-1的ABA 敏感性顯著強于其單突變體[4-5]。說明MADSbox 和PP2C 等多基因家族中成員基因在調節相關生理生化過程中存在功能冗余[6-8]。在這種情況下,單個的基因突變或者敲除往往難以觀察到相應的性狀,故不利于研究這些基因的生物學功能。
在研究多基因家族成員的基因功能時,往往需要利用單突變體并通過遺傳雜交構建雙突變或多突變體的方式來實現多基因功能研究。然而,這個過程復雜且周期較長,需要耗費大量的人力和物力,同時還受到突變體資源的嚴重限制。目前,研究人員主要通過各種正向遺傳學(forward genetics)和反向遺傳學(reverse genetics)手段解析植物的基因功能,RNAi 技術則是其中最為重要的技術手段之一[9]。RNAi 技術能有效地實現基因沉默,通過抑制基因表達水平來探究目標基因的功能。該技術具有高效性、特異性和可遺傳等特點,因而廣泛應用于植物基因功能研究[10-14]。然而,傳統的RNAi 體系一般只能使1-2 個基因沉默[15],很難讓多個基因同時沉默。雖然,有研究報道通過保守區廣泛脫靶來實現多基因干擾沉默,但是其特異性不強,而且靶向目標具有隨機性和不確定性[16-18]。因此,構建靶向精準、高效和可控的多基因RNAi 體系,對于同時研究多基因功能,尤其是研究基因間的功能冗余和協同互作具有重要意義。
為了構建有效多基因的干擾體系,本文對載體pCAMBIA1301 進行改造,構建了有效的多基因干擾體系pCAMBIA1301m 和pCAMBIA1301s 載體。A 組PP2C 成員是ABA 信號的負調控因子,成員之間在調控ABA 信號轉導過程中存在功能的冗余[4,8]。因此本文選取系統發育關系較為接近的PP2C 家族A組4 個基因,包括Solyc03g121880.2.1(SlPP2C1)、Solyc12g096020.1.1(SlPP2C2)、Solyc08g062650.2.1(SlPP2C3)和Solyc07g040990.2.1(SlPP2C4),作為分析對象,利用本文構建的多基因干擾體系,構建出四基因干擾載體。再通過遺傳轉化導入番茄中,獲得了四基因干擾的轉基因番茄植株,并分析了目標基因的干擾效率和轉基因番茄種子對ABA 的敏感性,證明本文開發的多基因干擾體系的有效性。本文為靶向精準、高效和可控的多基因RNAi 提供重要工具和技術體系,對于同時研究多基因功能,尤其是研究基因間的功能冗余和協同互作具有重要意義。
1 材料與方法
1.1 材料
本文使用pCAMBIA1301 載體作為構建多基因干擾載體體系的原始載體。使用Micro-Tom 番茄(Solanum lycopersicumcv.Micro-Tom)作為遺傳轉化材料,用于多基因RNAi 體系的效用分析。實驗材料均種植在溫度(25±2)℃,光強7 000 Lux,相對濕度80%,光周期14 h/10 h(晝/夜)的溫室中。
1.2 方法
1.2.1 構建多基因干擾體系 本文對pCAMBIA1301載體的多克隆位點(multiple clone site,MCS)區域進行改造,構建多基因干擾體系pCAMBIA1301m 和pCAMBIA1301s。具體構建步驟如下:
(1)pCAMBIA1301m 的構建。首先設計一個包含CaMV 35s 啟動子,PDK 內含子和NOS 終止子的表達盒,并命名為RNAi-E-cassette。表達盒中設置3 個MCS,其中MCS1 位于CaMV 35s 啟動子和PDK內含子之間,含4 個限制性位點Hind III、XbaI、SalI 和PstI;MCS2 位于PDK 內含子和NOS 終止子之間,含5 個限制性位點KpnI、XmaI、Eco53k I、SmaI 和SacI;MCS3 位于CaMV 35s 啟動子5'端上游,含6 個限制位點SpeI、HpaI、StuI、EcoR I、ApaI和AscI。同時,對pCAMBIA1301 載體中T-DNA 區域內的潮霉素抗性基因,用限制性酶AatII 和PspXI酶切去除,替換成卡拉霉素抗性基因。
接下來,在RNAi-E-cassette 表達盒MCS3 和NOS 終止子的3'端下游分別添加限制性位點SwaI和BamH I,將RNAi-E-cassette 改造成RNAi-E-cassette-E。并在RNAi-E-cassette-E 的上游5'端添加一段與pCAMBIA1301 同源的30 bp 序列ACACAGGAAACAGCTATGACCATGATTACG,在其下游3'端添加另一段30 bp 序列AGCTTGGCACTGGCCGTCGTTTTACAACGT,形成一個新的表達盒片段,將其命名為RNAi-E-cassette-E2。
由于原始載體pCAMBIA1301 上隱藏的限制性位點SmaI 可能會影響表達盒的使用。為了去除SmaI 限制性位點,通過人工合成pCAMBIA1301 載體上9 941-10 800 的核酸片段(5'存在AatII 位點GACGTC,3' 存在BstXI 位點CCANNNNNNTGG),將其中9 985 位置的堿基G(位于SmaI 識別位點內)替換為C,并將其命名為Fragment-Delete-SmaI。隨后,利用限制性內切酶AatII 和BstXI 酶切除原始pCAMBIA1301 載體上的相應序列,用Fragment-Delete-SmaI 片段替換,將新載體命名為pCAMBIA1301-Delete-SmaI。之后用限制性酶內切酶EcoR I 和Hind III 切除pCAMBIA1301-Delete-SmaI 的MCS,再通過同源重組將RNAi-E-Cassette-E2 連接到pCAMBIA1301-Delete-SmaI 載體上,形成一個新載體,將其命名為pCAMBIA1301m。
(2)pCAMBIA1301s 的構建。使用與pCAMBIA1301m 相同的方法構建pCAMBIA1301s。首先構建表達盒RNAi-E-cassette,隨后,將限制性酶切位點SwaI、PmeI 和BamH I 添加到NOS 終止子3' 下游,將RNAi-E-cassette 改造成RNAi-E-cassette-C。然后,在RNAi-E-cassette-C 上游5'端添加一段與pCAMBIA1301 同源的30 bp 序列ACACAGGAAACAGCTATGACCATGATTACG,在其下游3'端添加另一段30 bp 序列AGCTTGGCACTGGCCGTCGTTTTACAACGT,形成一個新片段,將其命名為RNAi-Ecassette-C2。再將RNAi-E-cassette-C2 連接到pCAMBIA1301-Delete-SmaI 載體上,獲得了一個新載體,將其命名為pCAMBIA1301s。
(3)多基因盒干擾載體使用方法。本文構建的多基因干擾體系由包括pCAMBIA1301m 和pCAMBIA1301s 兩個載體組成。兩個載體均可通過Hind III、PstI、SalI 和XbaI 酶切位點導入目標基因的正向干擾片段,通過KpnI、XmaI、Eco53k I、SmaI 和SacI 酶切位點導入目標基因的反向干擾片段,形成完整的目標基因干擾表達盒。隨后,用MCS3 區段內的限制性酶切位點SpeI、HpaI、StuI和NOS 終止子3'端下游的限制性酶切位點PmeI、SwaI 將pCAMBIA1301s 上的完整的目標基因干擾表達盒切下,并連接到pCAMBIA1301m 的35S 啟動子之前的SpeI、SwaI、HpaI、StuI 酶切缺口位置,形成雙表達盒的四基因干擾載體,同時載體保留下一個從pCAMBIA1301s 切下的表達盒接入的位點,以此實現連續構建完整目標基因干擾表達盒的目的,因此有利于多基因同時干擾或共沉默。
1.2.2 干擾基因篩選及生物信息學分析 本文從番茄數據庫(https://solgenomics.net/)篩選到的13個PP2C基因,通過與擬南芥數據庫(https://www.arabidopsis.org/)中篩選得到的擬南芥PP2C基因構建PP2C基因的系統發育樹。本文用MEGA7.0 中的clustalW 對上述基因的蛋白質序列進行比對分析,并用Neighbor-Joining method 法進行系統樹構建,Bootstrap 參數設為1 000;Model/Method 參數設為p-distance;Gaps/Missing Data Treatment 參數設為Pairwise delection。從中選擇具有較近的同源關系的4 個PP2C基因,并將它們重新命名:SlPP2C1、SlPP2C2、SlPP2C3和SlPP2C4,如表1所示。并通過NCBI(https://www.ncbi.nlm.nih.gov/)數據庫的Conserved Domain Search Service(CD search),并結合MEME(http://meme-suite.org/tools/meme)分析其PP2C 保守結構域,以確定其是否為PP2C 家族成員。
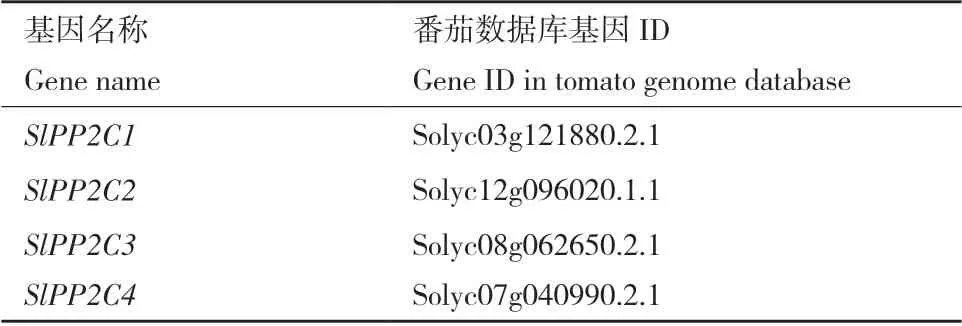
表1 本文分析的4 個PP2C 基因的相關信息Table 1 Information of four PP2C genes used in this paper
1.2.3 四基因干擾載體的構建 為了實現4 個PP2C基因被特異性干擾,同時避開其基因家族的保守功能區域,本文選取這些基因近編碼區3'端區域內的250-500 bp 片段作為干擾片段。采用Overlap PCR技術將SlPP2C1和SlPP2C2的干擾片段連接形成一個融合片段(A 片段),SlPP2C3和SlPP2C4的干擾片段連接形成另一個融合片段(B 片段)。然后,將A 片段和B 片段的正向和反向片段分別連接到多基因干擾載體體系pCAMBIA1301m 和pCAMBIA1301s的正向和反向位點上,形成pCAMBIA1301m:35S∷SlPP2C1-2 和pCAMBIA1301s :35S∷SlPP2C3-4。接著用SpeI 和SwaI 將35S∷SlPP2C3-4 表達盒從載體pCAMBIA1301s:35S∷SlPP2C3-4 上切下來,連接到載體pCAMBIA1301m:35S∷SlPP2C1-2 上,由此形成雙表達盒的pCAMBIA1301m:35S∷SlPP2C1-2-3-4 載體。引物設計使用Primer5,在SlPP2C1和SlPP2C3干擾片段的F 引物5'端添加SacI 和SalI(酶切點ACGCGTCGACGAGCTC,同時在SlPP2C2和SlPP2C4干擾片段的R 引物5'端添加SmaI 和XbaI 酶切位點TCCCCCGGGTCTAGA,引物序列見表2。
1.2.4 番茄遺傳轉化及陽性植株鑒定 將構建的四基因干擾載體pCAMBIA1301m:35S∷SlPP2C1-2-3-4,借助農桿菌GV3101 導入番茄Micro-Tom中,獲得轉基因番茄植株。隨后,通過GUS 染色和PCR 對T0轉基因植株進行檢測。PCR 使用寡核苷酸Loop-JC-F 和Loop-JC-R 作為鑒定引物(表2)。去除T0代假陽性植株后,將鑒定到的陽性植株命名為35S∷SlPP2C1-2-3-4,并對陽性植株分別種植、單株收種。T0代轉基因番茄種子經1/2 MS 固體培養基(卡拉霉素,100 mg/L)抗性篩選后,種植在溫室中,繁育子代轉基因植株,用于進一步的生理生化分析。
1.2.5 RT-qPCR 檢測與干擾效率分析 為檢測目標基因的干擾效率,取T1(T1-1、T1-2、T1-3、T1-4)和T2(T2-1、T2-2、T2-3 和T2-4)代陽性轉基因番茄的成熟葉片,用野生型(WT)番茄葉片作對照,用QIAGEN RNeasy Plant mini 試劑盒(Qiagen,德國)提取總RNA,然后用反轉錄試劑盒PrimeScriptTMRT Reagent Kit With gDNA Eraser(Perfect Real Time)(TaKaRa,日本)將總RNA 樣品反轉錄為cDNA。使用RT-qPCR 技術檢測干擾植株中各PP2C基因的表達水平。將上述cDNA 為模板,以SlUBI(Solanum lycopersicum Ubiquitin,NM_001346406.1)作為內參基因(引物序列見表2),用TB Green TM Premix EX Taq TM II(TaKaRa,日本)進行RT-qPCR 分析,以探究多基因干擾植株的干擾效率。使用金斯瑞(https://www.genscript.com/tools/real-time-pcr-taqmanprimer-design-tool)在線設計RT-qPCR 引物(引物序列見表2)。使用CFX96 Real-Time PCR 儀(Bio-rad,美國),RT-qPCR 程序為:95℃預變性30 s;95℃變性5 s,60℃退火30 s,39 次循環。實驗重復3 次,所得實驗數據通過2-ΔΔCt統計分析。RT-qPCR 定量分析時,將WT 中基因的相對表達值設置為1,用轉基因植株中基因的相對表達量來表示其基因的表達水平。
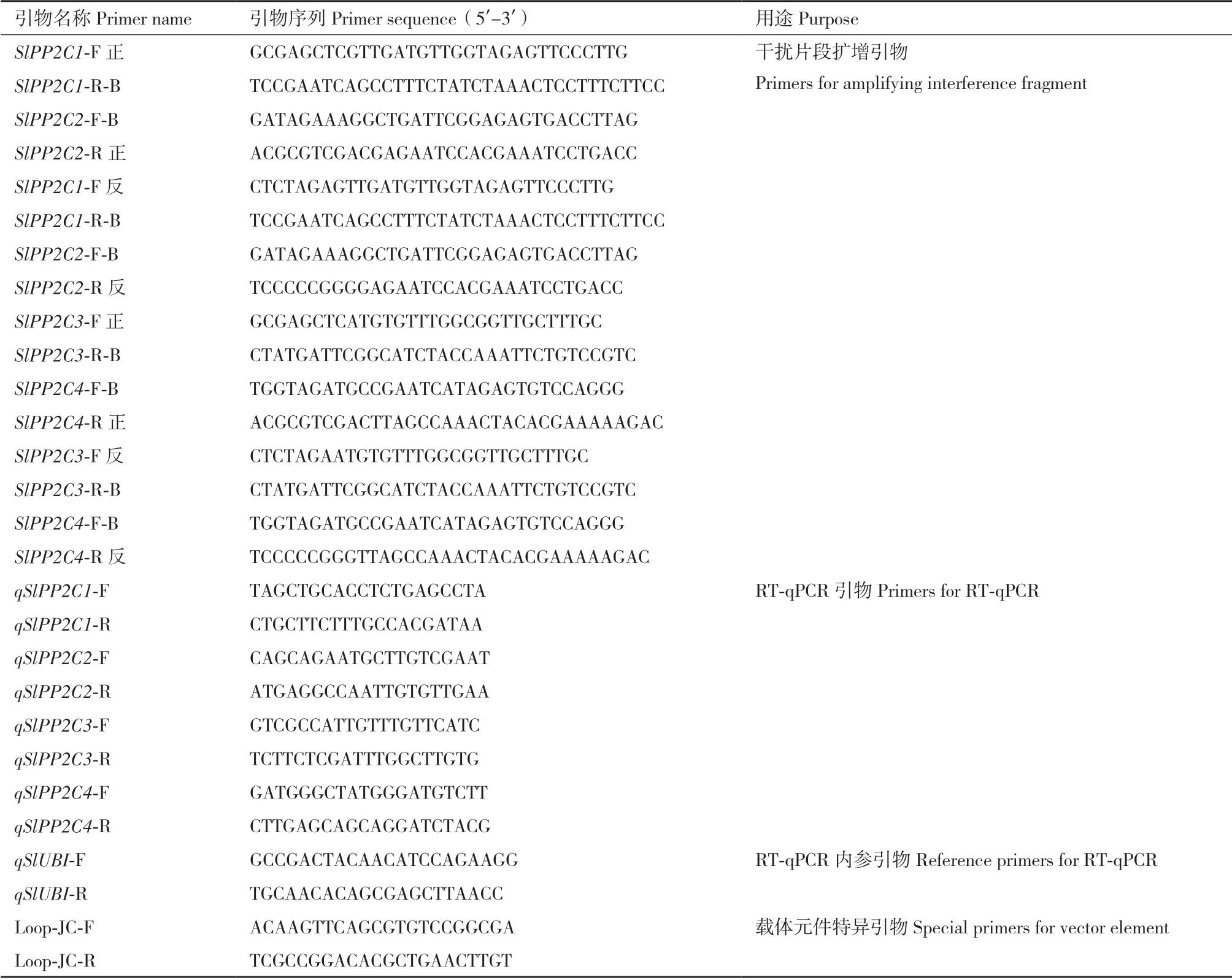
表2 本文使用的所有引物Table 2 All primers used in this study
1.2.6 干擾后的番茄轉基因植株對ABA 敏感性檢測 本文以種子萌發率為指標,分析轉基因番茄種子的ABA 敏感性。首先設置不同的ABA 濃度梯度,篩選番茄野生型(WT)種子對ABA 敏感的最適濃度:選取600 顆飽滿的番茄WT 種子接種在含有不同ABA 濃度梯度的1/2 MS 固體培養基上,觀察和統計種子萌發情況。ABA 設置4 個濃度梯度,分別為1 μmol/L、2 μmol/L、5 μmol/L 和10 μmol/L,用雙蒸水(Mock)處理作對照。每個梯度設置4 次生物學重復,每個重復處理30 顆種子。以種子胚根露白為萌發標準,每天統計萌發率,連續統計9 d。
隨后,將上述實驗篩選出來的最適濃度(5 μmol/L ABA)用于處理轉基因植株種子,雙蒸水(Mock)作為對照。新采收的T1代轉基因株系(T1-1、T1-2 和T1-3)種子用ABA 處理,萌發條件同上,以WT 種子為對照。通過統計種子萌發率,計算相對萌發率(相對萌發率=ABA(5 μmol/L)處理的種子萌發率/無ABA 處理種子萌發率),獲得干擾后的番茄種子對ABA 的敏感性結果。
2 結果
2.1 構建多基因載體體系
為了實現多個基因同時干擾,本文對原始載體pCAMBIA1301(圖1-A)進行改造,構建了多基因干擾體系pCAMBIA1301m 和pCAMBIA1301s 載體(圖1-B-C)。載體pCAMBIA1301 的T-DNA 區域位于兩個轉座邊界Right Border repeat T-DNA(RB)(2 350-2 374 bp)和Left Border repeat T-DNA(LB)(8 628-8 652 bp)之間,包含一個LacZ 基因和兩個35S 啟動子,其中LacZ 基因用于藍白斑篩選,一個35S增強啟動子用于驅動潮霉素抗性基因表達,另一個35S 啟動子用于驅動GUS 基因表達。T-DNA 區域外含有一個卡那霉素抗性基因標簽。pCAMBIA1301被廣泛用于農桿菌介導的植物遺傳轉化,然而該載體只能實現單基因干擾,具有較大的局限性。而本文改造形成的多基因干擾體系pCAMBIA1301m 和pCAMBIA1301s 載體(圖1-B-C),能夠實現多個基因同時干擾的目的,有利于同時分析多個基因的功能。
多基因干擾體系pCAMBIA1301m 和pCAMBIA1301s 載體的目標基因表達盒中均包含MCS3、MCS1 和MCS2 三個多克隆位點,MCS1 區段內包含黏性末端限制性內切酶位點Hind III、PstI、SalI 和XbaI,用于導入目標基因的正向干擾片段;MCS2區段中具有黏性末端限制性內切酶位點KpnI、XmaI 和SacI,以及平末端限制性內切酶位點Eco53k I和SmaI,用于導入目標基因的反向干擾片段。載體pCAMBIA1301m 的MCS3 區段包含限制性酶切位點粘性末端限制性內切酶切位點SpeI 以及平末端限制性內切酶位點SwaI、HpaI 和StuI,作為下一個表達盒載入的接口。載體pCAMBIA1301s 的MCS3 區段包含的粘性末端限制性內切酶位點SpeI 以及平末端限制性內切酶位點HpaI 和StuI,并在NOS 終止子3'端具有平末端限制性內切酶位點PmeI 和SwaI,用于切取pCAMBIA1301s 載體上完整的表達盒(圖1-B-C)。
多基因干擾載體體系pCAMBIA1301m 和pCAMBIA1301s 使用時,需要在目標基因正向干擾片段上,添加MCS1 區段內對應的兩個限制性內切酶位點;在反向片段上添加MCS2 區段內對應的兩個限制性內切酶位點,才能形成一個完整的干擾表達盒。在實際操作時,需要從PmeI 和SwaI 中選取一個平末端限制性內切酶,與粘性末端限制性內切酶SpeI 組合,才能完整切取pCAMBIA1301s 上的干擾表達盒,再連接pCAMBIA1301m 上,從而實現將兩個表達盒串聯于同一個干擾載體的目的,同時,也保證在載體pCAMBIA1301s 上始終保留有限制性內酶切位點SpeI、HpaI 和StuI,作為下一個新的表達盒載入的接口,利于多個表達盒重復添加和串聯。該多基因干擾體系能有效實現多個基因同時干擾,是同時研究多個基因的功能以及分析功能冗余基因的有效工具(圖1-D)。
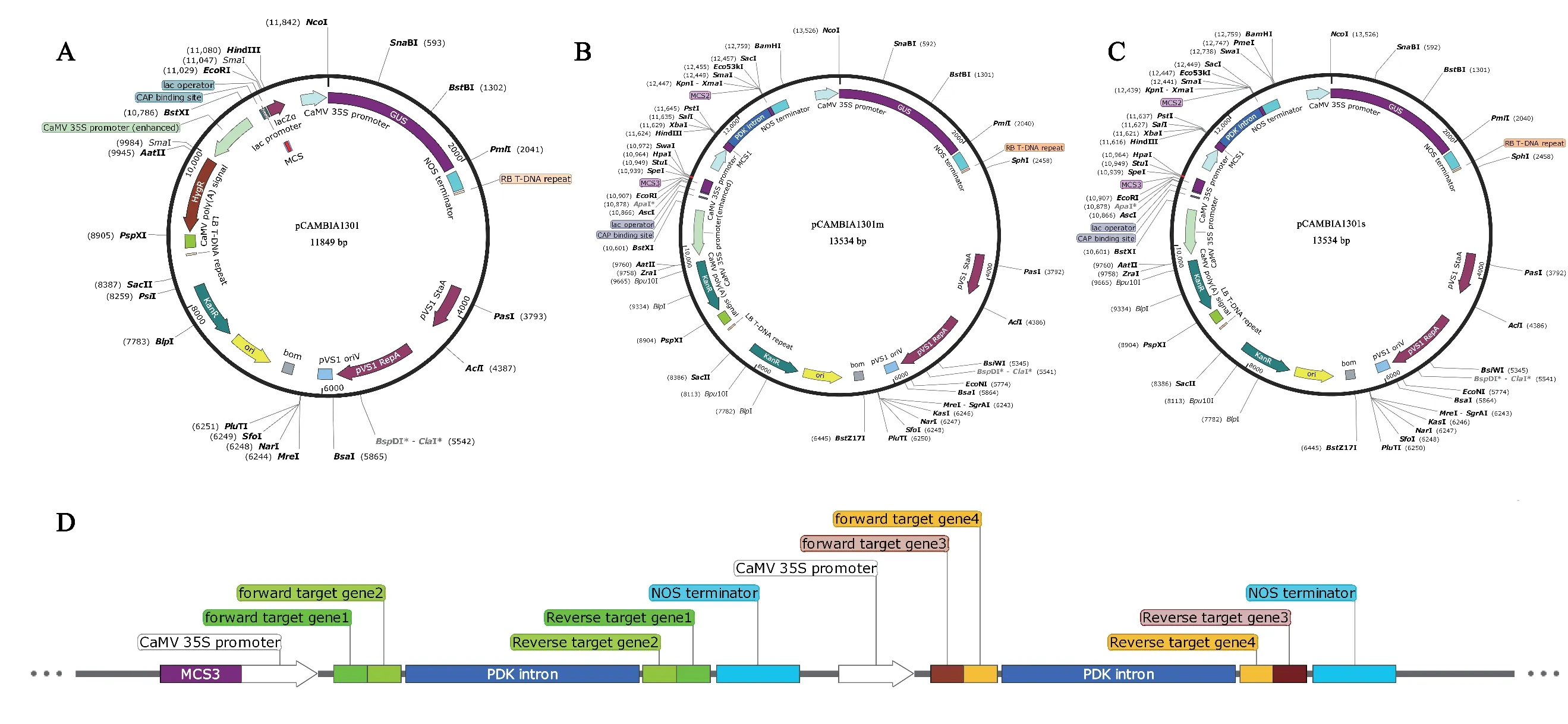
圖1 多基因沉默載體系統Fig.1 Multi-genes silencing system
2.2 干擾基因篩選及生物信息學分析
為了驗證多基因干擾體系的有效性,選用ABA 信號轉導核心元件PP2C 家族基因作為靶標進行多基因干擾。從番茄數據庫篩選到13 個PP2C基因,系統發育樹分析結果顯示,13 個PP2C基因均屬于A 組的PP2C 家族基因,其中4 個基因Solyc03g121880.2.1、Solyc12g096020.1.1、Solyc08g062650.2.1 和Solyc07g040990.2.1 具有較近的同源關系,這4 個基因可能在功能上具有一定關聯(圖2-A)。進一步分析發現,這4 個基因均具有完整的PP2Cc 超家族所特有的3 個保守區域(圖2-BC)。因此,選擇這4 個基因作為多基因干擾系統有效性檢驗的靶標基因,并將Solyc03g121880.2.1、Solyc12g096020.1.1、Solyc08g062650.2.1 和Solyc07g040990.2.1 分別命名為SlPP2C1、SlPP2C2、SlPP2C3和SlPP2C4。
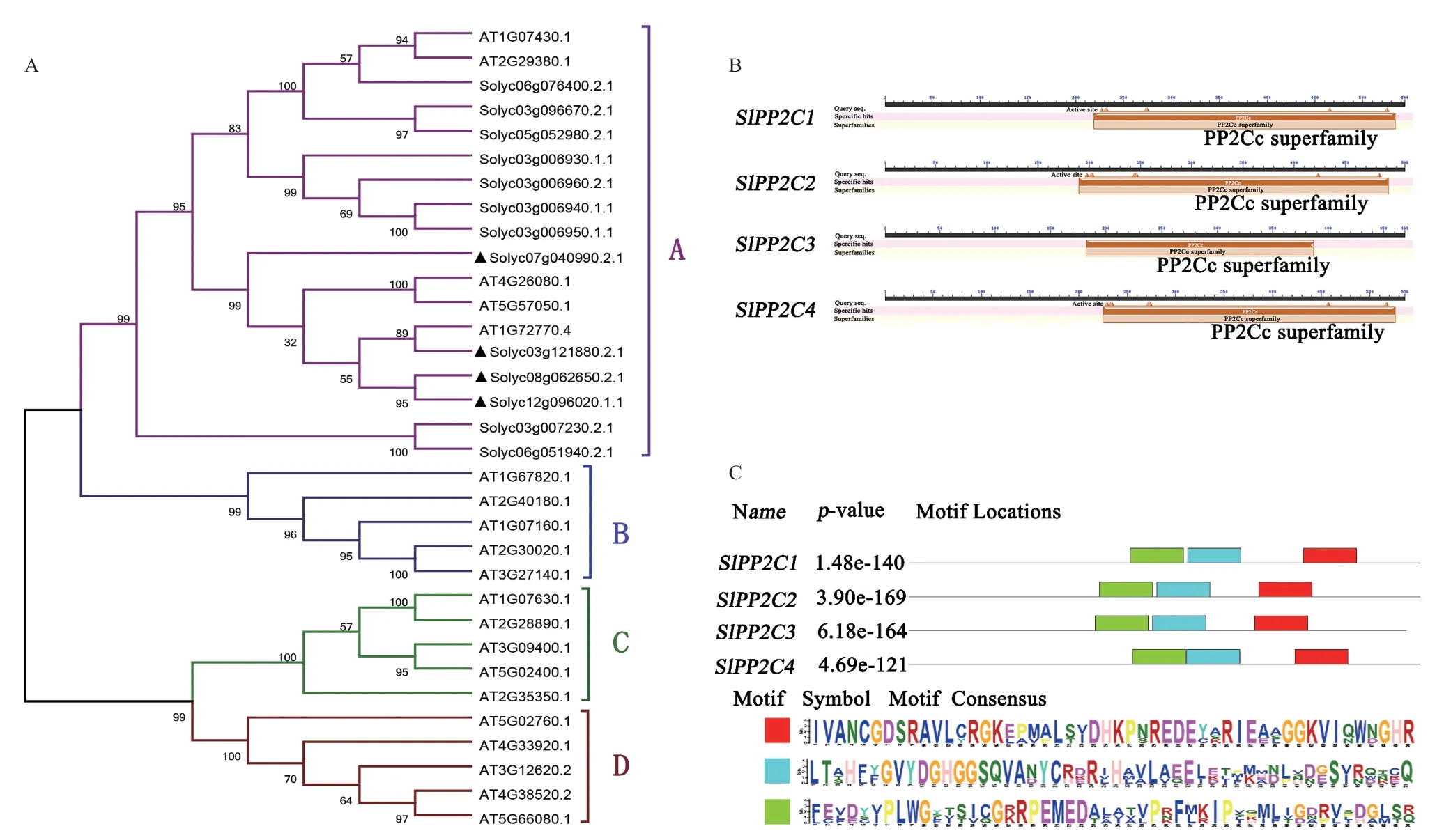
圖2 四個PP2C 基因的生物信息學分析Fig.2 Bioinformatics analysis of four PP2C genes
2.3 四基因干擾載體構建、轉化及陽性篩選
利用多基因干擾載體體系構建了四基因干擾載體pCAMBIA1301m:35S∷SlPP2C1-2-3-4(圖3-A)。該載體中包含兩個完整干擾表達盒,其中第一個表達盒介導SlPP2C1和SlPP2C2的融合干擾片段表達,讓SlPP2C1和SlPP2C2基因表達沉默,第二個表達盒介導SlPP2C3和SlPP2C4的融干擾片段表達,實現SlPP2C3和SlPP2C4基因沉默。因此,該四基因干擾載體能實現對4 個基因SlPP2C1、SlPP2C2、SlPP2C3、SlPP2C4的同時干擾。
通過遺傳轉化,將四基因干擾載體pCAMBIA1301m:35S∷SlPP2C1-2-3-4,導入Micro-Tom番茄,獲得四基因干擾番茄。隨后,用GUS 染色和PCR 法對四基因干擾的轉基因番茄的T0代植株進行陽性鑒定。GUS 染色法鑒定結果顯示,T0代的T0-1、T0-2、T0-3 和T0-4 植株的葉片為藍色(圖3-B),而WT 植株葉片為白色。PCR 法驗證結果顯示4 株T0植株均有清晰的擴增條帶,大小與預期結果基本一致(圖3-C)。鑒定結果說明4 個目標基因干擾片段均已成功轉入番茄體內,T0-1、T0-2、T0-3 和T0-4 均為陽性轉基因植株。
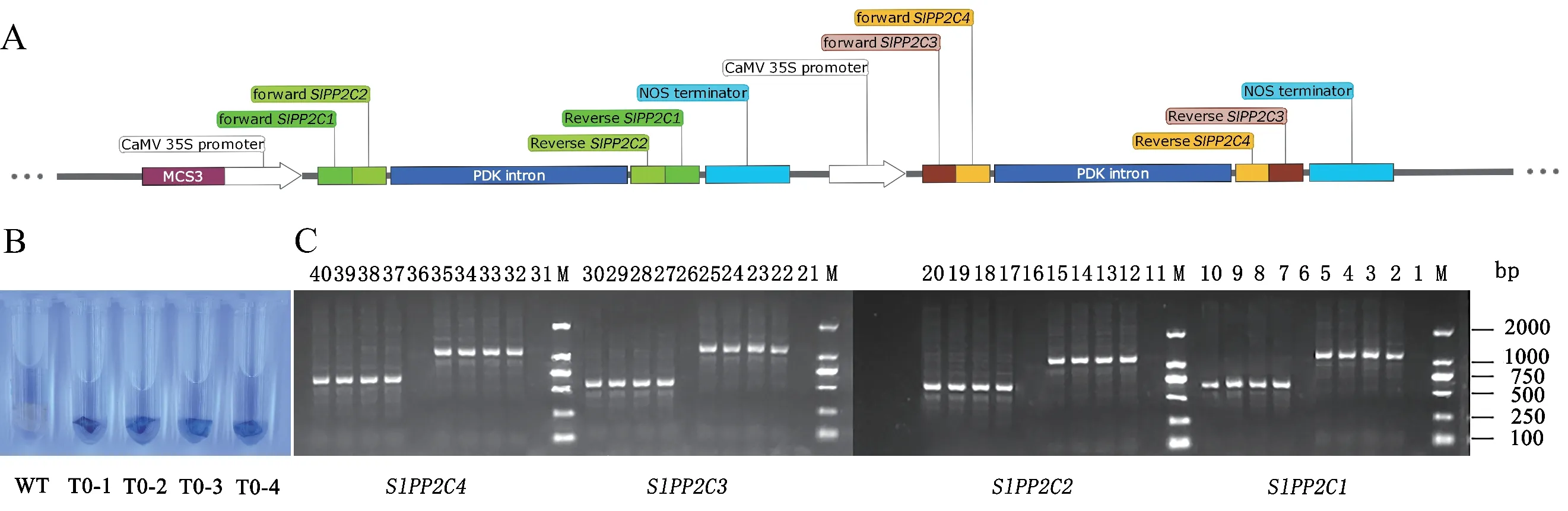
圖3 SlPP2Cs 干擾載體構建及陽性植株檢測Fig 3 Construction of SlPP2 Cs silencing vector and detection of positive plants
2.4 目標基因干擾效率檢測
為了探究多基因干擾系統介導下轉基因番茄中SlPP2C1、SlPP2C2、SlPP2C3和SlPP2C4基因的干擾效率,本文用RT-qPCR 技術檢測了這4 個基因在T1和T2代植株中的表達水平。結果顯示,在T1(T1-1、T1-2、T1-3 和T1-4)和T2(T2-1、T2-2、T2-3 和T2-4)代四基因干擾番茄中SlPP2C1、SlPP2C2、SlPP2C3和SlPP2C4的表達水平遠低于WT,這些基因均被顯著抑制,其干擾效率均高于70%(圖4-A-B),證明經過改造后的多基因干擾體系對目標基因具有良好的干擾效果,且T1和T2代的干擾效率基本一致。
2.5 轉基因番茄ABA敏感性分析
為了進一步驗證多基因干擾體系的效用性,分析了T2代轉基因番茄35S∷SlPP2C1-2-3-4 種子萌發對脫落酸的敏感性。結果顯示,與雙蒸水(Mock)處理相比,不同濃度ABA 處理均能抑制WT 番茄種子的萌發,而且ABA 濃度越高抑制作用越強(圖5-A)。雙蒸水處理的WT番茄種子從第1天開始萌發,在4 d 時達到最大萌發率0.948±0.039,其后不再變化。1 μmol/L 與2 μmol/L 的ABA 處理的WT 番茄種子的萌發率變化趨勢與雙蒸水處理的趨勢基本一致,在第1 天時開始萌發,之后分別在第4 天和第5 天達到最大萌發率0.906±0.071 和0.948±0.021。而5 μmol/L 和10 μmol/L 的ABA 處理的WT 番茄種子的萌發明顯延遲,分別在接種后第2 和3 天才開始萌發,其中5 μmol/L 的ABA 處理組在第9 天達到最大萌發率0.948±0.021,而10 μmol/L 的ABA 處理組到第9天也未達到峰值。結果表明,ABA 處理能抑制WT番茄種子的萌發,其中5 μmol/L 的ABA 濃度是顯著抑制WT 番茄種子萌發的最低有效濃度。因此,本文選擇5 μmol/L 為最佳ABA 處理濃度用于進一步分析多基因干擾植株種子萌發對ABA 的敏感性。
使用5 μmol/L 的外源ABA 處理WT 番茄和T2代的多基因干擾番茄T2-1、T2-2 和T2-3 的種子,用雙蒸水處理作為對照。結果顯示雙蒸水處理的T2-1、T2-2 和T2-3 的種子萌發率與WT 無顯著差異;5 μmol/L 的ABA 能顯著抑制WT 番茄種子的萌發,其萌發率遠低于雙蒸水處理的WT 種子萌發率。而ABA 處理轉基因番茄T2-1、T2-2 和T2-3 的種子萌發率顯著高于ABA 處理的WT 種子(圖5-B)。為了更為直觀地分析轉基因番茄種子ABA 敏感性變化的效率,本文計算了相對萌發率(相對萌發率=5 μmol/L ABA 處理萌發率/雙蒸水處理萌發率),結果顯示轉基因番茄相對萌發率遠高于WT 相對萌發率。這些結果表明番茄的4 個PP2C的目標基因被同時干擾后,其種子在萌發方面表現出明顯的ABA 不敏感性(圖5-C)。證明本文經過改造的多基因干擾載體系統能很好地實現多基因的同時干擾,可用于解析基因間功能冗余和研究多個基因的功能。
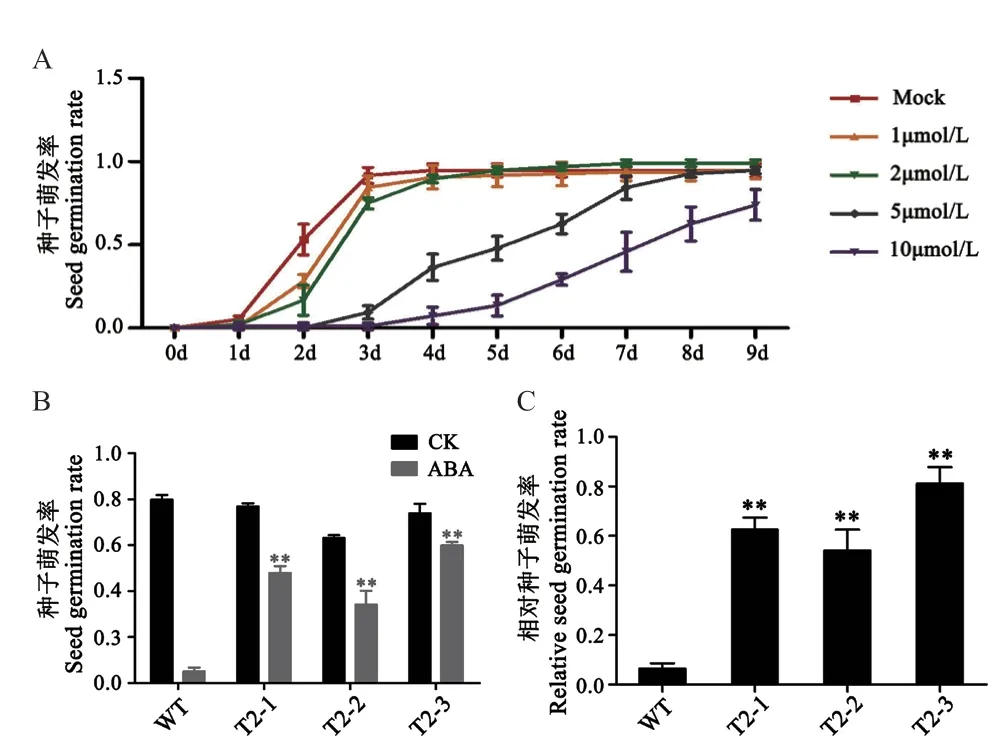
圖5 轉基因植株對ABA 敏感性檢測Fig.5 Sensitivity test of transgenic RNAi plants to exogenous ABA
3 討論
植物的生長發育是一個極為復雜的過程,受眾多基因的調控,其中往往涉及多基因家族的成員,但其部分成員之間常存在功能冗余[19]。在解析植物生長發育過程中這些基因功能和調控關系時,通常會使用基因敲除或過表達等技術[1,20]。然而,基因間的功能冗余導致單基因敲除的遺傳效應難以被檢測,從而限制了對這些基因的生物學功能的全面認識[19]。因此,多基因操作體系對于探究基因的功能及其相互之間的功能冗余具有重要意義。傳統基因功能分析,如誘變法構建突變體等手段,雖然較為有效,但由于誘變具有不確定性、冗余基因的多突變體獲得極為困難、研究周期漫長等缺點,嚴重阻礙了冗余基因的功能研究[21]。目前,RNAi 等技術作為研究基因表達調控和鑒定基因功能的重要技術,具有效率高和特異性強的特征[22-24],被廣泛運用于擬南芥[25]、大豆[26]、蕓薹[27]等植物的研究。但是,傳統的RNAi 體系通常針對單基因干擾,對于研究多基因控制的植物性狀具有局限性。因此,多基因干擾體系的構建對于同時研究植物的多個基因的功能具有重要意義,尤其對于研究冗余基因的功能極為重要。
本文以pCAMBIA1301 為基礎改造獲得的多基因干擾載體體系pCAMBIA1301m 和pCAMBIA1301s,在結構上均包含3 個多克隆位點MCS3、MCS1 和MCS2。該體系能通過MCS1 和MCS2 分別導入目標基因的正向和反向干擾片段,構建完整的目標基因干擾表達盒。pCAMBIA1301m 的多克隆位點MCS3包含黏性末端酶切位點SpeI,以及平末端HpaI、SwaI 和StuI,該多克隆位點為pCAMBIA1301s載體上酶切獲得的目標基因表達盒提供接入位點。而pCAMBIA1301s 載體MCS3 上包含酶切位點SpeI、HpaI 和StuI,并在NOS 終止子下游區域包含平末端酶切位點SwaI 和PmeI,能有效保證pCAMBIA1301s 載體上的目標基因干擾表達盒被完整切下,并與pCAMBIA1301m 的MCS3 上的接入位點有效對接,進而實現兩個目標基因干擾表達盒串聯于同一個干擾載體上。此外,pCAMBIA1301s上完整的目標基因干擾表達盒被切取,并連接到pCAMBIA1301m 上后,仍然保留了酶切位點SpeI 和HpaI 和StuI,作為下一個表達盒接入的位點,從而實現表達盒的重復添加和多次串聯,對于研究多基因同時干擾具有重要意義。
在之前的報道中,He 等[28]和Wang 等[29]在動物多基因沉默的研究中,先后開發了可用于多個siRNA 同時表達的pSOK、BSG 和FAMSi 系統,逐步克服了構建周期長,表達效率低,操作復雜和經驗依賴性高的難題,實現了多個siRNA 表達盒的快速組裝和表達,并廣泛應用于動物的多基因功能研究,為開發基于siRNA 的基因治療技術提供了重要工具,也為本研究提供了重要的經驗參考。目前,在植物的基因功能研究中,急需類似的多基因干擾系統,但暫未見報道。此前,陳任等[30]基于根瘤農桿菌(A.tumefaciens)Ti 質粒pBI121 和大腸桿菌(E.coli)質粒pUC18,構建了適用于植物的多基因表達系統pKAFCR80 和pKAFCR100,克服了植物基因表達載體酶切位點有限和目的片段插入困難等技術難題。陳立志[31]利用Cre/loxP 多基因載體重組技術構建系統,將椰子的3 個基因FatB3、LPAAT和KASI進行操作,構建了兩基因組合載體FatB3-LPAAT和FatB3-KASI,及三基因組合載體FatB3-LPAAT-KASI,實現了2 個或3 個基因的同時過表達。然而,這些載體系統均為過表達系統,無法實現植物的多基因干擾。本研究所構建的多基因干擾載體體系,在植物中有效地實現了多個基因的同時干擾。此外,該系統具有簡單、高效、不易受酶切位點限制等優點,有效地解決了冗余基因的功能研究中,多突變體獲得困難和研究周期漫長的難題。
體系的效用性是載體系統應用價值的核心要素,是載體系統廣泛應用的前提。He 等[28]和Wang等[29]開發的pSOK、BSG 和FAMSi 系統,通過體內和體外的生物功能驗證,鑒定其體系的效用性,并在動物基因功能研究中成功應用。陳任等[30]報道,將3 個甜葉菊葡萄糖基轉移酶基因,轉移到pKAFCR80 和pKAFCR100 載體系統中,并通過菌落PCR 鑒定了單基因、雙基因和三基因表達載體被成功構建。陳立志[31]將載體FatB3-LPAAT、FatB3-KASI和FatB3-LPAAT-KASI轉移到擬南芥中,通過PCR 技術成功鑒定到轉基因陽性植株,RT-qPCR 分析這些基因在轉基因植株中的表達量,并分析了這些基因導入對脂肪酸含量的影響,驗證了其系統的有效性。本研究改造獲得的多基因干擾載體體系,對4 個基因SlPP2C1、SlPP2C2、SlPP2C3和SlPP2C4構建了四基因干擾載體。通過轉基因導入番茄后,獲得轉基因陽性植株35S∷SlPP2C1-2-3-4。進一步分析轉基因番茄植株的干擾效率和轉基因番茄ABA 敏感性,結果顯示多基因干擾后的T1和T2代轉基因番茄植株株系中,4 個目標基因的表達水平均顯著低于WT 番茄,干擾效率均高于70%。SlPP2C1、SlPP2C2、SlPP2C3和SlPP2C4同時干擾顯著改變了T2代轉基因番茄種子萌發對ABA 的敏感性,導致轉基因番茄種子在ABA 處理條件下的萌發率和相對萌發率均顯著高于WT。結果表明該多基因干擾體系,能夠有效實現多基因的同時干擾,具有特異性和高效性。本研究通過一系列的驗證,不僅鑒定了該體系的效用性,并在植物基因功能研究中進行了應用實踐。
本研究改造的多基因干擾載體,能在短時間內實現單、雙以及多基因的同時干擾,能夠有效應用于多基因功能研究,并解析基因間功能冗余。該多基因干擾體系為植物的基因功能研究和基因間的功能冗余解析提供了重要的方法和分子工具。
4 結論
對pCAMBIA1301 載體進行改造,形成多基因干擾載體體系pCAMBIA1301m 和pCAMBIA1301s,利用該體系對番茄中的PP2C 家族4 個基因SlPP2C1、SlPP2C2、SlPP2C3和SlPP2C4構建四基因干擾載體SlPP2C1-2-3-4。通過遺傳轉化獲得四基因干擾的轉基因番茄植株35S∷PP2C1-2-3-4。T1和T2代陽性轉基因植株中的4 個目標基因的干擾效率均高于70%,并且顯著改變了T2代轉基因番茄種子萌發對ABA的敏感性。

