合成生物學細胞傳感技術在食品安全快速檢測中的應用
陳曉琳 劉洋兒 許文濤 郭明璋 劉慧琳
(1.北京工商大學食品與健康學院,北京 100048;2.中國農業大學營養與健康系,北京 100083)
開發新一代食品安全檢測技術是構建從“從農田到餐桌”全鏈條食品安全監管體系,進一步提升我國食品安全水平的關鍵。食品安全檢測技術主要分為儀器分析法和快速檢測法兩大類,基于色譜、光譜等原理的儀器分析法是目前食品安全抽檢監測部門所使用的主要方法,具有靈敏度高、準確性好等優點,但操作復雜、成本高、檢測時間長,不適合現場及大量樣品的篩選和快速測定[1]。快速檢測法是利用靶標待測物的化學或生物學性質所開發的,操作簡單、成本低廉、可以短時間內完成檢測的方法。相比于儀器分析法,快速檢測法不僅可以提升抽檢監測部門的工作效率,更可用于企業、商超、消費者的食品安全自檢自測,對于完善食品安全監管體系具有重要意義。
近年來,食品安全快速檢測技術在國內外科學家的共同努力下取得了長足的進步,其中利用抗原抗體特異性識別、適配體特異性識別、核酸特異性擴增等原理所開發的快速檢測技術發展尤為迅速[2]。這些技術檢測快速、操作簡便,但仍然需要在以下方面進行提升:首先,由于食品基質成分復雜,這些技術通常需要配合復雜的預處理步驟,導致操作復雜性增加,總檢測時間增長;另一方面這些技術所使用的抗體、適配體、核酸擴增酶和引物等物質生產純化費時費力,導致檢測成本增高。細胞傳感技術是一種新興食品安全快速檢測技術,它是以活體細胞為感應元件,感應被測量并按照一定規律轉換為可識別信號的檢測裝置[3]。由于細胞具有代謝調控能力,無論外部環境如何變化,細胞始終保持相對內穩態,為靶標識別和信號轉化提供了穩定的環境,因此細胞傳感器對環境的抗干擾能力通常較強;由于細胞具有自我繁殖能力,傳感器細胞內部所有基因元件可以通過基因復制和細胞增殖而自動擴增,因此細胞傳感器在生產上具有簡單、廉價、快速的特點。上述優點使細胞傳感技術在食品安全快速檢測中具有良好的實際應用前景。
合成生物學的發展為細胞傳感技術的應用提供了新的契機。合成生物學是指人們將基因按照一定規律連接成網絡,讓細胞來完成人為設計的各種任務[4]。與傳統的基因工程技術通過改造某個特定基因而獲得所需要的細胞品系不同,合成生物學技術將細胞視為“微型機械”,對細胞的改造更類似于機械設備中元器件的搭建。因此,合成生物學與細胞傳感技術在理論思想方面具有高度一致性。合成生物學為細胞傳感器提供新的功能元件、模塊器件以及組裝理論。本文將對基于合成生物學的細胞傳感技術發展及應用案例進行綜述,并對合成生物學與食品安全技術的發展趨勢進行展望。
1 合成生物學細胞傳感系統的感應元件
細胞傳感器的感應元件主要包括轉錄因子和核糖開關,轉錄因子是一類能與基因上游特定序列專一性結合,從而影響基因轉錄的蛋白質分子,核糖開關是某些mRNA 非翻譯區的序列折疊成一定的構象。這兩類分子均可特異性結合某種或某類化學物質并導致自身三維構象發生變化,轉錄因子構象變化后,其與基因的啟動子區域的結合能力改變,從而促進或抑制基因的轉錄過程,而核糖開關構象變化后,其莖環排布發生改變,暴露或隱藏mRNA 的核糖體結合位點,從而開啟或關閉mRNA 的翻譯過程。感應元件與待測物質的結合能力,決定了細胞傳感器的靈敏度和特異性,因此篩選合適的感應元件是構建細胞傳感器的關鍵。
1.1 轉錄因子
目前已經發現的原核生物轉錄因子約有300 多種,細胞傳感器設計者可以在CollecTF1、P2TFA、porTF 等原核生物轉錄因子數據庫中查找識別某種待測靶標物質的轉錄因子(表1)。然而在食品安全領域,大部分需檢測的危害物質并沒有相對應的已知轉錄因子,需要從自然界生物體內篩選新的轉錄因子,甚至人工構建自然界中不存在的轉錄因子。隨著基于高通量測序的轉錄組學技術的發展,篩選新轉錄因子的效率大幅提高。例如,Shi 等[25]為了篩選丁醇的轉錄因子,將丁醇及其類似物丙醇、乙醇等分別加入酵母細胞,進行轉錄組學分析,找出特異性響應丁醇,而不響應乙醇、丙醇的啟動子,并將其與紅色熒光蛋白基因結合,在酵母細胞中構建了檢測丁醇的全細胞生物傳感器。

表1 常見靶標物質的細胞傳感器感應元件Table 1 Sensing elements in whole-cell biosensors for common target substances
對于難以找到理想的天然轉錄因子的靶標物質,合成生物學提供了人工改造甚至從頭構建轉錄因子的策略,常見的方式有截短、嵌合、功能域突變、全蛋白突變、從頭設計等。(1)截短,即通過縮短已知轉錄因子的長度來改變其性能。例如,Tao等[26]通過截短轉錄因子CadR 來優化其對鎘離子和汞離子的特異性。該研究分別從C 端去掉CadR的10 個和21 個氨基酸來自獲得了CadR-TC10 和CadR-TC21,并將其作為感應元件控制綠色熒光蛋白基因的表達,構建識別鎘離子和汞離子,而對鋅離子識別減弱的大腸桿菌全細胞生物傳感器。(2)嵌合,即將一種轉錄因子的靶標識別功能域與另一種轉錄因子的基因表達調控功能域相結合,從而獲得一種特異性好、基因表達調控能力強的新轉錄因子。例如,Mendoza 等[27]利用嵌合的方式開發了一種對汞離子特異性好、靈敏度高的全細胞生物傳感器。該團隊將轉錄因子GolS77 的金離子識別功能域替換為MerR 的汞離子識別結構域,構建成為GolS*轉錄因子。GolS*轉錄因子與Hg2+結合后可以促進PgolB 啟動子控制的綠色熒光蛋白基因的表達,從而將檢測金離子的全細胞生物傳感器改造為檢測汞離子的全細胞生物傳感器。(3)功能域突變,即對轉錄因子中的功能域(能獨立存在的功能單位)進行位點特異性突變。例如Kasey 等[28]對MphR 轉錄因子識別結構域中與大環內酯類物質直接結合的5 個氨基酸位點進行隨機突變,構建成所有5 個氨基酸位點的飽和突變庫QCMS5,從中篩選了一種對大環內酯類物質特異性更好、靈敏度更高的突變體轉錄因子。利用該突變體轉錄因子構建的全細胞生物傳感器,可實現大環內酯類藥物生物合成基因通路的高通量定向進化。此外,D’Oelsnitz 等[29]對RamR轉錄因子與黃連素結合的氨基酸位點進行誘變,構建突變文庫,挑選最佳突變體轉錄因子,開發了四氫生物堿的高度特異性和靈敏度的生物傳感器。(4)全蛋白突變,即將原有轉錄因子的蛋白隨機突變篩選出有正向作用的突變體。例如,Chong 等[11]通過對dmpR 基因的易錯PCR 擴增,將隨機突變引入整個DmpR 蛋白,從中篩選出性能更好的特異性響應有機磷的轉錄因子,證明了在轉錄因子功能域外的氨基酸位點突變也有助于增加其誘導表達水平。(5)從頭設計,即利用酶對底物識別的功能域、抗體對抗原識別的功能域等部件,從頭創造自然界中不存在的轉錄因子[30-31]。例如,Chang 等[30]提出了一種基于單體DNA 結合域融合的單域抗體的通用框架來從頭設計針對新靶標配體的轉錄因子的策略。
對于改造或從頭設計的轉錄因子,合成生物學也提供了高效篩選的方案,例如,Liu 等[32]將轉錄因子性能與細胞麥芽糖利用能力相偶聯,形成了新型篩選策略。與傳統的基于抗生素耐藥性篩選策略相比,基于麥芽糖利用能力的篩選適應性更強,即使經過多次選擇,逃逸風險也要低得多。Jia 等[33]設計了雙向篩選技術,以獲得對鉛離子響應靈敏度較高,且不受鋅離子干擾的PbrR 轉錄因子突變體。在正向選擇中,PbrR 轉錄因子與氨芐青霉素抗性基因amp的表達相偶聯,在培養液中加入鉛離子,利用氨芐青霉素篩選出對鉛離子靈敏度較高PbrR 突變體;在反向篩選中,PbrR 轉錄因子與果聚糖合酶基因sacB相偶聯,在培養液中加入鋅離子,利用蔗糖篩選出對鋅離子靈敏度較低PbrR 突變體。
1.2 核糖開關
2002年人類發現第一個核糖開關,目前為止已知的天然核糖開關僅有20 余種[34]。原核生物中核糖開關主要有3 種類型:(1)適配終止子模式。當細胞內無靶標物質時,基因上游的5'非編碼形成抗終止子結構,RNA 聚合酶可以順利完成基因編碼區的轉錄。當細胞內有靶標物質時,靶標物質結合核糖開關,破壞了抗終止子的穩定性,而形成終止子發夾結構,導致RNA 聚合酶從mRNA 分離,關閉基因表達。(2)適配RBS 模式。當細胞內無靶標物質時,核糖體結合位點(ribosome binding site,RBS)被隱藏在莖環結構中,核糖體無法結合到mRNA 上而無法翻譯。當靶標結合核糖開關后,莖環結構被打開,暴露出核糖體結合位點,開啟蛋白翻譯。(3)適配核酶模式。當靶標物質結合到核糖開關區域后,激活核酶的自切割活性,導致mRNA 降解,從而阻斷蛋白質的翻譯過程。以核糖開關作為感應元件的細胞傳感器案例目前較少,例如Wang 等[35]將特異性響應鈷/鎳離子的核糖開關與紅色熒光蛋白mCherry 基因相結合,開發出高靈敏度和高選擇性的鈷/鎳離子全細胞生物傳感器。
對于自然界中不存在天然核糖開關的靶標物質,可以通過篩選、改造等方式開發人工核糖開關,而RNA 合成生物學技術的發展為核糖開關的智能靶向設計提供了新的契機。通過體外篩選得到的能與靶標物質進行高親和力和強特異性結合的核酸短鏈被稱為適配體。適配體的三維構象與其所處的體系環境具有密切關系,如何保證體外環境中篩選的適配體在傳感器細胞內正確折疊仍是該領域需要突破的技術瓶頸。Jang 等[36]通過體外-體內雙重篩選解決這一問題,開發了一種人工己內酰胺核糖開關,靈敏度達到50 mmol/L,并可用于篩選工業生產菌株以提高己內酰胺的產量。該團隊[37]以及Xiu 等[38]又利用該策略篩選得到了特異性響應柚皮素的核糖開關。然而該體外體內雙重篩選策略工作量大,成功率低,無法從根本上解決適配體的細胞內應用問題。深入研究適配體序列、構象、環境之間的關系,才是從根本上解決這一問題的關鍵[34,39-40]。
2 合成生物學細胞傳感系統的報告元件
細胞傳感器的報告元件是指傳感器細胞中生成人類或已有儀器可識別信號的元件。報告元件通常為蛋白質,也有少量為功能核酸。目前已經發展成熟和正在研發的各類報告元件可分為八類(圖1)。
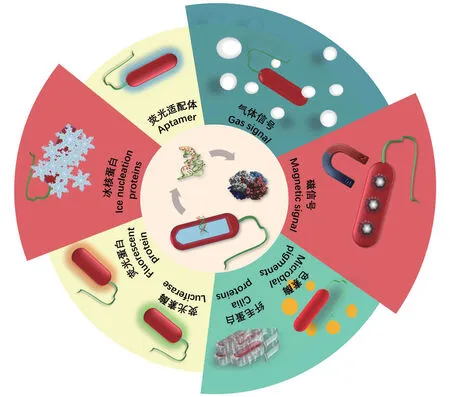
圖1 細胞傳感器報告元件種類Fig.1 Types of reporter elements used in whole-cell biosensors
2.1 熒光素酶
自然界中能夠與氧氣反應產生熒光的物質統稱為熒光素,該反應的速率在沒有酶催化的情況下非常慢,而生物體內許多能夠在鈣離子作用下大大加快這一反應速率的酶,統稱為酶熒光素酶(luciferase),常用作報告元件的熒光素酶包括細菌熒光素酶(bacterial luciferase,Lux)、螢火蟲熒光素酶(firefly luciferase,Luc)和水母素(aequorin)等。
2.2 熒光蛋白
熒光蛋白一般由單個基因表達,蛋白自身可以產生穩定的熒光,不需要任何底物,除了溶氧外,其表達和熒光強度基本不受底盤細胞代謝的影響,這些優點使熒光蛋白成為最理想的細胞傳感器報告元件。現階段,90%以上的合成生物學細胞傳感器使用熒光蛋白作為報告元件。在熒光蛋白的選擇方面,細胞傳感器的設計者需要考慮如下因素[41]:第一,熒光蛋白在底盤細胞中能夠有效表達并成熟,并且能提供最夠強度的熒光信號;第二,熒光蛋白在檢測過程中要保持光穩定性;第三,熒光蛋白對底盤細胞應是沒有毒性的;第四,熒光蛋白應該對檢測體系的環境因素不敏感。
2.3 熒光適配體
RNA 適配體熒光報告元件是指與無熒光或弱熒光靶物質結合后能形成強熒光復合物的適配體。RNA 適配體熒光報告元件信號輸出的過程則只需要經歷“轉錄”的過程,理論上,RNA 適配體報告元件的信號輸出所需時間更短。在長度上,由于蛋白元件的每個氨基酸對應DNA 上3 個堿基,而RNA元件的每個核糖核酸對應DNA 上的1 個堿基,RNA元件所對應的基因通常更短。在元件設計上,RNA比蛋白質在裁剪、劈裂、拼接等方面都更加便利。因此,RNA 適配體作為報告元件具有獨特的優勢。目前可用作報告元件的熒光適配體有孔雀石綠熒光適配體(malachite green aptamer)[42]、菠菜綠熒光適配體(spinach aptamer)[43]、芒果黃熒光適配體(mango aptamer)[44]、西蘭花熒光適配體(broccoli aptamer)[45]。
2.4 色素報告元件
色素(microbial pigments)是一類由微生物或動植物產生的次級代謝產物,因其具有特殊的化學結構,能夠對光線造成反射、干涉、散射或吸收等效果,而呈現出不同的顏色。雖然色素本身不是蛋白類物質,但其合成受到色素生成酶的嚴格控制,因此可以作為合成生物學細胞傳感器的報告元件。與熒光蛋白報告元件相比,微生物色素報告元件產生的輸出信號是人類肉眼可見的,因此更適合用于可視化細胞傳感器的開發。常見的微生物色素包括類胡蘿卜素[46]、黑色素[47]、靈菌紅素[48]、紫色桿菌素[49]、靛藍素[50]等。色素報告元件的性能,取決于傳感器底盤細胞中底物的存在情況,由底物到產物所需的基因元件數量,從底物到產物顏色變化在視覺上的顯著性等。
2.5 氣體報告元件
對于不透明的樣品,如土壤、谷物等,較難利用光學報告元件進行檢測,故近年來出現了以氣體的生成作為輸出信號的全細胞生物傳感器,由于氣體可以自發集中到檢測體系的頂空,因此無論在透明介質還是不透明介質中均可應用。常見的氣體報告元件[51]如norB基因(催化生成一氧化二氮)、efe基因(催化生成乙烯)[52]、mht基因(催化生成鹵甲烷)[53]、dsr基因(催化生成甲硫醇)。
2.6 磁小體(magnetosome)
1975年,美國人R.P.Blakemore 首次發現了一類運動方向能隨外加磁場極性改變而變化的細菌,并將其命名為趨磁細菌(magnetotacitic bacterium)。隨后科學家陸續發現多種類型的趨磁細菌,發現它們細胞內都含有生物膜包被,單磁疇級晶體鐵磁顆粒,稱為磁小體。目前磁小體尚不能在大腸桿菌等工程菌株中表達,若隨著磁小體生成機制的深入研究[54],這一技術瓶頸得以突破,則可以將大部分基因整合到大腸桿菌基因組上進行組成型表達,將少數幾個關鍵基因作為信號輸出元件進行誘導表達。當靶標物質存在時,傳感器細胞能產生完整的磁小體,從而釋放磁信號,通過檢測磁性強弱,反映靶標物質的濃度。
2.7 冰核蛋白
自然界存在一類細菌能在-5℃--2℃誘發植物細胞水結冰而發生霜凍,這類細菌稱為冰核細菌。冰核細菌能產生一種特殊的蛋白質,具有特定的重復序列,可以使水分子排列成冰核,進而形成規則、細膩和微小的冰晶,這類蛋白被稱為冰核蛋白。冰核蛋白報告元件提供了一種延時檢測的方法。由于冰核蛋白結構比較穩定,保存時間較長,故可以將產生冰核蛋白的過程與檢測冰核蛋白的過程進行分離。冰核蛋白報告元件的優點是將對樣品物性的要求降到最低,缺點是檢測過程比較繁瑣,且無法實現動態實時監測[55-56]。
2.8 Curli蛋白
大腸桿菌和沙門氏菌(Salmonellaspp.)的生物膜中含有名為Curli 的功能性淀粉樣蛋白,它們可以在細胞外自組裝成納米級纖維蛋白。研究表明,Curli 和類似的功能性淀粉樣蛋白是一種關鍵性生物膜成分,能夠促進基底的黏附、生物膜的結構強化和宿主細胞的入侵。Tay 等[57]利用特異性響應汞離子的轉錄因子MerR 控制curli基因的表達,構建了檢測汞離子的全細胞生物傳感器。該傳感器細胞與樣品進行孵育后,上清的OD 值與汞離子濃度呈現負相關性。
3 基于合成生物學的食品安全檢測基因回路
感應元件和報告元件通過基因表達調控的方式相偶聯,即可構建成為簡單的細胞傳感器基因回路(圖2),用于單一靶標物質的直接檢測。若要實現細胞傳感系統的信號放大、多元檢測、延時報告等復雜功能,則需要借助于其他功能元件或由幾個相關功能元件組成的完成某一任務的功能模塊,構建成為復雜的細胞傳感器基因回路。合成生物學理論和技術的發展,正是推動簡單基因回路向復雜基因回路演進的主要動力。
3.1 信號放大
合成生物學細胞傳感器在檢測各種食品污染物方面具有很大的潛力,然而細胞傳感器的檢測限通常較高,檢測時間較長,常常不能滿足實際需要。為了解決這個問題,在基因回路中加入模式化的信號放大模塊是一種有效的方案(圖2-A),能夠將檢測限降低2-3 個數量級,并且也可以在一定程度上提高檢測速度。
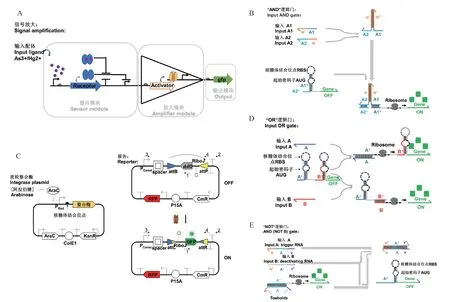
圖2 合成生物學細胞傳感器的基因回路Fig.2 Gene circuits of whole-cell biosensors in synthetic biology
3.1.1 基于轉錄因子疊加的放大信號 Karig 等[58]為了放大qsc 啟動子對酰基高絲氨酸內酯(AHL)的響應,使Placlq啟動子控制rhlR基因的表達,高效的cl(LVA)抑制基因置于qsc 啟動子的下游,同時λP(R-O12)啟動子控制熒光報告基因的表達,將這三部分基因回路進行串聯,構建信號放大基因回路。當外源性C4HSL 擴散到細胞內并與rhlR基因表達的RhlR 受體蛋白結合,C4HSL/RhlR 復合物激活qsc 啟動子,導致Cl 蛋白的產生,Cl 蛋白會調控基因eyfp的表達水平。
3.1.2 基于正反饋回路的信號放大 反饋可以放大對誘導劑的響應,并產生二進制輸出和滯后,是許多基因回路調節中常用的機制。正反饋也被用來增強細胞和組織特異性啟動子的轉錄活性,為增強基因表達提供了一種方法。例如,Sayut 等[59]利用人工正反饋環(PFLs)來實現信號放大,作者利用LuxR 在高濃度的3-氧-己酰高絲氨酸內酯(OHHL)存在下可以激活PluxI 啟動子,構建了正反饋的基因回路。在基因回路中,外源添加的OHHL 會導致LuxR 激活PluxI 啟動子,從而導致LuxR 和gfpuv 的表達,而LuxR 表達的增加進一步增強了PluxI 啟動子的活性,導致正反饋,從而增強了弱啟動子的反應實現了信號放大。
3.1.3 通過信號串聯實現信號放大 使用核糖開關在大腸桿菌的敏感菌株和報告菌株之間啟動信號傳遞,與核糖開關直接控制熒光表達相比,增加了配體結合產生的熒光量。例如,Goodson 等[60]使用一個核糖開關調節信號分子C4,該分子可被“放大器”細胞類型的啟動子(“PRhl”)檢測,激活綠色熒光蛋白的表達。與核糖開關直接控制熒光表達相比,增加了配體結合時產生的熒光量。
3.1.4 基于質粒拷貝數核糖開關信號放大 控制質粒的拷貝數可以增強熒光信號。Dwidar 等[61]設計并構建了一個雙核糖開關質粒,在單個質粒上引入兩個配體激活的核糖開關,對相同的配體作出反應。一個核糖開關控制目的基因,另一個控制質粒復制,配體的加入導致目的基因的表達量增多以及質粒拷貝數的增加,從而使核糖體開關在基因表達的動態范圍內表現出顯著的改善。
3.1.5 利用幾種方式集合的方法構建信號放大系統 例如,Wan 等[62]通過3 種方法聯合開發了一種新穎的模塊化傳感器信號放大方法,設計了超靈敏的砷和汞細胞傳感器,將檢測限和輸出分別提高了5 000 倍和750 倍,第一種方法是調節傳感模塊中的細胞內受體蛋白密度,以增加傳感器的靈敏度,即改變感應元件中組成型啟動子(PC)的強度,受體蛋白的密度由PC啟動子的強度決定(啟動子越弱傳感器的靈敏度越高,動態范圍越大),且受體蛋白與配體結合后將抑制同源啟動子PR的表達,抑制綠色熒光蛋白的產生;第二是在計算模塊中設計一個高增益轉錄放大器,該放大器放大來自PR啟動子的傳感器信號,從而增加檢測范圍;第三種方法是串聯多個這樣的放大器來放大傳感器信號并進一步提高了傳感性能。
3.2 邏輯計算(邏輯門)
多元靶標檢測是細胞傳感器的發展趨勢之一。當一個細胞傳感器檢測多個靶標時,可以構建并行檢測通道,即每一種靶標對應一種信號報告元件;也可以進行信號整合,即將多個靶標的檢測結果,通過邏輯運算整合成一個報告信號。實現邏輯運算的模塊被稱為邏輯門,常見的邏輯門包括與門(AND Gate)(圖2-B),或門(OR Gate)(圖2-D),非門(NOT Gate)(圖2-E),或非門(NOR Gate)等。與門的運算規則為當所有靶標均為陽性時產生報告信號,或門的運算規則為所有靶標中任意一個為陽性即產生報告信號,非門的運算規則為檢測靶標均為陰性時產生報告信號,或非門為所有靶標均為陰性時產生報告信號。合成生物學利用核糖開關、轉錄因子、重組酶等元件構建了基因線路的邏輯門模塊,可以實現細胞傳感器多元靶標檢測時的邏輯運算及信號整合。
3.2.1 基于核糖開關的邏輯門 RNA 工程系統為許多生物體的基因表達提供了簡單而通用的控制,其中核糖開關的設計和實現提供了一個獨特的機會來操縱順式反應器中的任何報告裝置,以低代謝成本執行嚴格的時間和空間控制。這種由核糖開關調節的設備組裝成高階遺傳電路,可以有效地處理邏輯運算。核糖開關即設置特定的RNA 序列,使其可以形成特定環狀結構,此結構可以與一些抗生素進行結合從而不再與核糖體結合,從而阻止了翻譯的進行。例如,Schneider 等[25]采用了著名的ROC 分析,并推導出了一種新的邏輯門性能指標。從新霉素和四環素結合核糖開關開始,設計了一個能夠傳遞NOT 和NOR 邏輯行為的阻遏門。單個輸入對應于NOT 邏輯;將兩個核糖開關進行“串聯”形成NOR邏輯門。當四環素和新霉素分子不存在時可以結合核糖體進行翻譯表達綠色熒光蛋白,四環素和新霉素存在一種以上都不能結合核糖體不表達綠色熒光。
3.2.2 基于復合型轉錄因子的邏輯門 原核生物中存在一些由不同組分組裝構成的復合型轉錄因子,如異源二聚體轉錄因子以及某些需要伴侶組分的轉錄因子。將不同靶標物質對應復合型轉錄因子的一種組分的表達,即可構建AND 型邏輯門。例如,Moon 等[65]利用InvF 轉錄因子及其伴侶蛋白SicA構建了AND 邏輯門。InvF 轉錄因子及SicA 單獨存在時均不具有開啟報告元件基因表達的能力,但二者同時存在時,可以組裝形成轉錄因子復合物,結合到相應的啟動子上開啟報告元件基因的表達。將兩種靶標物質分別控制InvF 和SicA 的表達,即可形成只有在兩種靶標物質同時存在時才會產生報告信號的AND 邏輯門細胞傳感器。
3.2.3 基于Toehold 的邏輯門 Green 等[63]設計了一種轉錄因子的邏輯門模型“核糖計算”系統。由全新設計的部件組成,通過可預測和可設計的堿基配對規則運行,減少擴散介導的信號損失,降低代謝成本,并提高電路可靠性。其將RNA 設計為環狀結構不夠緊密的“發卡”結構,而可以與環中一段RNA 完全互補配對的一段RNA 稱為反義RNA,有反義RNA 存在時設計的RNA 不形成環狀結構而與其結合表達熒光信號。將幾種環狀結構“串聯”即可形成OR 邏輯門,將其“并聯”即可形成AND 邏輯門,添加兩段方向相反的反義RNA 即可組成NOT邏輯門。
3.2.4 基于熒光適配體劈裂的邏輯門 Alam 等[66]提出了二進制“Split-Broccoli”系統作為一個獨立的RNA 邏輯門,并作為一個監測RNA 的設備在體內進行RNA 雜交。Split Broccoli 是第一個在體內運行的功能性分裂適體系統。Split-Broccoli 系統的兩條自主RNA 鏈被指定為頂部和底部。這兩條鏈都不包含形成功能性西蘭花單體所需的完整序列,而且都不會折疊成類似功能性單體的二級結構。以這種方式設計分裂花椰菜系統,其中只有在存在兩條或兩條底部鏈(輸入)的情況下,才能激活,從而創建一個能夠完全作為RNA 執行和報告邏輯操作的“AND”門。
3.3 記憶元件
基于合成生物學的記憶元件的構建一般有兩種方式(圖2-C),例如Kotula 等[67]使用了最常見的一種實現方式,一個切換開關,其中阻遏器抑制彼此的表達,一個記憶狀態對應于一個阻遏器的支配,維持記憶狀態的反饋回路需要連續使用能量和材料來進行轉錄和翻譯,類似于電子電路中的易失性記憶;第二種方法是利用重組酶結合兩個識別位點,并將中間的DNA 轉化,對應于這兩個方向的狀態即使在細胞死亡后也會保持。例如Yang 等[64]用不可逆的大型絲氨酸噬菌體(LSTP)整合酶,該整合酶參與介導噬菌體在其同源識別位點——attB(細菌)和attP(噬菌體)之間整合和切除到細菌基因組中,通過LSTP 整合酶切割、旋轉和重新連接DNA,將這些位點放置在相反的方向上,使位點之間的區域反轉,構建了一個能夠記錄211(2 048)種狀態組合(1.375 bytes 的信息)的存儲陣列。
4 基于合成生物學的食品安全檢測系統及商業化呈現形式
微生物細胞易于培養,繁殖迅速,代謝相對簡單,因此現階段微生物細胞是合成生物學細胞傳感器的主要細胞類型。近年來,受到無細胞蛋白表達系統的啟發,合成生物學“無細胞”(Cell-Free)或稱“擬細胞”生物傳感器被開發出來,利用細胞破碎液、細胞抽提液或人工配制的細胞模擬液作為合成生物學基因回路的工作環境。
4.1 微生物細胞傳感系統
工程化大腸桿菌基因背景清楚,質粒工具和基因編輯工具豐富,生長迅速,培養成本低,相對安全。基因組簡化的大腸桿菌可以進一步減少背景基因的干擾,降低潛在的安全風險,提高細胞傳感器的工作效率[68]。大腸桿菌的生存環境較為廣泛,在一般的樣品環境下可以完成檢測功能,但在一些較為特殊的檢測環境,或者對食品安全性要求較高的檢測環境下,大腸桿菌并非最佳選擇。選用樣品中原始存在的菌株作為傳感器的底盤細胞,可能更加有利于檢測結果的穩定性和準確性。(1)在土壤樣品的污染物檢測中,除了大腸桿菌,還可以選用一些土壤原生菌株,包括農桿菌[56]、希瓦氏菌[53]、假單胞菌[69]、腸桿菌[55]、羅爾斯通氏菌[70]等。(2)在發酵產品的原位實時檢測中,可以選用發酵菌株,如莽草酸發酵過程中利用谷氨酸棒狀桿菌(Corynebacterium glutamicum)構建細胞傳感器[71],麥納醌發酵過程中利用枯草芽孢桿菌(Bacillus subtilis)構建細胞傳感[72],柚皮素發酵過程中利用釀酒酵母(Saccharomyces cerevisiae)構建的細胞傳感器[73]。
4.2 擬細胞傳感系統
擬細胞傳感系統的建立主要涉及細胞破碎以獲取細胞提取液的過程,常見的細胞破碎方法包括冰浴超聲破碎、球磨破碎、液氮破碎、電激破碎等。在破碎后的提取液中,加入人工構建的帶有合成生物學基因回路的質粒以及必要的補充物質,即可構建成擬細胞傳感體系[74]。與微生物細胞傳感系統相比,擬細胞傳感系統打破了細胞界限,突破了細胞壁和細胞膜的限制,這為其帶來了以下的優勢:首先,省去了待測靶標物質穿過細胞壁和細胞膜的過程,提升了檢測效率;其次,可以更容易地實現對檢測體系離子環境的調控,對于某些在細胞內較難應用的生物元件或方法,如體外篩選的適配體、細胞內易被降解核酸元件,以及基于聚合酶鏈式反應(polymerase chain reaction,PCR)、CRISPR-Cas9 的交叉方法等[75],在擬細胞傳感系統中更加容易應用;再次,對于一些具有遺傳毒性、氧化應激毒性的有毒靶標物質,擬細胞傳感器受到的影響相對較小,毒性抗性更強。然而完整細胞體系的破壞,也導致了細胞傳感器的一些傳統優勢的喪失,如擬細胞傳感器生產成本的提升,對檢測環境變化的抵抗能力較差等。總之,細胞傳感器和擬細胞傳感器各具優勢,在今后有可能形成兩條不同的發展路線。
4.3 商業化呈現形式
基于合成生物學的細胞或擬細胞傳感器具有成本低,抗干擾能力強,操作簡單,安全可靠等優勢,因此理論上很適合在食品安全現場檢測領域的應用。若要構建可商業化的現場檢測方法,必須將合成生物學細胞傳感器在一定平臺上進行呈現。可與合成生物學細胞傳感器對接的便攜式平臺有試管(圖3-A)、口罩(圖3-B、E)、手環(圖3-C)、可穿戴設備(圖3-D)、試紙(圖3-F)、芯片[76]等。大部分合成生物學細胞傳感器在研發階段是在試管中進行的,在商業化應用中,細胞或擬細胞傳感系統可以凍干后儲存在試管中,在使用時通過加水活化,加入預處理的待檢樣品進行檢測。細胞傳感器和擬細胞傳感器也可以凍干固定化在濾紙、消化纖維素膜等紙基材料中制備食品安全檢測試紙條,使用時將樣品與稀釋液混合,滴加在試紙條上進行檢測[77],與試管相比,試紙條成本更低、更加便攜和安全。最近,Nguyen 等[78]報道了將細胞或擬細胞傳感器整合到輕質、柔性底物和紡織品中,并利用這些制品做成了手環、服裝等可穿戴設備。將合成生物學細胞傳感器整合到可穿戴設備中,可以擴大其對生理狀態、疾病狀態和暴露于病原體或毒素的非侵入性監測的能力。

圖3 基于合成生物學細胞傳感器的商業化呈現形式Fig.3 Commercial presentation forms of whole-cell biosensors based on synthetic biology
5 總結與展望
5.1 合成生物學細胞傳感器面臨的挑戰
與其他食品安全快速檢測方法相比,合成生物學細胞傳感器在檢測速度上存在劣勢。以細菌為底盤細胞的傳感器從加樣到讀數約需要20 min 至數小時,而以酵母等真核微生物為底盤細胞的傳感器這一過程需要數小時至數天。這方面的技術突破需要依靠合成生物性功能核酸元件的開發與應用,例如適配體感應元件、RNA 信號放大元件、熒光適配體報告元件等。其次,合成生物學細胞傳感器作為一種轉基因微生物及其制品,環境釋放后的生物安全性需要進一步保障。在商業化現場檢測應用中,傳感器細胞的基因回路片段很難完全破壞,置于環境中存在轉移并整合到其他微生物基因組內的可能性,導致生物安全性風險。這方面的技術突破需要依靠合成生物學細胞傳感器與納米材料技術的結合。再次,合成生物學細胞傳感器在知識產權方面如何保障是其商業化過程中需要解決的重要問題。購買者在得到商業化合成生物學細胞傳感器產品后,很容易從產品中分離細胞并自行擴增培養,而不會再次購買同類產品。這方面的技術突破可以通過對底盤細胞的改造,構建需要依賴特殊營養因子的傳感器細胞,使購買者在無法得知特殊營養因子種類的情況下,無法自行擴增培養傳感器細胞。
5.2 合成生物學細胞傳感器的發展方向
合成生物學細胞傳感器未來將向著靶標多元化、功能擴展化、設計智能化的方向發展。所謂靶標多元化,即每個細胞傳感器可以檢測多種靶標物質,以此大大提高檢測效率。多元化的實現,依賴邏輯計算基因回路將多個靶標信號的整合,并且需要解決各個靶標的信號之間的串擾問題。所謂功能擴展化,即合成生物學細胞傳感器除了檢測功能外,還可以通過讓傳感器細胞表達蛋白酶、脂肪酶、植酸酶等以完成食品有機物消化功能,以及通過表達催化靶標反應的酶完成靶標轉化功能,通過這些功能擴展,可以進一步簡化合成生物學細胞傳感器所需的樣品預處理的過程。所謂設計智能化,是指通過功能基因元件數據庫,標準化元件接口,以及自動化設計工具,完成合成生物學細胞傳感器基因回路的智能化、定制化設計。

