黑曲霉寡肽酶YpsA的生化特征解析
程磊,王正祥
(天津科技大學 生物工程學院,天津,300457)
蛋白質水解物包括多肽、寡肽和氨基酸,是食品、發酵、化工、醫藥、飲料、飼料等行業的重要原料。蛋白質的水解程度與水解方式,決定了蛋白水解物的化學組成、生理活性和物化特性等。相比傳統酸堿水解制備方法,蛋白水解酶介導的蛋白質酶法水解,具有條件溫和、易于控制、產品質量高等優勢[1]。但蛋白水解酶具有水解位點選擇性和底物分子大小偏好性,單一種類蛋白水解酶對特定底物的水解作用往往具有限制性[2-3]。
MEINLSCHMIDT等[4]以多種商品蛋白酶水解大豆分離蛋白,發現其中堿性蛋白酶(alcalase)水解度最高,可達13%,此時水解產物中仍有相當比例的10~25 kDa大小組分。SCHLEGEL等[5]以9種蛋白酶水解羽扇豆分離蛋白,也發現使用堿性蛋白酶水解度最高,可達9.05%,但水解產物中仍有相當比例的10~20 kDa大小組分。GRUPPI等[6]用2種商品酶Debitrase HYW20TM和ProlyveTM分別水解乳清蛋白、酪蛋白和乳蛋白,水解前后分子質量在10 kDa以上的成分比例由70%~95%降至2%~25%,分子質量在1~10 kDa的成分比例由4%~35%升至35%~55%。ALAHMAD等[7]使用無花果蛋白酶水解鳙魚蛋白,水解度分別為13.36%、17.09%和20.15%的條件下,分子質量在1~10 kDa的成分比例由水解前的2.67%分別增至8.55%、7.69%和6.86%。ZHANG等[8]用堿性蛋白酶(alcalase)水解紫蘇粕蛋白,蛋白電泳結果顯示反應體系中主要成分由反應前的52 kDa和32 kDa兩種為主轉變為水解后的10 kDa以下為主,另有少量37 kDa和30 kDa成分。另外,胃蛋白酶(pepsin)、胰蛋白酶(trypsin)、糜蛋白酶(chymotrypsin)、嗜熱菌蛋白酶(thermolysin)、枯草桿菌蛋白酶(subtilisin)、酸性蛋白酶(acidic protease)和蛋白酶K(proteinase K)等均有被應用于寡肽制備的報道[9],從另一方面說明了蛋白水解酶對特定底物水解作用的局限性。
單一蛋白水解酶對底物水解作用的局限性表現為生成特定比例的寡肽產物,此時使用寡肽水解酶進行輔助酶解,理論上可以調節酶解的水解度,同時改變產物化學組成、生理活性和物化特性。因此,寡肽水解酶的獲得對于蛋白水解與蛋白質加工具有重要意義和關鍵價值。為此,本文對來源于黑曲霉的一種未知功能的蛋白水解酶進行分子克隆、表達與功能鑒定,進一步就其蛋白水解偏好性進行分析,為其應用于蛋白質加工和寡肽制備等奠定基礎。
1 材料與方法
1.1 菌種與質粒
黑曲霉(Aspergillusniger)CICIM F0215,為本實驗室前期分離、鑒定并保藏。大腸桿菌(Escherichiacoli)JM109和畢赤酵母(Pichiapastoris)GS115,為本實驗室保藏,分別用于本研究的重組質粒構建和酶表達宿主。質粒pPIC9k(Invitrogen),用于本研究的酶編碼基因克隆與表達的載體。黑曲霉和大腸桿菌分別采用馬鈴薯葡萄糖(potato dextrose agar,PDA)培養基和LB(Luria-Bertani)培養基進行培養[10];畢赤酵母及其重組菌的培養基及培養方法等參照畢赤酵母操作手冊(Invitrogen)進行。
1.2 主要試劑
限制性內切酶和LATaqDNA多聚酶,大連寶生物工程有限公司;T4 DNA連接酶、質粒小量提取試劑盒、TRIzol總RNA提取試劑、cDNA合成試劑盒和小量DNA產物純化回收試劑盒,Thermo Fisher公司;大豆分離蛋白,上海源葉;小麥蛋白、花生分離蛋白、豌豆分離蛋白和芝麻蛋白,江蘇銳陽;BODIPY FL Ester,Invitrogen;苯甲基磺酰氟(phenylmethylsulfonyl fluoride,PMSF)、抑肽素(pepstatin)、E-64和EDTA-2 Na,Sigma公司。其他生化試劑為分析純,國藥化學試劑有限公司。
1.3 基因克隆和表達
黑曲霉總RNA提取及cDNA制備,按照試劑盒使用說明進行。基因擴增、連接、轉化與鑒定等,按照常規實驗方法進行[10]。基因擴增所用引物由生工生物工程(上海)股份有限公司合成,上游引物序列為:5′-GTACTGTCTCTCCATAAACGCGACGG-3′,下游引物為:5′-TGCTCTAGATTACAGAGCGAGAAGTAGGCCGATACC-3′(下劃線部分為限制性酶切位點)。
重組酶的發酵制備,按照畢赤酵母操作手冊(Invitrogen)所述方法進行,以甲醇誘導發酵并監測發酵液酶活力變化,至酶活力不再上升時終止發酵。離心收集發酵液上清液,制得粗酶液,再經鹽析、脫鹽、凝膠過濾色譜等進行分離純化。酶蛋白純度分析采用SDS-PAGE法,使用5%的濃縮膠和12%的分離膠,蛋白質濃度測定采用BCA(bicinchoninic acid)法[10]。
1.4 酶活力測定與酶學特征分析
1.4.1 蛋白水解酶酶活力檢測方法
蛋白水解酶酶活力檢測,依照本研究前期建立的均相檢測法進行,使用BODIPY NHS Ester標記的大豆分離蛋白作為底物[11]。基本步驟為:熒光底物(10 μg/mL)與適度稀釋的酶液分別預熱至40 ℃后各取100 μL加入微孔板,40 ℃下反應10 min,用酶標儀在激發波長500 nm、發射波長530 nm條件下檢測熒光。以底物和酶液作為對照。所測酶活力用相對熒光強度(relative fluorescence intensity,RFI)表示,計算如公式(1)所示:
RFI=FC-(FA+FB)
(1)
式中:FC,樣品熒光值;FA,底物熒光值;FB,酶液熒光值。
1.4.2 溫度和pH對酶活力的影響
溫度和pH對酶活力的影響,按照實驗室常規方法進行[12]。將酶液與底物分別置于25~60 ℃下或pH 3.0~10.0下進行酶活力測定。以酶活力最高者為100%,計算相對酶活力,確定酶的最適作用溫度和最適作用pH。
1.4.3 抑制劑對酶的特異性抑制
按1/10或1/100的添加比例,將抑制劑溶液(10 mmol/L PMSF乙醇溶液、100 μmol/L抑肽素二甲亞砜溶液、100 μmol/L E-64去離子水溶液或10 mmol/L EDTA-2 Na去離子水溶液)與適度稀釋的酶液混合,其中PMSF、抑肽素、E-64和蛋白水解酶在4 ℃孵育20 min后檢測殘余酶活力,EDTA-2 Na在4 ℃孵育6 h后檢測殘余酶活力。以不添加抑制劑的酶活力為Uc(對照),添加抑制劑后檢測的酶活力為Us,抑制劑對蛋白酶的抑制率(I)計算如公式(2)所示:
(2)
1.5 酶底物偏好性分析
采用酶法分別對小麥蛋白、花生分離蛋白、豌豆分離蛋白和芝麻蛋白進行水解,制備獲得不同水解度的水解物[13]。以此為底物,按照上述酶活力測定分析重組酶對其水解作用,底物質量濃度為10 g/L,反應條件為40 ℃和pH 7.0。
1.6 生物信息學分析方法
黑曲霉基因組信息,參照A.nigerCBS 513.88基因組序列(美國國立生物技術信息中心);序列比對分析使用在線分析程序BLAST(https://blast.ncbi.nlm.nih.gov/Blast.cgi)進行;信號肽分析使用在線分析程序SignalP 6.0(https://services.healthtech.dtu.dk/service.php?SignalP)進行分析;氨基酸序列比對分析使用Clustal Omega(https://www.ebi.ac.uk/Tools/msa/clustalo/)和BioEdit Sequence Alignment Editor軟件進行分析,并使用MEGA 11軟件以Neighbour-joining法構建遺傳發育樹。
2 結果與討論
2.1 黑曲霉蛋白水解酶系中存在一個未知功能的全新蛋白水解酶
黑曲霉具有極為豐富的蛋白水解酶體系,以A.nigerCBS 513.88基因組序列為參照序列,進行了黑曲霉蛋白水解酶系的分析,發現其中的XM_001396314開放讀框為一疑似天冬氨酸蛋白酶,將此讀框的編碼基因命名為ypsA,編碼產物命名為YpsA。此讀框由492個氨基酸殘基組成,其N-端含有一個由18個氨基酸殘基組成的典型Sec信號肽。其一級結構與氨基酸序列相似性分析結果顯示,YpsA與MEROPS數據庫中不同來源的天冬氨酸蛋白酶具有較高的一級結構相似性和一定的氨基酸序列相似性(圖1、圖2),并且與來自于A1A家族的幾種酶相對聚集,遺傳距離相對接近,與Q12303存在最高相似性(33.05%);而涉及不同家族來源的天冬氨酸蛋白酶的自展值大多較低(<50%),這與其氨基酸序列相似性較低(<22%)吻合。故此,初步分析結果揭示YpsA為A1A家族的新成員。
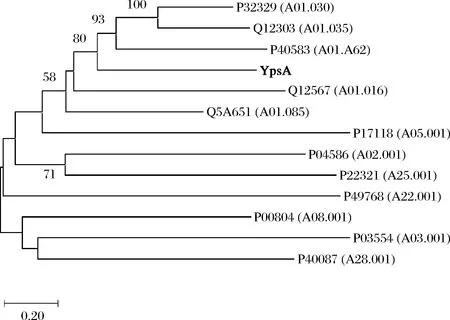
圖1 YpsA在天冬氨酸蛋白水解酶家族中的遺傳距離Fig.1 Genetic distances of YpsA in the aspartic peptidase family注:線段的長度表示用MEGA 11計算的遺傳距離;分支節點上的數字代表的是bootstrap百分比,小于50%的bootstrap值未顯示;除YpsA外,各蛋白水解酶以其在UniProt數據庫(https://www.uniprot.org/)中的登錄號表示,括號中標注為各蛋白水解酶在MEROPS數據 庫(https://www.ebi.ac.uk/merops/)中的家族分類號

圖2 天冬氨酸蛋白水解酶不同家族成員的氨基酸序列比對與結構分析Fig.2 Multiple sequence alignment and primary structure analysis of different aspartic peptidases注:“*”指示保守的氨基酸序列;“:”指示保守的替換;“.”指示半保守的替換;序列中的“-”代表空格;信號肽以陰影進行標注;活性位點以實線方框標出;N-端保守的色氨酸和酪氨酸殘基用虛線方框標出
進一步分析YpsA一級結構組成序列特征(圖2),發現已報道的5種A1A家族成員均具有該家族典型的4個基序,分別是組成第1個ψ環的Asp-Thr-Gly與Gly-H-H-Gly(H為疏水性氨基酸),以及組成第2個ψ環的Asp-Thr-Gly與H-H-Gly-Asp/Gln/Asn[14-15]。YpsA在序列對應位置也具有全部4個基序,其中第2和第4個基序分別為Gly-Ile-Ala-Gly和Leu-Leu-Gly-Asp。天冬氨酸蛋白酶在多肽鏈N-端具有高度保守的酪氨酸殘基位點和相對保守的色氨酸殘基位點[14],通過比對可知,這2個位點在YpsA中分別為Trp86和Tyr218。除此之外,進行比對的6種天冬氨酸蛋白酶的氨基酸序列,還在其他多個位點具有保守的、保守替換的或是半保守替換的氨基酸殘基,顯示其具有較高的一級結構相似性,可初步確認YpsA的催化活性中心組成為Asp79和Asp274[15]。
2.2 ypsA基因克隆、異源表達及生化特征
基于以上分析,黑曲霉YpsA極有可能是一未知功能的天冬氨酸蛋白酶。為此,進一步通過cDNA克隆技術對其進行克隆與表達。通過提取A.nigerCICIM F0215的總RNA并反轉錄制備cDNA,以此cDNA為模板設計核苷酸引物,對其成熟肽編碼序列進行擴增并克隆入表達載體pPIC9K中,獲得了重組質粒pPIC-ypsA。經核苷酸序列測定與分析后發現,所克隆的ypsA核苷酸序列與A.nigerCBS 513.88中相應序列完全一致。
進一步將線性化后的重組質粒pPIC-ypsA電擊轉化入畢赤酵母GS115,并通過G418抗性平板篩選獲得轉化子Pp-YpsA。按照畢赤酵母操作手冊中的方法進行搖瓶發酵與酶液制備,經96 h發酵后,發酵液中重組酶的酶活力達到1 034 386 RFU/mL,進一步純化獲得重組YpsA用于后續酶學性質等分析。
在不同溫度和不同pH下,分析了重組YpsA的最適作用pH和溫度,結果如圖3所示。YpsA在40 ℃和pH 7.0的條件下表現出最高酶活力,并且YpsA能夠在相對較寬的溫度(30~50 ℃)和pH(pH 4.5~9.5)下呈現高活性(相對酶活力>50%)。YpsA的基礎酶學性質與來自釀酒酵母的天冬氨酸蛋白酶Yapsin1和YAP3有明顯差異,后者的最適作用pH分別為4.5~5.5和4.0~4.5,并且較窄pH范圍內(分別為pH 4.3~6.0和pH 3.8~5.3)保持50%以上的相對酶活力[16-17]。YpsA與白色念珠菌(Candidaalbicans)中10種天冬氨酸蛋白酶的酶學性質也存在較大差異,后者的多數天冬氨酸蛋白酶最適作用pH介于3.0~5.0,僅其中的Sap7最適作用pH為6.5,且在pH 4.8~7.3保持50%以上的相對酶活力[18]。此外,現有研究多認為天冬氨酸蛋白酶是酸性蛋白酶的代表,而本研究鑒定獲得的來自于黑曲霉的天冬氨酸蛋白酶YpsA,具有中性最適作用pH并具有較為寬泛的高活性pH范圍。可見,中性天冬氨酸蛋白酶在自然界中是存在的,并且可能發揮重要的生理作用。因此,隨著研究的深入,天冬氨酸蛋白酶作為酸性蛋白酶代表的認知可以獲得進一步完善。此外,中性天冬氨酸蛋白酶這一特征,也有可能使其更便于在特定蛋白質生物加工過程的應用。
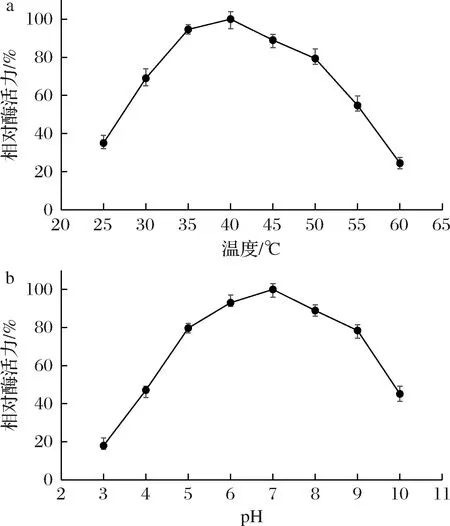
a-溫度對酶活力的影響;b-pH對酶活力的影響圖3 溫度和pH對YpsA活性的影響Fig.3 Effects of temperature and pH on the activity of YpsA
按照現行蛋白水解酶的分類原則,蛋白水解酶可根據其活性中心位點類別進行區分,除天冬氨酸蛋白酶家族外,還包括絲氨酸蛋白水解酶、半胱氨酸蛋白水解酶、金屬蛋白水解酶等家族。不同家族蛋白水解酶的催化活性可被不同種類的抑制劑特異性抑制,因而可使用抑制劑對蛋白水解酶進行家族分類[19]。為此,本研究進一步分析和檢測了不同蛋白酶抑制劑對YpsA活性的抑制作用,結果顯示,抑肽素對YpsA具有強烈抑制作用,而PMSF、E-64和EDTA對YpsA活性幾乎沒有抑制作用(圖4)。已知抑肽素是一種緊密結合的可逆抑制劑,其結構類似催化反應過程中的四面體中間體,對蛋白水解酶A1和A2家族有特異性抑制作用[20]。依據本實驗結果,并結合上述結構特征分析,可以確定黑曲霉來源的YpsA是一種天冬氨酸蛋白酶。
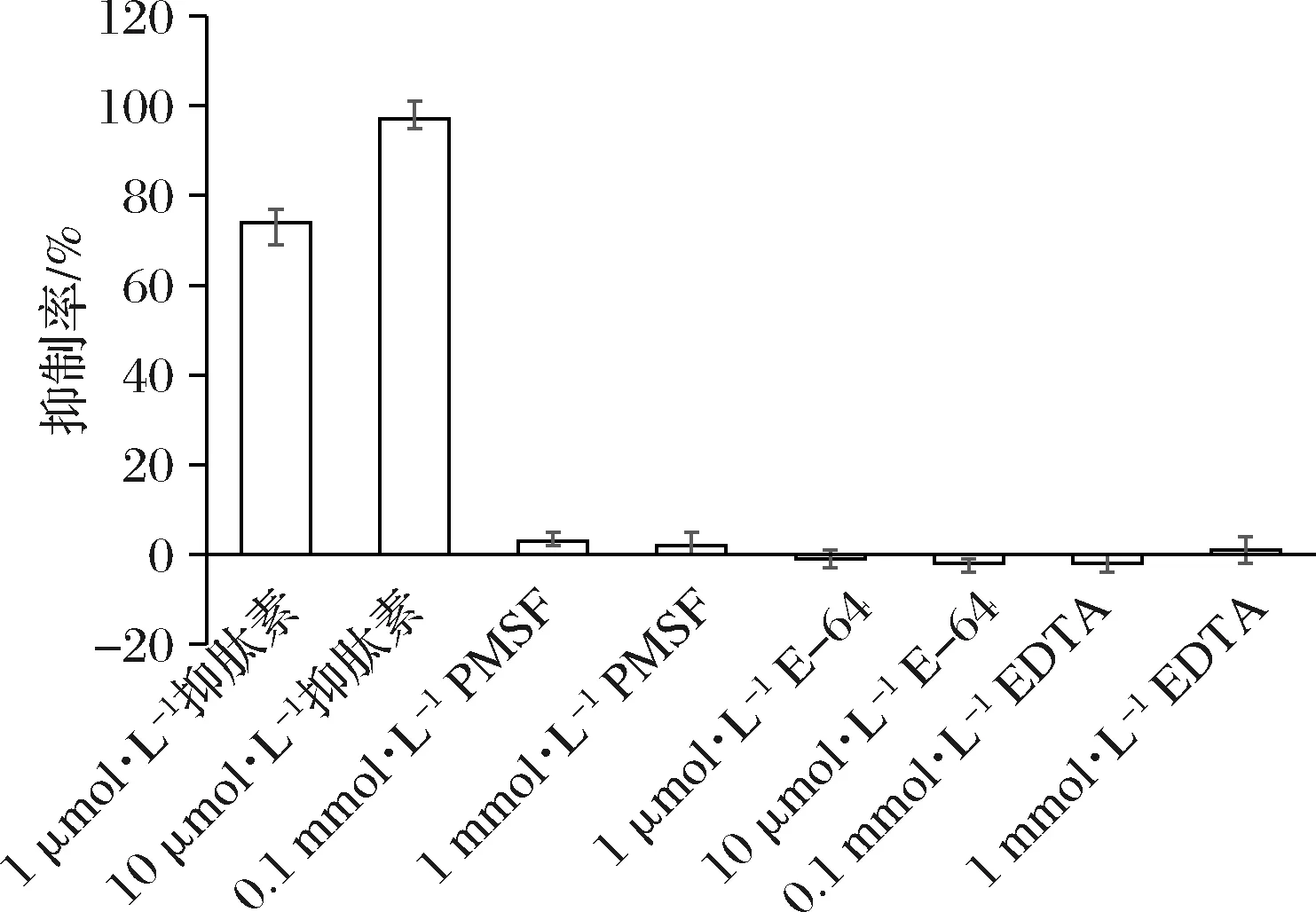
圖4 蛋白酶抑制劑對YpsA活性的影響Fig.4 Effects of different protease inhibitors on the activity of YpsA
2.3 重組酶YpsA水解不同底物特征
已有研究揭示,天冬氨酸蛋白酶具有酸性pH條件下的高活性和穩定性,其被應用于多個重要的工業領域,特別是在食品行業,如在乳制品行業的奶酪加工中用作牛奶凝固劑,在果汁或釀酒工業中用于澄清,在部分食品中用作增味劑等,而特定酶的適合應用場景取決于其催化特征[15]。在上述研究中發現,YpsA的最適作用pH為中性,有效作用pH寬度也與現有報道的大多數天冬氨酸蛋白酶有較大差異。因此,YpsA應該具有獨特的蛋白水解特征。為此,分別使用5種植物來源的蛋白、多肽、寡肽作為底物,進一步對YpsA的水解特征進行了分析,結果匯總于圖5。可以看出,YpsA對低分子質量的寡肽(0.45~1.45 kDa)具有相對高的活性,而對所測試的大豆蛋白、小麥蛋白、豌豆蛋白、花生蛋白和芝麻蛋白及其多肽制備物(1.45~12.5 kDa)的水解活性皆較低。可見,YpsA對由5~15個氨基酸殘基組成的低分子質量寡肽具有水解偏好性,是一種新型天冬氨酸寡肽酶。
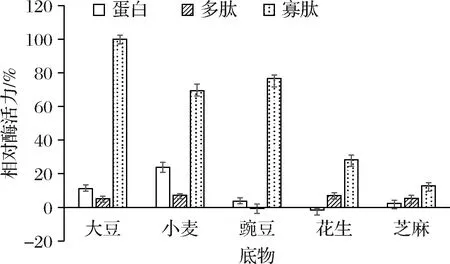
圖5 YpsA作用于不同底物的活力特征Fig.5 Relative activities of YpsA on different substrates
3 結論
通過分子克隆、功能鑒定與分析,確認了黑曲霉YpsA為一新型中性天冬氨酸寡肽酶,具有相對更寬泛的最適作用pH范圍,在蛋白質生物加工和寡肽制備中可能具有特殊的應用價值。

