環境熱應激對綿羊肉品質及血液生化指標的影響
王 玥,王維婷,白秀玉,李 強,杜鵬飛,柳堯波,馬艷麗,胡 鵬,李騰飛
(1.河北工程大學生命科學與食品工程學院,河北 邯鄲 056038;2.山東省農業科學院農產品與營養加工研究所,山東省農產品精深加工技術重點實驗室,農業農村部新食品資源加工重點實驗室,山東 濟南 250100;3.濟南市畜牧技術推廣站,山東 濟南 250306)
動物肌肉品質受多種因素影響[1-4],其中品種和養殖環境是引起差異的主要因素[5-6]。近年來,研究者關注到養殖環境條件控制與優質肉生產之間有著密不可分的關系[7],其中,熱應激對畜禽肌肉品質影響成為研究熱點。
當環境長時間保持高溫、高濕,畜禽依靠行為反應無法有效達到降溫效果時,便會陷入熱應激帶來的不利影響中,其體內會通過調節激素的分泌來降低代謝水平,以起到促進散熱和減少產熱的效果[8]。但與此同時,這種代謝水平變化不僅影響畜禽免疫水平,還會導致畜禽生長速度減緩和生產率降低,也會造成肉品質下降[9-10]。
甄少波等[11]研究顯示,高溫天氣下豬肉的保水性顯著降低,滴水損失和蒸煮損失遠高于秋冬季節時的豬肉;馮京海[12]的研究結果顯示,循環高溫會導致雞肉品質下降,包括pH值降低引起的酸味、滴水損失和剪切力增加引起的嫩度下降等;Imik等[13]研究發現,暴露于熱應激(34~41 ℃)的肉雞,雞肉的氧化應激、蛋白質和脂肪氧化增加,產品貨架期縮短;Kadim等[14]的研究也顯示高溫天氣下牛肉的肉色更為黯淡,pH值和剪切力均有所下降。但目前的研究主要集中于豬、牛等家禽動物上,對綿羊的研究較少。
隨著人民群眾生活水平的提高,我國羊肉生產量和消費量呈現出快速增長的發展趨勢[15],同時消費者也開始注重肉的品質和風味。我國大宗羊肉的生產及流通以綿羊為主,其中主要肉羊品種有:湖羊、小尾寒羊、杜泊羊等品種及雜交羊[16-17],魯中肉羊是以湖羊和南非白頭杜泊羊為親本培養的新品種肉用綿羊,具有生長速度快、繁殖率高、屠宰率高、肉質好、耐粗飼、性情溫和等一系列優點[18]。本研究以魯中肉羊為研究對象,通過人工控溫創造適宜環境與應激環境,研究熱應激對綿羊肉品質的影響,為綿羊在北方高溫地區的養殖和屠宰加工提供一定理論依據。
1 材料與方法
1.1 材料與試劑
自山東省萊蕪嬴泰農牧科技有限公司(魯中肉羊育成單位)選取8 月齡、健康無病、體質量均勻的公羊12 只。
促甲狀腺激素釋放激素(thyrotropinreleasing hormone,TRH)、三碘甲狀腺原氨酸(triiodothyronine,T3)、甲狀腺素(thyroxine,T4)、免疫球蛋白A(immunoglobulin A,IgA)、IgM、IgG、白細胞介素4(interleukin 4,IL-4)、促腎上腺皮質激素(adrenocorticotropic hormone,ACTH)、腎上腺素(epinephrine,EPI)、皮質醇(cortisol,Cor)、胰島素(insulin,Ins)酶聯免疫吸附實驗(enzyme-linked immunosorbent assay,ELISA)試劑盒 上海酶聯生物科技有限公司;尿素氮(urea nitrogen,BUN)、肌酐(creatinine,CR)、肌酸激酶(creatine kinase,CK)、乳酸脫氫酶(lactate dehydrogenase,LDH)檢測試劑盒浙江美康生物科技有限公司。
1.2 儀器與設備
DW-86L416G超低溫冰箱(-80 ℃) 中國海爾公司;DK-88恒溫水浴鍋 上海精宏實驗設備有限公司;MC-15k微型高速離心機 浙江佑寧儀器有限公司;BSA124S-CW分析天平 德國賽斯多利斯公司;7180生化分析儀 日本日立公司;Milli-Q IQ7000超純水凈化裝置 美國默克密理博公司;CR-400色彩色差計日本柯尼卡美能達公司;TA.XT-Plus質構儀 英國Stable Micro Systems公司、FE-plus pH計 瑞士梅特勒-托利多公司;FSH-2A可調高速勻漿機 山東函優生物科技有限公司。
1.3 方法
1.3.1 實驗羊只處理
將實驗羊只分為應激組與對照組,每組6 只,適應性飼養期間保持通風,使用風扇和噴淋保持羊舍溫度處于正常范圍內,為期14 d。實驗期間飼喂使用的飼糧根據NY/T 816ü2021《肉羊營養需要量》[19]進行配制,飼糧營養水平和配方組成如表1所示。

表1 飼糧配方Table 1 Ingredients and nutrient composition of experimental diet
適應期結束后調整應激組羊舍溫濕度,使其達到熱應激水平,進行為期3 d的熱應激刺激,對照組保持正常飼養管理。實驗期間2 組實驗羊只均保持自由采食與飲水。熱應激刺激完成后,于第4天晨間進行屠宰,宰前禁食12 h、禁水3 h。
熱應激第3天分別于8:00、14:00、22:00時采集實驗羊只頸靜脈血,使用移液器將采集血液轉移到離心管中,于常溫4 000 r/min條件下離心15 min,收集上清血漿部分,防止下層血細胞混入,將收集到的血漿置于-80 ℃低溫冰箱備用。
實驗動物屠宰后,取一側背最長肌于現場進行肉品質各項數據檢測;其余樣品帶回實驗室于4 ℃冷庫貯藏,用于后續檢測。
1.3.2 環境溫濕度檢測及熱應激狀態判斷
將溫濕度檢測儀懸掛于羊舍中心位置,離地約1.5 m以保障數據采集準確性及防止羊群損壞儀器。在14 d適應期和3 d刺激期內于每天8:00、14:00、22:00進行記錄。使用溫濕度指數(temperature humidity index,THI)判斷羊只是否處于熱應激狀態。THI按式(1)計算:
式中:T為干球溫度/℃;RH為畜禽所處環境的相對濕度/%。
1.3.3 綿羊肉品質測定
根據NY/T 2793—2015《肉的食用品質客觀評價方法》[20],對實驗羊只的滴水損失、蒸煮損失、pH值、肉色和剪切力進行檢測,每個檢測項目設置3 個平行以保證實驗結果的可靠性。其中pH值、肉色和剪切力結果為儀器顯示的直接檢測值。滴水損失率和蒸煮損失率均按式(2)計算。
式中:m1為處理前肉塊質量/g;m2為處理后肉塊質量/g。
1.3.4 感官評價
根據GB/T 22210ü2008《肉與肉制品感官評定規范》[21],挑選12 名(其中6 名女性、6 名男性)具有食品專業基礎人員對樣品進行感官評價。實驗選擇脖頸部位進行烹飪,烹飪方法為清水煮制,不添加任何調味料。采用盲評方式進行評價,評價結果取平均值。感官評價標準如表2所示。

表2 感官評價標準Table 2 Criteria for sensory evaluation of cooked sheep meat
1.3.5 肌肉纖維結構測定
將烹飪后的肌肉樣品切成5 mmh5 mmh15 mm立方體,使用體積分數3%戊二醛溶液固定,固定完成后置于干冰中貯藏,委托北京中科百測有限公司進行掃描電鏡檢測。
1.3.6 酶聯免疫分析
根據試劑盒說明書對TRH、T4、Cor、EPI、Ins、T3、ACTH、IgA、IgG、IgM和IL-4進行ELISA,使用酶標儀對其含量進行檢測。
1.3.7 血液生化分析
使用全自動生化分析儀對BUN、CR、CK和LDH含量進行測定。
1.4 數據處理
使用WPS表格軟件對實驗中獲得的各項數據進行整理并制表,結果表示為平均值±標準差。使用SPSS 22.0軟件對數據進行單因素方差分析和多重比較,其中多重分析使用Duncan’s法進行,將顯著性水平設置為0.05,分析2 組之間各項數據的差異顯著性。
2 結果與分析
2.1 環境溫濕度檢測結果
施加應激期間于羊舍測定早、中、晚不同時間點環境THI,用于判斷環境條件是否達到熱應激標準,結果如表3所示。綿羊熱應激判斷標準為:THI<72為無熱應激;72<THI<78為輕度熱應激;78<THI<88為中度熱應激;THI≥88為重度熱應激[22]。

表3 環境THITable 3 Environmental temperature and humidity index
本研究中,適應期8:00、14:00、22:00的平均THI分別為58.89、68.31、65.30,全天平均THI為64.68,屬于無熱應激范圍。說明在適應期間,對照組與應激組均未受到熱應激影響。刺激期間,對照組養殖環境保持不變,應激組養殖環境經過調控后每天8:00、14:00、22:00的平均THI分別為81.69、82.14、76.54,說明應激組在刺激期間白天受到中度熱應激影響,夜間有所恢復,受到輕度熱應激影響;全天平均THI為80.12,總體處于中度熱應激狀態。
2.2 熱應激對綿羊肉品質的影響
由表4可知,熱應激對實驗羊只在45 min和24 h時的pH值以及蒸煮損失均無顯著影響;而滴水損失、剪切力以及在45 min和24 h時的肉色指標(L*、a*和b*)在2 組間均存在顯著差異(P<0.05),其中應激組滴水損失顯著高于對照組(P<0.05),剪切力顯著低于對照組(P<0.05)。

表4 熱應激對綿羊肉品質的影響Table 4 Effect of heat stress on the meat quality of sheep
本研究中,滴水損失結果顯示對照組較好,應激組剪切力顯著低于對照組(P<0.05)。此外,新鮮屠宰的2 組實驗羊只肉色指標均差異顯著,表明熱應激羊肉具有更好的新鮮度,但保水性較差。有研究[23]表明L*與肌肉的保水性呈負相關,肌肉保水性會伴隨著L*增加而下降;a*與肉制品新鮮度呈正相關性;b*則與a*相反,與肉制品新鮮度呈負相關,這與本研究結果不符。
為驗證初步實驗結果的準確性,進行肌肉纖維掃描電鏡分析、感官評價以及在4 ℃條件下貯藏24 h后的肉色檢測。貯藏45 min~24 h期間,應激組L*由30.19上升至35.99,變化明顯;a*由17.82下降至13.24,變化明顯;b*由5.51上升至7.86,變化明顯。對照組L*、a*、b*的變化趨勢均與應激組相同,但L*和a*變化均不明顯,僅b*變化明顯,但其變化幅度遠小于應激組。
以上結果表明,24 h貯藏后,應激組羊肉保水性大幅下降,水分流失情況嚴重。
2.3 熱應激對綿羊肌肉纖維結構的影響
由圖1可知,橫向截面結果顯示,對照組肌肉纖維平均直徑約60 μm,纖維排列緊密;應激組肌肉纖維平均直徑約60 μm,纖維排列較為松散,可以觀察到明顯的纖維間隙,寬度約10 μm。縱向截面結果顯示,對照組肌肉纖維完整且排列緊密,無纖維斷裂情況;應激組肌肉纖維排列較為松散、肌肉纖維較為完整、無斷裂情況。

圖1 綿羊肌肉纖維掃描電鏡結果Fig. 1 Scanning electron microscopy micrographs of muscle fibers in sheep meat
掃描電鏡結果顯示,應激組羊肉的肌肉纖維排列松散,可以觀察到明顯的間隙;對照組肌肉纖維則排列較為緊密,排列松散的肌肉纖維更容易被切斷,因此應激組得到了更低的剪切力數據。生物體內的水分分為結合水、不易流動水和自由水3 部分,在肉類貯藏期間,最先發生流失的水是存在于細胞組織間隙中的自由水[24],應激組肌肉組織間隙的存在會導致自由水的流失速度大幅增加,降低保水性,此結論與貯藏24 h后的羊肉肉色檢測結果一致。
2.4 熱應激對綿羊肉感官評價結果的影響
由圖2可知,應激組與對照組之間外觀和氣味并無顯著差異,且評分均在4 分以上;口感和多汁性組間存在極顯著差異(P<0.01),對照組分別為3.75和4.06,高于應激組的2.63、2.81;風味組間存在顯著差異(P<0.05),對照組風味得分略高于應激組;異味方面應激組與對照組差異極顯著(P<0.01),大部分參與測試者均表示在應激組樣品中可以感受到明顯酸味,而對照組沒有。

圖2 羊肉感官評價結果雷達圖Fig. 2 Sensory evaluation radar plots of cooked sheep meat
感官評價結果同樣驗證了應激組與對照組之間的差異,口感與多汁性評分顯著下降說明應激組羊肉中水分流失嚴重,明顯的異味說明應激組羊肉的新鮮度遠低于對照組。在口感方面參評人員普遍認為應激組更好,由此判斷這是因為雖然肌肉纖維的松散會帶來更低的剪切力,但其導致的水分流失會產生更為嚴重的口感差距,對于消費者來說反而無法獲得更良好的食用體驗。
2.5 熱應激對綿羊血液激素水平的影響
由表5可知,在熱應激狀態下,應激組實驗羊只血液中TRH、T4、Cor含量相較于對照組在全天各時間點均顯著降低(P<0.05、P<0.01);應激組EPI、Ins含量相較于對照組在全天各時間點均極顯著上升(P<0.01);應激組T3含量相較于對照組在全天各時間點均無顯著差異;應激組ACTH含量在夜間較對照組顯著下降(P<0.05),但全天平均水平無顯著差異。
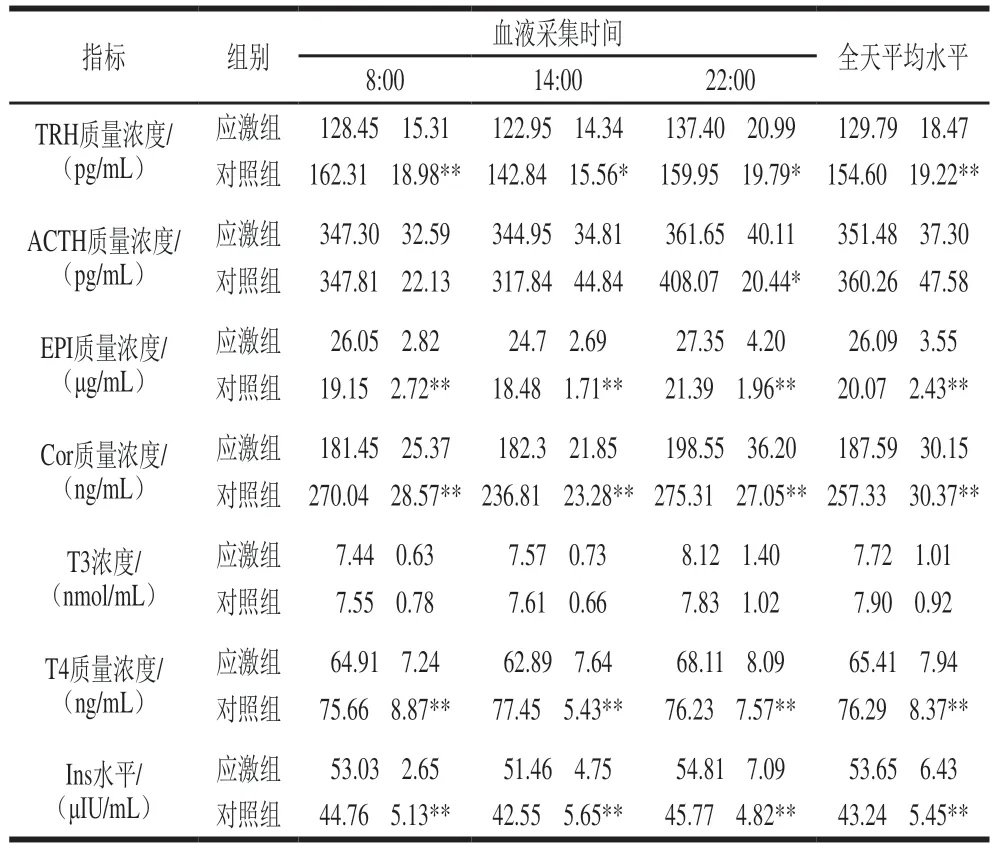
表5 綿羊血液激素水平Table 5 Blood hormone levels in sheep
2.6 熱應激對綿羊免疫水平的影響
由表6可知,熱應激狀態下,應激組IgA含量相較于對照組在全天各時間點均極顯著降低(P<0.01);應激組IgG、IgM、IL-4含量相較于對照組在全天各時間點均無顯著差異。免疫球蛋白具有抗病毒和免疫調節功能[25],不同的免疫球蛋白具有相似的結構,但各自具有不同的免疫學功能,其中IgA可以中和血液中的抗原,防止炎癥發生[26]。IgA含量降低說明熱應激狀態下實驗綿羊免疫力顯著下降,將更容易受到疾病影響。

表6 綿羊血液免疫因子水平Table 6 Blood immune cytokines levels in sheep
2.7 熱應激對綿羊血液生化水平的影響
由表7可知,熱應激狀態下實驗綿羊BUN含量應激組相較于對照組在14:00顯著升高(P<0.05),其他時間極顯著升高(P<0.01);CR含量應激組相較于對照組在全天各時間點均極顯著升高(P<0.01)。這2 種物質在動物體內主要通過腎小球進行過濾然后經由尿液排出,其含量升高意味著腎功能在熱應激影響下受到了一定程度的損傷。LDH活力應激組相較于對照組在晨間顯著降低(P<0.05),在午間和夜間無顯著差異,但全天平均水平極顯著降低(P<0.01);CK水平應激組相較于對照組在全天各時間點均無顯著差異。

表7 綿羊血液生化指標Table 7 Blood biochemical indicators in sheep
3 討 論
肉品質的評定指標包括肉色、pH值、滴水損失、蒸煮損失、剪切力等,其中肉色是評定肉品質時最直觀的指標,其優劣會直接影響消費者的選擇[27-28]。本研究中,剛完成宰殺時應激組羊肉與對照組羊肉在肉色方面并無顯著差異,但在經過24 h貯藏后,應激組羊肉的亮度顯著提高,其直觀表現是顏色更白,這種變化與PSE(pale, soft, exudative)肉的特征相似,PSE肉的特點為色澤蒼白、質地更加柔軟、保水性差,嚴重時會有液體從表面滲出[29]。掃描電鏡結果顯示,應激組羊肉的肌肉纖維排列松散,可以觀察到明顯的間隙,更容易被切斷,應激組肌肉纖維間隙的存在會導致自由水的流失速度大幅增加[24],降低了保水性,這些表現與PSE肉的性狀一致,感官評價結果也得到一致的結果。本研究中從各項指標和外觀表現來看,應激組羊肉尚未達到PSE肉的程度,但從2 組羊肉之間肉色、保水性和剪切力等指標的差異來判斷,應激組羊肉有向PSE肉發展的趨勢,
熱應激不僅影響了綿羊的肉品質,還對其生理狀態造成了極大的負面影響。本研究發現,熱應激狀態下綿羊的IgA含量顯著降低,與施力光等[30]的研究一致,表明熱應激使綿羊免疫能力出現了顯著下降;BUN和CR含量顯著升高,與劉若楠[31]、王桂超[32]等的研究結果相似。董書清[33]的研究顯示,血液BUN濃度受到生理和病理多種因素影響,生理因素主要為高蛋白飲食,但本研究中2 組實驗動物所用飼料一致,因此應為病理性升高,最可能的原因是高熱環境下實驗動物失水導致血液濃度升高引起的尿素潴留;CR則是肌酸代謝的最終產物,經腎小球濾過后不被腎小管重吸收,通過腎小管排泄出體外,在腎臟病變初期其水平通常不變化,直至腎臟受到實質性損傷時才會開始升高。因此在高溫環境下,BUN和CR含量升高表示實驗動物的腎臟功能可能受到一定損傷,如果不進行及時的應對,不僅會影響肉品質、損害消費者利益,還有可能引發家畜疾病甚至死亡,對養殖者造成巨大的經濟損失。
快速準確地判斷熱應激的發生對于應對熱應激帶來的影響至關重要,目前研究者們普遍依靠畜禽養殖環境的THI進行熱應激水平判斷[34],本研究也采用此方法,但研究者們仍進一步研究和探索可以準確反映畜禽熱應激狀態的生物標志物。熱休克蛋白(heat shock proteins,HSP)被認為是可以最有效反映熱應激程度和持續時間的標志物[35-36],其作為熱應激標志物的研究已經非常深入[37],但HSP的檢測需要的經濟和技術成本都較高,因此對其他便于檢測標志物的研究迫在眉睫。本研究通過ELISA和血液生化分析儀對2 組實驗羊只血液中7 種激素進行定量檢測,其中Ins、TRH和Cor 3 種激素的含量在熱應激狀態下出現顯著變化,可以有效反映出畜禽熱應激狀態的變化,這與童雄[38]、Petersen[39]等的研究基本一致;除此之外,相較于HSP這些激素的檢測成本更為低廉,有利于熱應激檢測的開展和推廣。因此本研究判斷Ins、TRH和Cor 3 種激素可作為生物標志物用于綿羊熱應激狀態的判斷。
4 結 論
本研究結果顯示,實驗綿羊在經過3 d的中度熱應激刺激后,肉品質受到了嚴重的負面影響,有向PSE肉發展的趨勢;免疫功能顯著降低,腎功能受到一定影響。通過對血液生化指標差異進行分析,發現Ins、TRH、Cor 3 種激素在熱應激狀態下變化顯著,可作為生物標志物用于綿羊熱應激狀態的判斷。本實驗結果可為綿羊在高溫地區的養殖及高溫條件下屠宰加工的動物福利管理提供一定的理論支持,為改善熱應激的影響提供研究基礎。

