新生兒缺氧缺血性腦病血清miR-384與炎癥反應、神經行為的相關分析
王 彤,楊國穎,趙凱紅,邢 燁,田 勃
(唐山市婦幼保健院新生兒科,河北 唐山 063000)
新生兒缺氧缺血性腦病(hypoxic-ischemic encephalopathy,HIE)主要因圍產期窒息所致,發病機制較復雜,既往研究指出其可能與炎性細胞因子有關,同時氧自由基增加、脂質過氧化等可能共同參與了HIE進展,能誘發腦水腫、神經元壞死等病理改變,促進神經纖維性質改變[1]。HIE癥狀包括抽搐、意識狀態改變、原始反射異常等,患兒死亡率較高,預后欠佳,部分患兒還會出現不同程度的后遺癥,例如智力低下、癲癇、腦癱等[2]。因此,臨床需進一步探究HIE的發生與進展機制,以期為該病治療提供依據。
目前,有學者指出微小分子核糖核酸(microRNA,miR)與多臟器損傷有關,當臟器處于缺氧、缺血狀態時能促進炎癥因子分泌,將特定信號路徑激活,上調相關基因表達,促進細胞壞死,miR可能參與了相關基因的調控過程[3]。動物實驗發現miR-384-5p(從miR-384前體的5′端臂加工而成)表達與大鼠神經細胞凋亡有關,在大鼠皮質受損后可見miR-384-5p表達下調[4],提示miR-384可能在腦神經病變中有調節作用。另有研究認為miR-384表達下調可能通過敲除環狀RNA染色質重塑因子(Circular RNA bromodomain PHD finger transcription factor,circBPTF)對機體炎癥免疫進行調節,使高糖誘導的免疫炎癥紊亂改善,緩解應激反應[5]。而炎癥與HIE進展密切相關,當腦中樞組織受到損害時,可引起固有免疫系統受損,致大量炎癥介質釋放,加重HIE患兒的腦組織損害[6],但目前針對miR-384是否通過調節炎癥免疫影響HIE患兒的病情尚無定論。動物實驗提示HIE與免疫功能異常有關,窒息缺氧能引起T細胞亞群異常,導致淋巴細胞凋亡加速及輔助性T細胞17/調節性T細胞(helper T cell 17/regulatory T cell,Th17/Treg)失衡,誘發免疫功能紊亂,提示Th17/Treg失衡可能在HIE中發揮了調節作用[7]。而目前尚不明確miR-384與Th17/Treg平衡及HIE之間的關系,基于此,本次研究納入106例HIE新生兒進行研究,分析其miR-384表達水平與炎癥反應、Th17/Treg失衡、神經行為的相關性,以期為HIE臨床治療提供思路,報道如下。
1對象與方法
1.1研究對象
選擇2015年10月至2020年10月唐山市婦幼保健院收治的106例HIE患兒為HIE組,另選取同期同院產科分娩的90例健康新生兒為對照組。HIE診斷標準:參考《新生兒缺氧缺血性腦病.第2版》[8]:①孕婦既往有可能引起胎兒宮內窘迫的產科病史,且伴有胎兒宮內窘迫癥狀(例如羊水Ⅲ度污染,胎心<100次/min,且持續時間≥5min)或者在分娩過程中有明顯窒息史;②出生時存在重度窒息,即1min Apgar評分≤3分,延續至5min Apgar評分仍≤5分,或者臍動脈血氣PH≤7.00;③新生兒出生后發生意識改變、原始反射異常、肌張力改變等神經系統異常表現,持續時間>24h;④排除其他原因(如產傷、顱內出血等)所致的抽搐及宮內感染、遺傳代謝性疾病和其他先天性疾病所引起的腦損傷,滿足上述4條則可確診。納入標準:①HIE組:符合上述診斷標準者;未見先天遺傳性疾病者;胎齡37~42周者;患兒監護人對研究內容知情同意。②對照組:同期于我院產科分娩的健康新生兒;胎齡37~42周者;孕婦孕期健康;Apgar評分為8~10分者;患兒監護人對研究內容知情同意。排除標準:因遺傳代謝性疾病或其他先天疾病所致的腦損傷者;先天畸形者;顱內出血者;孕婦有妊娠期糖尿病、妊娠期高血壓等合并癥;機體嚴重感染者;腦結構發育異常者。研究方案獲醫院倫理委員會批準。
1.2檢測方法
1.2.1炎癥因子、Treg、Th17及其他細胞因子檢測
兩組新生兒采集4mL外周血,分裝于兩管。其中一管血樣離心10min,轉速3 000r/min,分離血清,存至-70℃環境待測。經酶聯免疫吸附法檢測血清白介素-6(interleukin-6,IL-6)、C反應蛋白(C-reactive protein,CRP)、腫瘤壞死因子-α(tumor necrosis factor-α,TNF-α)水平,試劑盒均購自上海酶聯生物科技有限公司,經霍爾德HED-SY96S自動酶標儀(山東霍爾德電子科技有限公司)測定;另一管血樣加入抗凝劑,存至-70℃環境待測,經貝克曼庫爾特DxFLEX流式細胞儀(美國貝克曼庫爾特有限公司)測定Treg、Th17水平,計算Th17/Treg值。
1.2.2血清miR-384檢測
另取2mL外周血,離心方式同上,取血清存至-70℃環境待測。經實時逆轉錄聚合酶鏈反應(quantitative real-time reverse transcription polymerase chain reaction,qRT-PCR)檢測miR-384。主要試劑為總RNA提取試劑、逆轉錄試劑、qPCR試劑、異丙醇、氯仿,均由賽默飛世爾科技公司提供。主要儀器為TG-16W高速離心機[愛來寶(濟南)醫療科技有限公司]、KS48+型PCR擴增儀[冠森生物科技(上海)有限公司]、F3微量移液器(賽默飛世爾科技公司)。具體如下:嚴格根據試劑說明書提取總RNA,待提取完畢,取RNA液體2μL測定純度,分析A260/A280值,若二者比值在1.6~1.9之間,則提示純度滿足檢測要求。針對總RNA液體進行逆轉錄,使其合成cDNA,將cDNA產物冷卻,并行PCR擴增,反應條件如下:95℃預變性30s;95℃變性10s,55℃退火15s,72℃延伸20s,共進行40個循環。引物序列為①miR-384:上游5′-GCCGAGATTCCTAGAAATTG-3′,下游5′-CTCAACTGGTGTCGTGGA-3′;②內參引物U6:上游5′-CTCGCTTCGGCAGCACA-3′,下游5′-AACGCTTCACGAATTTGCGT-3′。利用2-△△CT表示miR-384表達水平,取3次試驗均值為最終結果。
1.3 HIE分組與評價標準
根據HIE分度標準將患兒分成輕度組(n=37)、中度組(n=44)、重度組(n=25)。HIE分度標準[8]①輕度:意識處于興奮與抑制交替的狀態,肌張力稍微增高或者正常,擁抱反射良好,吸吮反射正常,可能伴有肌陣痙攣,未見中樞性呼吸衰竭,瞳孔擴大或正常;②中度:嗜睡,肌張力有所下降,擁抱、吸吮反射減弱,常有驚厥,伴有中樞性呼吸衰竭,瞳孔常縮小;③重度:昏迷,肌張力松軟,擁抱、吸吮反射消失,持續驚厥,伴明顯中樞性呼吸衰竭,瞳孔擴大,對光反射延遲。
新生兒神經行為量表(neonatal behavioral neurological assessment,NBNA)評分[9]:包括原始反射(3項)、行為能力(6項)、一般反應(3項)、主動肌張力(4項)與被動肌張力(4項)5個維度,共20個條目,每項計0~2分,總分范圍為0~40分,總分35分以下提示神經功能異常,分值越高表明神經功能越好。
1.4統計學方法
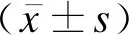
2結果
2.1兩組基線資料比較
兩組性別、胎齡、新生兒出生體重及分娩方式比較差異均無統計學意義(P>0.05),見表1。
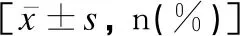
表1 兩組基線資料比較
2.2兩組血清miR-384、炎癥因子及NBNA評分比較
HIE組血清miR-384水平及NBNA評分低于對照組,IL-6、CRP、TNF-α水平高于對照組,差異均有統計學意義(t值介于-21.533~30.802之間,P<0.05),見表2。
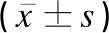
表2 兩組血清miR-384、炎癥因子及NBNA評分比較
2.3兩組Th17、Treg及Th17/Treg比較
HIE組Treg水平低于對照組,Th17、Th17/Treg水平高于對照組,差異均有統計學意義(t值介于-6.166~8.390之間,P<0.05),見表3。
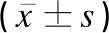
表3 兩組Th17、Treg及Th17/Treg比較
2.4不同臨床分度HIE患兒血清miR-384、炎癥因子及NBNA評分比較
HIE輕、中、重度組血清miR-384水平及NBNA評分均依次降低,IL-6、CRP、TNF-α水平均依次升高,差異有統計學意義(F值介于82.368~225.418之間,P<0.05),見表4。
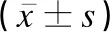
表4 不同臨床分度HIE患兒血清miR-384、炎癥因子及NBNA評分比較
2.5不同臨床分度HIE患兒Th17、Treg及Th17/Treg比較
HIE輕、中、重度組Treg依次降低,Th17、Th17/Treg均依次升高,差異有統計學意義(F值介于135.487~513.891之間,P<0.05),見表5。
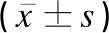
表5 不同臨床分度HIE患兒Th17、Treg及Th17/Treg比較
2.6 HIE患兒miR-384與炎癥因子、Th17、Treg、NBNA評分的相關性
經Pearson線性相關分析提示,HIE患兒血清miR-384與IL-6、CRP、TNF-α、Th17、Th17/Treg呈負相關(r值介于-0.867~-0.406之間,P<0.05),與Treg、NBNA評分呈正相關(r值分別為0.671、0.776,P<0.05),見表6。
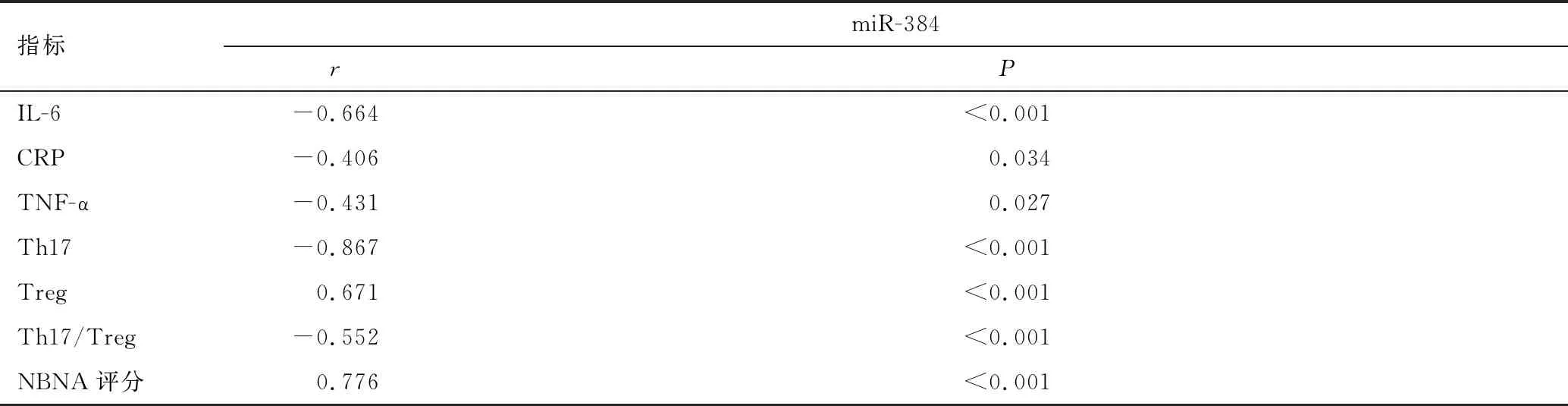
表6 HIE患兒miR-384與炎癥因子、Th17、Treg、NBNA評分的相關性
3討論
3.1 HIE發病現狀及基礎機制分析
研究表明在我國活產兒中,約3‰~6‰出現HIE,死亡率約為15%~20%,即便患兒存活,仍有約25%~30%發生不同程度的神經系統后遺癥[10]。盡早對患兒進行治療,可以改善其預后。研究指出免疫炎癥反應參與了HIE發病與進展過程,炎癥因子可通過炎癥細胞、免疫細胞產生,對細胞功能有調節作用;促炎因子的過度釋放能啟動炎癥機制,擴大炎癥反應,加重HIE所致的神經損害[11]。Th17/Treg失衡也與HIE有關,二者失衡通常表現為與之相關的促炎因子釋放增加,而抗炎因子釋放減少,引起炎癥免疫紊亂,促使腦組織功能損害[12]。有學者發現某些miRNA在組織處于缺氧、缺血時存在異常表達,miRNA的轉錄水平對蛋白功能有一定影響,參與其凋亡、生長等過程,它通過對基因轉錄后沉默進行介導,從而在HIE中發揮作用[13]。臨床通過分析相關的miRNA在HIE中的作用,可能對該病治療具有一定指導意義。
3.2 HIE與炎癥因子、miR-384表達、Th17/Treg失衡的關系
本研究提示與健康新生兒相比,HIE患兒的血清IL-6、CRP、TNF-α水平明顯增高,而NBNA評分下降,表明患兒存在炎癥反應,且神經行為能力相對較差。IL-6是一種促炎因子,在中樞神經系統防御、損害過程中發揮了重要的調節作用,在出現HIE后可導致IL-6水平迅速上調,它能促使炎癥細胞在病變部位大量聚集,促進中性粒細胞釋放大量的毒性氧基,加重HIE損害[14]。CRP、TNF-α對炎癥介質釋放有激活作用,能促進局部炎癥損害,且對黏附因子釋放、合成存在誘導作用,致腦損害加重[15-16]。
本研究結果顯示HIE患兒的血清miR-384表達量較正常新生兒明顯降低。目前,動物研究發現在中樞神經功能損傷后,海馬體中miR-384-5p存在異常表達[17],表明其可能參與了中樞神經毒性進展,與腦損害發生存在關聯。Liu等[18]認為miR-384對腦中樞神經元的調節機制比較復雜,可能通過Snhg8/miR-384/Hoxa13/FAM3A軸發揮作用,其中Snhg8過表達能調控miR-384發揮抗細胞凋亡作用,而miR-384表達能靶向其3′UTR影響Hoxa13表達,Hoxa13則能與FAM3A啟動子結合,對神經元凋亡進行調節,但在該調節軸中,miR-384過表達反而促進神經元凋亡,加重腦損害,與本次結論相悖。分析原因可能為上述研究以小鼠為模型,而本研究以新生兒為研究對象。miR-384還可能通過減少腦組織內炎性巨噬細胞,從而減少腦內丙二醛、過氧化氫酶和超氧陰離子陽性細胞數量,減輕局部炎癥,對腦組織進行保護[19]。而炎癥與HIE發生密切相關,大量炎癥介質的釋放會加重HIE嚴重程度,miR-384低表達則可能通過促炎作用,加速HIE發生與進展。
本研究發現HIE患兒的血清Treg下降,Th17、Th17/Treg增高,表明Th17/Treg參與了該病發生過程。Treg具有抗炎功能,能對自身免疫反應進行抑制,在限制炎癥、維持免疫穩定性中發揮重要作用。Th17則具有促炎作用,它能通過調節核轉錄因子-kB(nuclear factor kappaB,NF-kB)信號路徑,促進炎癥介質產生。腦損傷患者可見Th17/Treg失衡,具體表現為Th17及其細胞因子含量上升,而Treg及其細胞因子含量下降,Th17/Treg失衡可通過調節相關的炎癥信號通路,促進腦損傷[20]。
3.3 miR-38表達與HIE患兒炎癥、Th17/Treg失衡、NBNA評分的關系
本研究顯示隨著HIE臨床分度增加,患兒的促炎因子表達水平逐漸升高,而血清miR-384水平、抗炎因子表達水平逐漸下降,且NBNA評分逐漸降低。這表明HIE患兒病情加重與炎癥反應程度及神經行為能力水平有關。患兒機體組織中的炎癥程度越重,則可導致腦損害進一步加劇,進而影響神經行為功能,經之前的分析提示血清miR-384在腦損傷中能發揮抗炎作用,而低表達的miR-384可能無法對腦內炎性巨噬細胞進行充分調節,促進神經炎癥,加重中樞神經毒性,致腦損害進展,上述作用可能共同導致HIE病情加重。本研究提示HIE患兒血清miR-384與炎癥因子、Th17、Treg、NBNA評分均有相關性,這進一步提示miR-384可能通過與炎癥因子、Th17、Treg相互作用,參與HIE進展。miR-384可能通過減少炎性巨噬細胞、下調促炎介質水平發揮抗炎功能,對腦組織功能進行保護,而一旦miR-384表達下調,則可能致炎性巨噬細胞數量增加,促炎介質釋放增多,導致與Th17相關的促炎因子大量釋放,機體抗炎作用減弱,Treg相關抗炎因子水平下調,促使Th17/Treg失衡。
綜上所述,HIE患兒血清miR-384水平下調,且其可能與炎癥因子、Th17、Treg共同影響HIE患兒病情有關,臨床有望通過檢測血清miR-384水平輔助評估HIE患兒病情。本研究局限性為受研究時間限制,未進一步隨訪觀察miR-384對HIE患兒遠期腦發育是否有影響,日后將增設隨訪對此予以探討。

