人肝癌耐藥細胞中差異表達微小RNA的篩選及生物學功能分析
耿海靜,王海生,張建宇,李薇,鄧秀玲
內蒙古醫科大學基礎醫學院,呼和浩特 010000
原發性肝癌是消化系統常見的惡性腫瘤之一,其發病率和病死率居高不下。目前對于肝癌的治療仍以綜合治療為主,其中化療占主要地位。常用的化療藥物有阿霉素(ADR)、5-氟尿嘧啶(5-FU)、鉑類抗癌藥物等。然而隨著治療周期的延長,化療藥物敏感性逐漸降低,出現多藥耐藥,嚴重制約了化療的療效,導致腫瘤復發和轉移,是化療失敗的主要原因。腫瘤耐藥性產生的機制十分復雜,涉及多因素、多環節、多通路,是目前研究的熱點和難點。微小RNA(miRNA)是一類非編碼小分子RNA,通過與靶mRNA的3'端非翻譯區(3'-UTR)互補結合,促使靶mRNA的降解或抑制其翻譯,從轉錄后水平調控基因表達,參與調控機體的多種生物學過程[1]。研究顯示,miRNA不僅參與調控腫瘤的發生發展,而且在腫瘤多藥耐藥的發生發展過程中也發揮重要作用。2018年—2022年,我們通過miRNA 芯片技術,尋找人肝癌耐藥細胞株Bel-7402/5-FU、Bel-7402/ADR 與親本細胞株Bel-7402 之間差異表達的miRNA,探討miRNA 在肝癌多藥耐藥中的作用,預測其調控的靶基因,為miRNA參與肝癌耐藥性機制研究提供更多的靶點。
1 材料與方法
1.1 材料 人肝癌耐藥細胞株Bel-7402/5-FU、Bel-7402/ADR 和親本細胞株Bel-7402 均購自上海美軒生物技術公司。Gene Chip miRNA 4.0(Affymetrix 公司);TRIzol 試劑(上海普飛公司);反轉錄試劑為Promega M-MLV 試劑盒;反轉錄引物、miRNA PCR 引物和SYBR Premix Ex Taq 熒光試劑(廣州市銳博生物科技有限公司);胎牛血清(FBS)、0.25%胰酶、RPIM1640 培養基(Sigma 公司);RIPA、BCA 蛋白檢測試劑盒、小鼠抗人PGP 抗體及抗山羊二抗(索萊寶公司)。
1.2 細胞培養 將Bel-7402細胞培養于RPMI1640完全培養基(含10%胎牛血清、100 μg/mL青霉素和100 μg/mL 鏈霉素)中,Bel-7402/5-FU 細胞培養于含10 μg/mL 5-FU 的RPMI1640培養基(含10%胎牛血清、100 U/mL 青霉素和100 μg/mL 鏈霉素)中,Bel-7402/ADR 細胞培養于含5 000 ng/mL ADR 的RPMI1640 培養基(含10%胎牛血清、100 μg/mL 青霉素和100 μg/mL 鏈霉素)中。置于37 ℃、5% CO2、飽和濕度的CO2培養箱內。
1.3 肝癌細胞miRNA 表達譜分析 將對數生長期細胞,按照1×105/孔接種于6 孔板中,培養48 h,每組設3 個復孔。待細胞生長達到80%融合度時,加入TRIzol 試劑提取總RNA,使用NanoDrop2000 和安捷倫生物分析儀2100 分析RNA 純度,質檢合格的RNA 進行miRNA 芯片檢測。使用FlashTag? Biotin HSR RNA Labeling Kit 對樣本miRNA 進行標記,標記后的miRNA 與上膠緩沖液混合,PCR 儀孵育99 ℃ 5 min,45 ℃ 5 min。孵育完成后,取130 μL 注入芯片,雜交16~18 h后,用清洗液清洗芯片。將芯片放入Gene Chip Scanner 3000 掃描儀中進行掃描,讀取芯片掃描圖像提取探針的信號值。圖像和數據以TIFF 的文件格式保存。Bel-7402、Bel-7402/5-FU、Bel-7402/ADR 細胞RNA 分別雜交1 張芯片,每個探針重復3 次。采用t 檢驗計算樣品間miRNA 表達量變化的統計學差異,以P≤0.05 且|差異倍數(FC)|>2 為顯著性差異表達的miRNA。對不同樣品組之間差異表達的miRNA 進行圖形化展示,即火山圖分析,篩選標準為P≤0.05且|FC|>2。
1.4 肝癌耐藥細胞差異表達miRNA 靶基因的預測和 功 能分 析 在Targetscan、microRNA. ORG 和miRDB 三個數據庫中對FC 最大的miRNA 進行靶基因預測。通過Fisher 精確檢驗評價某個GO term 基因富集度的顯著性水平和各個通路基因富集度的顯著性水平。根據靶基因預測結果,獲得3 個數據庫中共有的靶基因,通過Gene Ontology 進行GO 注釋及富集分析,同時在KEGG 數據庫進行信號通路分析,確定受到顯著影響的代謝和信號轉導途徑。
1.5 肝癌耐藥細胞差異表達miRNA 的驗證 采用實時熒光定量PCR(qPCR)法。收集6孔板達80%融合度的Bel-7402、Bel-7402/5-FU和Bel-7402/ADR細胞,加入TRIzol試劑提取總RNA。按照M-MLV 試劑盒(Promega)進行miRNA逆轉錄獲取cDNA。向逆轉錄產物中加入無RNA 酶的去離子水補足體積,取1 μL稀釋液進行后續的PCR反應。反應體系:SYBR premix ex taq 6.0 μL,引物mix(5 μmol/L)0.3 μL,模板(反轉錄產物)0.6 μL,RNase-Free H2O 5.1 μL。反應條件:95 ℃預變性30 s;95 ℃ 5 s,60 ℃ 30 s,40 個循環。所有樣本重復運行3次,繪制解離曲線證實擴增的特異性。以2-ΔΔCt法計算靶基因的相對表達量。
1.6 統計學方法 采用SPSS25.0 統計軟件。符合正態分布的計量資料以±s表示。Bel-7402 與Bel-7402/5-FU、Bel-7402 與Bel-7402/ADR 之 間 差異的比較采用配對t檢驗。P<0.05 為差異有統計學意義。
2 結果
2.1 肝癌耐藥細胞差異表達miRNA 篩選結果 與Bel-7402細胞比較,Bel-7402/5-FU 細胞存在58個差異表達的miRNA,其中上調27 個、下調31 個,Bel-7402/ADR 細胞存在87 個差異表達的miRNA,其中上調17個、下調70個。見OSID碼圖1。在Bel-7402/5-FU和Bel-7402/ADR細胞中分別篩選出10個FC最大的miRNA,見表1、2。兩種耐藥細胞有9個差異表達miRNA重合,其中Bel-7042/5-FU細胞中miR-205-5p、miR-10a-5p、miR-675-3p、miR-373-5p、miR-371a-3p、miR-372-3p、miR-675-5p、miR-4532 表達下調,miR-31-5p、miR-4446-3p表達上調;Bel-7042/ADR細胞中miR-205-5p、miR-675-3p、miR-373-5p、miR-373-3p、miR-372-3p、miR-371a-3p、miR-675-5p、miR-10a-5p、miR-4532表達下調,miR-31-5p表達上調。
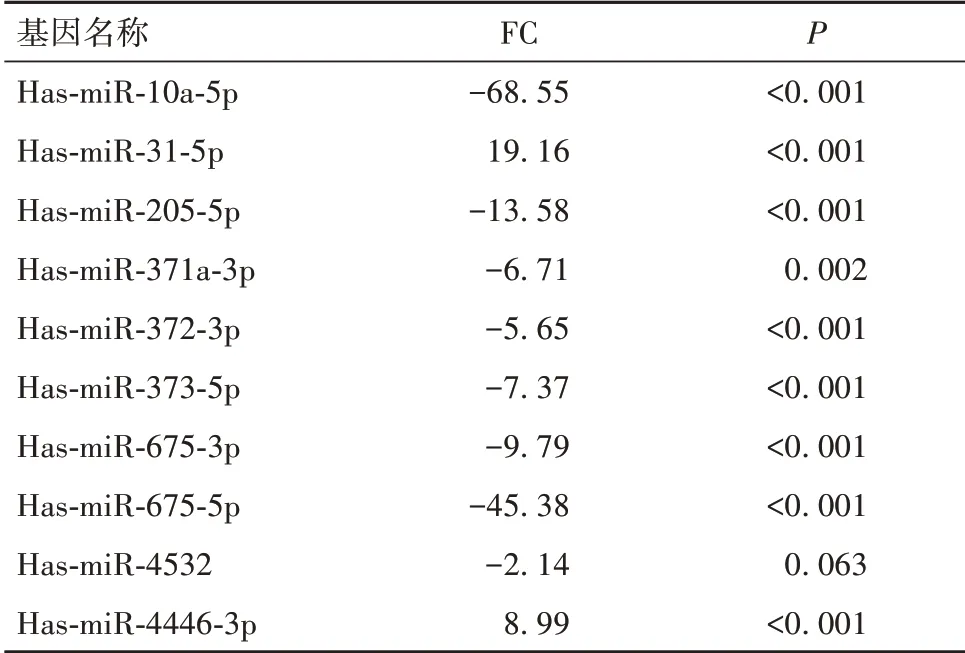
表1 人肝癌耐藥細胞Bel-7402/5-FU中的差異表達基因
2.2 肝癌耐藥細胞差異表達miRNA 的預測靶基因GO 分析結果 根據10 個FC 最大的miRNA 靶基因的 預 測 結 果,從Targetscan、microRNA. ORG 和miRDB 三個數據庫中獲取共同靶基因,進行GO 分析。GO 分析涉及生物過程(BP)、分子功能(MF)和細胞組分(CC)三個部分。其中BP主要涉及RNA 聚合酶Ⅱ啟動子的轉錄調控、生物合成過程正向調控和氮化合物代謝過程負向調控等過程;MF主要涉及酶結合、大分子復合物結合和核酸結合轉錄因子活性等功能;CC 主要涉及高爾基體、催化復合物和轉移酶復合物等過程。見OSID碼圖2。
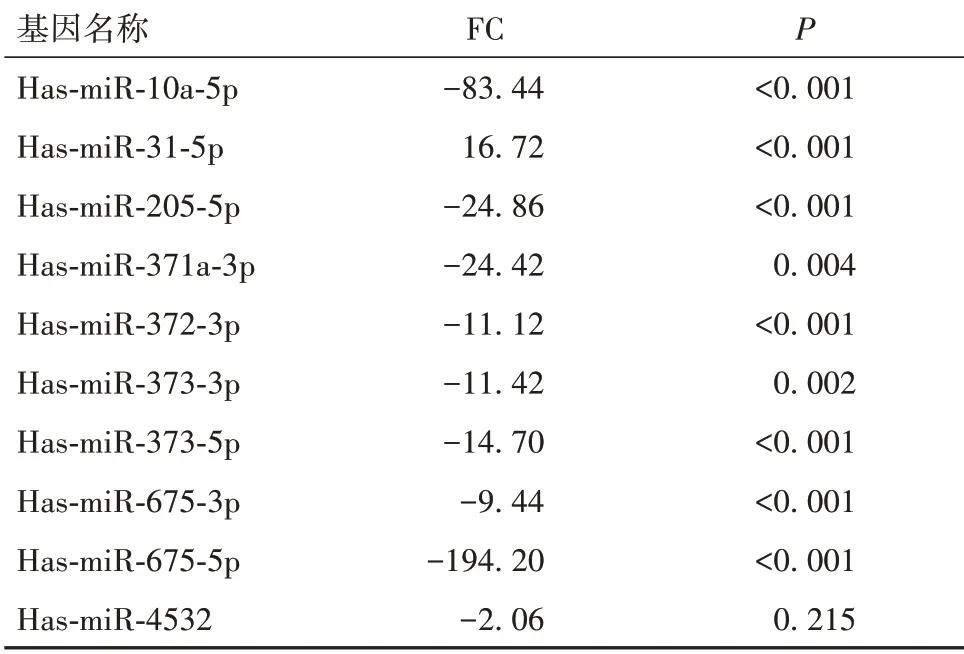
表2 人肝癌耐藥細胞Bel-7402/ADR中差異表達基因分析
2.3 肝癌耐藥細胞差異表達miRNA 的預測靶基因KEGG 分析結果 根據靶基因預測結果,獲得三個數據庫中共有的靶基因,同時進行KEGG 通路分析。靶基因富集通路包括軸突引導、泛素介導的蛋白水解、PAR1通路、神經營養因子信號通路、MAPK 信號通路、TGF-β信號通路。見OSID碼圖3。
2.4 肝癌耐藥細胞差異表達miRNA 的驗證結果 與Bel-7402 細 胞比 較,Bel-7402/5-FU 和Bel-7402/ADR 細 胞 中miR-31-5p、miR-4446-3p 表 達 上 調,miR-205-5p、miR-675-3p、miR-373-5p、miR-372-3p、miR-371a-3p、miR-675-5p、miR-10a-5p 和miR-4532表達下調(P均<0.05),驗證結果與芯片結果一致。見表3。

表3 人肝癌耐藥細胞Bel-7402/5-FU和Bel-7402/ADR中 差異表達miRNA的驗證結果
3 討論
目前研究認為,腫瘤細胞高表達的耐藥基因MDR1/P 糖蛋白(P-gp)導致細胞對藥物攝取降低、細胞外排功能增加,是腫瘤細胞多藥耐藥產生的主要機制。P-gp 是ABC 轉運蛋白之一,利用ATP 水解產生的能量,將5-FU、ADR、紫杉醇、長春新堿等多數化療藥物及一些分子靶向藥物轉運出胞外,以降低其在細胞內的濃度,從而導致腫瘤細胞產生多藥耐藥性[2]。在肝癌、胰腺癌、腎癌等腫瘤耐藥細胞中,P-gp表達水平普遍升高[3],提示P-gp表達量與腫瘤耐藥性發生有關。5-FU 和ADR 是臨床常用的肝癌化療藥物,也是P-gp 轉運的底物,因此本研究以人肝癌耐藥細胞株Bel-7402/5-FU 和Bel-7402/ADR為研究對象。miRNA 是細胞內的一類非編碼小RNA,在轉錄后水平調控體內多種生理和病理活動過程。miRNA 不僅調控腫瘤的發生、轉移,而且還調控腫瘤細胞的耐藥性,miRNA 異常可導致腫瘤細胞的表型改變,從而導致耐藥發生,提示miRNA 有可能作為預測化療敏感性和逆轉耐藥的靶點用于腫瘤治療。本研究利用miRNA 芯片技術分析人肝癌Bel-7402 細 胞 與Bel-7402/5-FU 和Bel-7402/ADR 細胞的miRNA 表達譜,篩選耐藥細胞中的差異表達miRNA,并對FC>10 的差異表達miRNA 進行靶基因預測。結果顯示,在Bel-7402/5-FU 和Bel-7402/ADR 細胞中,有9 個miRNA 的表達發生明顯變化,其中miR-31-5p 表達上調,miR-205-5p、miR-675-3p、miR-373-5p、miR-372-3p、miR-371a-3p、miR-675-5p、miR-10a-5p 和miR-4532 表達下調,后續PCR 檢測結果也驗證了這一點。這表明上述miRNA 在肝癌耐5-FU 和ADR 發生發展過程中具有重要作用。此外我們還發現,miR-4446-3p 在Bel-7402/5-FU 細胞中表達上調,而miR-373-3p在Bel-7402/ADR細胞中表達下調,提示miR-4446-3p 參與了Bel-7402/5-FU 耐藥性的形成,miR-373-3p參與了Bel-7402/ADR 耐藥性的形成。
研究顯示,上述miRNA 在不同腫瘤耐藥機制中可能發揮不同的作用(目前未見miR-373-3p 的研究報道)。miR-4532 在乳腺耐藥和敏感細胞中差異表達,它可通過調節HIC-1 的表達促進乳腺癌細胞對阿霉素的耐藥性[4],這可能成為逆轉腫瘤耐藥性的新的治療靶點。ZICHITTEllA 等[5]報道,在缺氧微環境中,直腸癌中miR-675-5p 表達升高,通過抑制Caspase-3影響5-FU誘導的腫瘤細胞凋亡,從而增強耐藥性。CHEN 等[6]報道,在大腸癌細胞中,miR-31-5p 高表達導致使大腸癌對奧沙利鉑產生耐藥性,其機制是由于miR-31-5p 抑制了大腫瘤抑制激酶2(LATS2)表達;而抑制miR-31-5p表達可促進腫瘤細胞凋亡并增強腫瘤細胞對化療藥物的敏感性。葉茸茸[7]報道,與小細胞肺癌親本細胞株H69 相比,miR-4446-3P 在小細胞肺癌多藥耐藥細胞H69AR 中呈高表達。李清華等[8]報道,結直腸腺瘤復發患者與未復發患者相比,miR-4446-3p 表達上調,其高表達可能參與了結直腸腺瘤的復發機制。miR-372-3p可能作為一種致癌物,在直腸癌[9]、睪丸生殖細胞腫瘤[10]和口腔癌[11]等多種腫瘤的發生中發揮作用。在結直腸癌中,miR-372-3p 高表達與腫瘤大小和分化顯著相關[12],miR-372-3p上調通過抑制LATS2、抑制Hippo信號通路參與結直腸癌的進展。在鼻咽癌中,miR-372通過下調PBK、激活p53信號通路抑制腫瘤細胞的侵襲和轉移,同時miR-372 過表達也增強了對放療的敏感性[13]。然而,在胃癌[14]、肝癌[15]和乳腺癌[16]中,miR-372 可促進腫瘤進展和轉移;在口腔癌[17]、鼻咽癌[18]、腎細胞癌[19]、前列腺癌[20]中,miR-31-5p可顯著抑制腫瘤生長,可能成為腫瘤治療的關鍵靶點。
一個miRNA 可以同時調控多個靶基因,而一個靶基因可以被多個miRNA 調控,這使得它們在不同的腫瘤中發揮不同的作用。本研究對篩選出的10個差異表達的miRNA 預測靶基因進行GO 和KEGG分析,以期尋找miRNA 參與調控的生物學功能和相關通路,結果顯示,其參與正向調控RNA 聚合酶Ⅱ啟動子、酶結合和高爾基體的轉錄調控等生物過程,富集的通路有泛素依賴的蛋白酶體降解途徑、PAR1通路、神經營養因子信號通路、MAPK 信號通路、TGF-β 信號通路。TGF-β 可在上皮細胞中誘導上皮間質轉化,與多種纖維化疾病和癌癥進展相關[21]。研究顯示,miR-372 表達可顯著抑制HaCaT 細胞中TGF-β 誘導的上皮間質轉化[22]。MAPK 位于許多生長因子的下游,是細胞增殖最重要的途徑之一,許多證據表明,MAPK 過度表達和激活在癌癥進展中起重要作用。miRNA 可調節MAPK 信號,而MAPK 信號通常在癌癥進展的情況下過度表達,表明miRNA與MAPK信號通路之間的串擾在人類癌癥的發展中起關鍵作用。一項對肝細胞癌的研究表明,EGFRp38 MAPK 可下調miR-675-5p 表達,其下調可增強PD-L1 mRNA 的穩定性,從而導致PD-L1 積累[23]。在L-精氨酸誘導的胰腺炎中,毒蕈堿乙酰膽堿受體被激活并通過p38 MAPK 信號通路調節胰腺炎,在體外和體內胰腺炎模型中,miR-31-5p 表達均降低[24],提示miR-31-5p表達與MAPK信號通路之間存在重要關系。基于以上研究,我們推測差異表達的miRNA 可能通過調控MAPK、TGF-β 等信號通路參與肝癌耐藥的形成。
本研究通過芯片數據和生物信息學方法篩選在肝細胞癌耐藥細胞中差異表達的miRNA,并對這些miRNA的表達情況進行驗證。進一步的功能分析表明這些miRNA可能通過調控MAPK和TGF-β等信號通路參與肝癌耐藥的發生過程。但本研究也存在一定的局限性:其一,本文鑒定的miRNA有些已被證明與其他腫瘤耐藥相關,但部分miRNA 如miR-373-3p目前尚無相關證據,這些miRNA 是否在肝癌耐藥過程中發揮作用仍不明確;其二,克服腫瘤多藥耐藥性是未來肝癌治療的研究重點,而miRNA 介導的耐藥又具有多樣性和復雜性的特點,其靶基因的功能較復雜,要在多個miRNA 及其靶基因中找到導致肝癌細胞耐藥的關鍵機制,有待進一步研究探索。

