慢性阻塞性肺疾病合并肺炎患者的痰培養菌種分布及耐藥性分析
丁 劍, 周 俊
(1. 江蘇省揚中市人民醫院 呼吸內科, 江蘇 揚中, 212200;2. 揚州大學附屬醫院 呼吸與危重癥醫學科, 江蘇 揚州, 225009)
慢性阻塞性肺疾病(COPD)是緩慢型進展性疾病,發病率、致死率較高,會使患者的生活質量大幅度降低[1]。COPD易并發細菌感染,導致肺炎發生,隨著病情進展,還可誘發呼吸功能障礙等一系列并發癥,甚至危及患者生命[2]。抗菌藥物治療是COPD合并肺炎的主要治療手段,但由于該病遷延難愈,長期用藥會使病原菌耐藥性增強,降低臨床效果,不利于預后恢復[3]。治療前明確病原菌類型并進行藥敏試驗,能避免經驗性用藥缺陷,使用藥更加規范合理化,在呼吸道感染性疾病的診療中具有良好的應用前景[4-5]。本研究回顧性分析507例COPD合并肺炎患者的痰培養病原菌分布情況及其耐藥性,以期為此類患者的藥物治療提供參考依據,現報告如下。
1 資料與方法
1.1 一般資料
回顧性分析2020年1月—2021年12月揚中市人民醫院收治的507例COPD合并肺炎患者的臨床資料,其中男425例,女82例; 年齡43~94歲,平均(69.13±11.58)歲; 體質量指數19.5~26.8 kg/m2, 平均(23.44±1.53) kg/m2; COPD病程3~12年,平均(6.59±1.42)年; 住院時間1~29 d, 平均(15.43±5.72) d。納入標準: ① 臨床癥狀、影像資料和實驗室指標均符合《2018 KATRD臨床實踐指南: 慢性阻塞性肺疾病(修訂版)》[6]中COPD診斷標準者; ② 有呼吸困難加重、痰液黏度升高、肺部濕啰音、咳嗽等臨床癥狀者; ③ X線或CT檢查示肺部有滲出性病灶陰影者; ④ 不明原因發熱者; ⑤ 無精神疾病或認知功能障礙者; ⑥ 臨床資料完整者。排除標準: ① 合并免疫功能異常、臟器器質性病變者; ② 合并肺部惡性病變者; ③ 對本研究使用藥物過敏者; ④ 合并肺栓塞、胸腔積液者; ⑤ 參與本研究前使用其他抗菌藥物治療者。
1.2 材料與方法
1.2.1 儀器和試劑: 細菌測定系統[品牌迪爾,型號DL-96II,注冊號粵食藥監械(準)字2011第2400303號],生物顯微鏡[品牌尼康,型號Ci-S,注冊號國食藥監械(進)字2013第2223834號],生物安全柜[品牌博科,注冊號國食藥監械(準)字2009第3540026號],支氣管鏡[品牌奧林巴斯,型號BF-260, 注冊號國食藥監械(進)字2010第3223051號],細菌測定系統隨機體外診斷試劑板(珠海迪爾生物工程有限公司生產,型號DL-96E試劑板,生產許可證號粵食藥監械生產許20030756號)。
1.2.2 痰標本采集和病原菌培養: 囑患者嚴格按照痰液提取規范于入院次日晨起漱口咳出深部痰液,棄去第1口痰液,留取第2口痰液標本(合格標準: 低倍鏡下白細胞>25個/低倍鏡視野,鱗狀上皮細胞<10個/低倍鏡視野,或者鱗狀上皮細胞∶白細胞<1∶2.5); 排痰困難者以纖維支氣管鏡輔助排痰,具體操作為經鼻腔將纖維支氣管鏡置入至肺部感染區域,以無菌毛刷采集呼吸道深處痰液標本; 痰少,則霧化吸入生理鹽水誘導排痰。取出合格痰液標本后,即刻置于無菌試管,避免二次感染。將合格痰液標本于2 h內完成痰液培養,若標本在2 h后進行痰液培養則需4 ℃保存。病原菌培養依照相關要求[7]進行,于顯微鏡下分離痰液標本,將合格標本分別接種于血瓊脂平板、巧克力平板,培養箱(37 ℃)培養24 h, 分離、純化疑似病原菌。
1.2.3 藥敏試驗: 使用微生物藥敏分析儀對分離病原菌進行鑒定,采用K-B瓊脂法實施藥敏試驗。革蘭氏陽性菌質控菌株為溶血葡萄球菌(ATCC 29970),革蘭氏陰性菌質控菌株為銅綠假單胞菌(ATCC 27853)、鮑曼不動桿菌(ATCC 17978)、肺炎克雷伯菌(ATCC 700603)。
1.3 觀察指標
① 痰液培養標本中病原菌分布情況。② 菌群耐藥性分析: 分析革蘭氏陰性菌、革蘭氏陽性菌對常用抗菌藥物的耐藥性。③ 采用改良版英國醫學研究委員會呼吸問卷(mMRC)[8]、慢性阻塞性肺疾病評估測試(CAT)[9]比較根據藥敏試驗結果用藥患者與經驗性用藥患者的呼吸困難程度、生活質量。mMRC評分范圍為0~4分,評分越高表示呼吸困難越嚴重; CAT評分范圍為0~40分,評分越低表示生活質量越高。
1.4 統計學分析
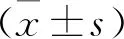
2 結 果
2.1 痰液培養標本中病原菌分布情況
507例COPD合并肺炎患者痰液標本經培養共分離出152株病原菌: 革蘭氏陽性菌13株(8.55%), 包括溶血葡萄球菌9株(5.92%)、其他4株(2.63%); 革蘭氏陰性菌75株(49.34%), 包括銅綠假單胞菌18株(11.84%)、陰溝腸桿菌6株(3.95%)、鮑曼不動桿菌7株(4.60%)、肺炎克雷伯菌22株(14.47%)、大腸埃希菌5株(3.29%)、嗜水氣單菌3株(1.98%)、其他14株(9.21%); 真菌64株(42.11%), 包括光滑球擬酵母菌7株(4.60%)、白色假絲酵母菌51株(33.55%)、熱帶假絲酵母菌3株(1.98%)、曲霉菌2株(1.32%)、念珠菌1株(0.66%)。
2.2 痰標本中革蘭氏陰性菌對常用抗菌藥物的耐藥性分析
痰標本中革蘭氏陰性菌耐藥菌株以肺炎克雷伯菌、銅綠假單胞菌、鮑曼不動桿菌為主,這3種病原菌對氨芐西林的耐藥率均高達100.00%, 且對頭孢曲松、頭孢唑林、頭孢吡肟的耐藥率均不低于50.00%, 其中肺炎克雷伯菌對阿米卡星的耐藥率為0%。見表1。
2.3 痰標本中主要革蘭氏陽性菌對常用抗菌藥物的耐藥性分析
痰標本中革蘭氏陽性菌耐藥菌株為溶血葡萄球菌,其對青霉素的耐藥率高達100.00%, 且對氨芐西林、克林霉素、苯唑西林、亞胺培南的耐藥率均高于65.00%。見表2。
2.4 經驗性用藥患者與藥敏分析后用藥患者的mMRC評分、CAT評分比較
507例患者中,將檢出革蘭氏陽性菌、革蘭氏陰性菌的88例患者納入藥敏后用藥組(根據藥敏試驗結果用藥),另隨機抽取未檢出病菌的88例患者納入經驗性用藥組(經驗性用藥)。治療后,藥敏后用藥組患者mMRC評分、CAT評分均低于經驗性用藥組患者,差異有統計學意義(P<0.05), 見表3。

表1 痰標本中主要革蘭氏陰性菌對常用抗菌藥物的耐藥情況

表2 痰標本中主要革蘭氏陽性菌對常用抗菌藥物的耐藥情況
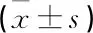
表3 2組患者治療后mMRC評分、CAT評分比較 分
3 討 論
COPD為臨床常見呼吸道疾病,隨著社會人口老齡化程度加劇,其發病率呈上升趨勢。COPD發病機制較為復雜,多與炎癥反應、免疫功能、糖皮質激素抵抗及應激反應等因素密切相關,隨著病情進展,可誘發肺部感染,使氣流受限程度加重,導致痰液濃度升高、呼吸困難,且多伴有咳嗽、喘息等,不僅影響患者生活質量,還會帶來巨大經濟負擔[10-11]。目前,臨床醫師治療COPD合并肺炎主要采用抗生素治療方案,但由于患者病情遷延難愈,長期使用抗生素會增強病原菌耐藥性,使耐藥菌株隨之增加,進而影響臨床療效。因此,對于經驗性治療效果不佳的COPD合并肺炎患者,臨床醫師應盡早明確其病原菌類型,并結合病原菌耐藥性優化治療方案,從而減輕患者病情[12]。本研究結果顯示, 507例COPD合并肺炎患者痰液標本經培養后共分離出病原菌152株,其中真菌64株、革蘭氏陰性菌75株、革蘭氏陽性菌13株,表明真菌、革蘭氏陰性菌是引發COPD患者肺炎的主要病原菌,故治療時應給予對真菌、革蘭氏陰性菌敏感度較高的抗菌藥物。賈云利[13]分析難治性哮喘合并肺部感染患者病原菌分布情況發現,患者的主要病原菌為革蘭氏陽性菌。由此可見,誘發肺炎的病原菌具有多樣性,且肺部感染病原菌分布情況與發生區域存在一定關系。
本研究藥敏試驗結果顯示, COPD合并肺炎患者普遍存在細菌耐藥現象(以革蘭氏陰性菌、革蘭氏陽性菌耐藥現象最為常見),革蘭氏陽性菌僅溶血葡萄球菌出現耐藥現象,其對青霉素耐藥率高達100.00%, 且對氨芐西林、克林霉素、苯唑西林、亞胺培南的耐藥率均高于65.00%; 革蘭氏陰性菌中耐藥菌株以肺炎克雷伯菌、銅綠假單胞菌、鮑曼不動桿菌為主,這3種病原菌對氨芐西林的耐藥率均高達100.00%, 且對頭孢曲松、頭孢唑林、頭孢吡肟的耐藥率均不低于50.00%, 其中肺炎克雷伯菌對阿米卡星無耐藥現象。王斐等[14]、張毅等[15]指出,肺炎可由多種病原菌相互作用引發,經驗性使用抗菌藥物可導致病原菌異變,產生多重耐藥性,此外由于該病病程較長,長期抗菌治療也是病原菌耐藥性升高的主要原因。根據臨床癥狀、病原菌分布情況和藥敏試驗結果調整治療方案,選用敏感性較高的抗菌藥物或聯用多種高敏感性藥物,能有效提高患者治療效果,緩解病情,降低延期治療或不合理用藥引起的耐藥風險[16]。本研究結果還顯示,藥敏分析后用藥患者的mMRC評分、CAT評分均低于經驗性用藥患者,差異有統計學意義(P<0.05), 提示預先對COPD合并肺炎患者進行病原菌耐藥性分析,有助于提升抗菌藥物使用合理性,可促進病情好轉,提高患者生活質量。分析原因,明確病原菌分布情況和藥敏試驗結果,能幫助醫師針對性使用耐藥性較低的抗生素,使治療方案更加合理,提升病原菌控制效果,減輕病原菌對呼吸道的損傷,進而提升患者生活質量。值得注意的是,醫院必須加強痰標本管理,以進一步提高痰標本合格率: ① 強調標本的重要性,增加科室護理人員,增設檢查環節,各班人員主動巡視并檢查標本臺面,及時送檢; ② 增設臺面單獨放置標本,嚴格規范標本分類,分區放置,護工不定時整理臺面; ③ 規范培訓制度,加強人員培訓,開展業務知識競賽,進行上崗操作考核; ④ 加強病房管理,減少探視,選擇安靜狀態下對患者進行告知,宣教時提高音量。
綜上所述, COPD合并肺炎患者感染的病原菌以革蘭氏陰性菌和真菌為主,且不同病原菌對不同抗菌藥物的耐藥性明顯不同。對患者痰液標本進行痰培養和藥敏試驗,能指導臨床醫師合理使用抗菌藥物,從而有助于改善患者呼吸功能和生活質量。

