不同給藥方式建立異丙腎上腺素誘導小鼠心肌纖維化模型的評價
焦浩淼 趙 文
心肌纖維化是多種心血管疾病的共同病理改變之一,如缺血性心臟病、高血壓性心臟病、病毒性心肌炎和動脈粥樣硬化等,最終會引起心臟功能障礙、心律失常和心力衰竭等嚴重并發癥,具有極高的發生率和危險性[1~3]。預防和逆轉纖維化一直是臨床治療心力衰竭過程中的關鍵,因此,研究心肌纖維化動物模型具有重要的臨床意義。
目前小鼠心肌纖維化模型構建主要分為藥物和手術兩種方式[4,5]。手術方式為主動脈弓結扎手術和腹主動脈結扎術,具有較高的死亡率且實驗周期較長[6]。藥物主要為皮下植入血管緊張素Ⅱ微量泵和注射異丙腎上腺素(isoproterenol, ISO),但血管緊張素Ⅱ的不穩定性和半衰期較短的特點降低了模型的成功率[7]。ISO引起心肌纖維化的主要作用機制為促使心肌細胞肥大,進而產生心肌病理性肥厚,長期作用最終引起心肌纖維化,更能真實模擬自然病程[8]。腹腔注射和皮下注射ISO具有操作簡單、價格低廉、實驗周期短和模型成功率高等特點[9]。但是至今對兩種給藥方法所構建的小鼠心肌纖維化模型相關指標的差異鮮有報道。本研究分別采用腹腔注射和皮下多點注射ISO兩種方法構建小鼠心肌纖維化模型,通過小鼠生存率、心功能受損、組織切片觀察和膠原蛋白表達等方面評估兩種給藥方式的差異,為更好地建立實驗動物模型提供參考。
材料與方法
1.實驗動物:8~10周齡的SPF級野生雄性C57BL/6J小鼠,體質量為18~22g,購自北京維通利華實驗動物技術有限公司,動物使用許可證號:SCXK(京)2019-0010。所有小鼠均飼養于SPF級動物房內,小鼠適應3天后進行實驗。
2.實驗材料與試劑:ISO(批號:A201102)購自美國Sigma Aldrich公司;0.9%氯化鈉溶液(批號:C-20082006-1)購自河南科倫藥業有限公司;甘油醛3-磷酸脫氫酶抗體(glyceraldehyde-3-phosphate dehydrogenase, GAPDH)購自北京中杉金橋生物科技有限公司;collagen Ⅰ和collagen Ⅲ抗體購自美國Cell Signaling Technology公司;通用型組織固定液、蛋白定量試劑盒和組織裂解液購自北京索萊寶生物科技有限公司。
3.實驗設計與分組:將60只雄性C57BL/6J小鼠隨機分為對照組、模型組A和模型組B,每組各20只。對照組給予腹腔注射0.9%氯化鈉溶液,模型組A按5mg/(kg·d)劑量腹腔注射ISO(0.9%氯化鈉溶液為溶劑),模型組B按5mg/(kg·d)劑量皮下多點注射ISO(0.9%氯化鈉溶液為溶劑),ISO實驗劑量參考本團隊前期實驗結果,每日1次,持續21天。實驗期間觀察小鼠生命體征,并計算不同時間點的小鼠死亡率。
4.觀察指標:末次給藥24h后,用醫用脫毛膏除去小鼠頸部和胸部毛發,將醫用耦合劑均勻涂抹于小鼠胸前,手持超聲探頭(MS-400),放置于小鼠胸腔部位,觀察心臟長軸切面,檢測小鼠心功能,通過軟件處理分析計算出計算左心室重量(left ventricular mass, LV mass)、左心室射血分數(left ventricular ejection fraction, LVEF)和左心室短軸縮短率(fractional shortening, LVFS);稱量小鼠的體質量,用4%水合氯醛處理小鼠,取出心臟和肺,濾紙吸去殘留的血液,稱量小鼠心臟和肺的重量,剝離出脛骨,量取脛骨長度,記錄數據,分別計算心臟重量與體質量比率(HW/BW)、心臟重量與脛骨長度比率(HW/TL)和肺臟重量與體質量比率(LW/BW)。
5.Masson染色:將取出的小鼠心臟置于0.9%氯化鈉溶液中,排出殘留血液,隨后放入組織固定液中固定48h。經過組織脫水、石蠟包埋、切片和脫蠟等步驟,并置于蘇木精中浸染10min,隨后用蒸餾水沖洗,再用Masson染液浸泡8min,后用2%冰醋酸浸洗適宜時間,分化液分化5min,然后直接用苯胺藍染液染3min。最后用中性樹膠封片。采用徠卡高通量掃描儀對切片進行掃描,并用Image J軟件進行分析,觀察小鼠心肌纖維化的程度。
6.Western blot法檢測:提取各組小鼠心肌組織蛋白,按照Western blot法實驗標準操作。

結 果
1.兩種不同給藥方法對小鼠死亡率的影響:對照組小鼠在21天實驗周期內未出現死亡。模型組A小鼠在第0~7天死亡1只,死亡率為5%;第8~14天死亡3只,死亡率為15.79%;第15~21天死亡3只,死亡率為18.75%。模型組B小鼠在第0~14天未出現死亡;第15~21天死亡1只,死亡率為5%。
2.兩種不同給藥方法對小鼠心功能的影響:末次給藥24h后,使用小動物超聲儀檢測各實驗組小鼠的心功能。各組代表性小鼠的M超如圖1所示,超聲統計結果如表1所示。與對照組比較,模型組A和模型組B小鼠的LV mass明顯升高,LVEF和LVFS明顯降低(P<0.05或P<0.01),長時間腹腔注射ISO和皮下多點注射ISO均可誘導小鼠心肌肥大和心功能降低;與模型組B比較,模型組A小鼠LVEF和LVFS均降低(P<0.05),LV mass升高(P<0.05),表明模型組A小鼠心功能受損更嚴重。

圖1 各組小鼠心臟超聲圖實線箭頭所示為左心室舒張末期內徑,虛線箭頭所示為左心室收縮末期內徑。A.對照組;B.模型組A;C.模型組B
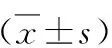
表1 各組小鼠心臟超聲參數比較
3.兩種不同給藥方法對小鼠HW/BW、HW/TL和LW/BW的影響:末次給藥24h后,稱量小鼠的心臟和肺,量取小鼠脛骨長度,并進行計算分析,詳見表2。與對照組比較,模型組A的HW/BW、HW/TL和LW/BW值均明顯升高(P<0.05或P<0.01),模型組B的HW/BW和HW/TL值均相對升高(P<0.05);與模型組A比較,模型組B小鼠HW/TL值降低(P<0.05)。以上結果表明,長時間腹腔注射ISO和皮下多點注射ISO均可誘導小鼠心肌肥大和心功能降低,模型組A小鼠出現心力衰竭,影響肺循環,出現了明顯的肺水腫,而模型組B則沒有出現肺水腫。
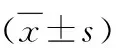
表2 各組小鼠HW/BW、HW/TL和LW/BW比較
4.各組小鼠Masson染色結果:Masson染色主要區分心肌纖維和膠原纖維,心肌纖維呈現紅色,膠原纖維則呈現藍色。如圖2所示,對照組小鼠心肌纖維排列規則且界限清晰,與對照組比較,模型組A和模型組B的小鼠心肌組織染色結果都出現大量結構紊亂的纖維組織,膠原大量沉積,纖維化明顯。定量結果顯示,模型組A和模型組B的小鼠心肌纖維化面積均明顯增加(P<0.05或P<0.01),分別增加了59.7%和52.3%。與模型組A比較,模型組B小鼠心肌纖維化面積無明顯變化(P>0.05)。長時間腹腔注射ISO和皮下多點注射ISO均可誘導小鼠出現纖維化反應。

圖2 各組小鼠心臟組織切片(Masson染色,×200)A.對照組;B.模型組A;C.模型組B
5.各組小鼠心臟組織膠原蛋白表達情況:與對照組比較,模型組A和模型組B的小鼠心肌組織膠原蛋白collagen Ⅰ和collagen Ⅲ的表達量均明顯升高(P<0.05或P<0.01),詳見圖2、表3。表明長時間腹腔注射ISO和皮下多點注射ISO均可誘導小鼠心肌膠原蛋白異常分泌。

表3 各組小鼠心臟組織膠原蛋白表達情況比較
討 論
成年哺乳動物的心室心肌主要由心肌細胞和成纖維細胞組成,而成纖維細胞在心肌纖維化進程中扮演重要的角色[10]。心肌成纖維細胞在感染、炎癥、代謝失衡和長期負荷等條件下活化為肌成纖維細胞,膠原蛋白分泌異常,膠原逐漸沉積,多余的膠原蛋白增加心室壁的硬度,引起心室重塑,最終阻礙心肌正常的收縮和舒張[11,12]。隨著纖維化的發生和發展,心臟功能進一步降低,加重心肌缺血缺氧,破壞心肌收縮力,以致心力衰竭,并引發一系列的并發癥,降低患者的生存率[13]。ISO是一種β腎上腺素受體激動劑,已成功應用于構建小鼠心肌纖維化模型中[14]。根據本研究前期模型構建預實驗結果,并考慮飼養動物實驗成本問題,將實驗周期設定為21天。

圖3 各組小鼠心臟組織中膠原蛋白表達情況的電泳圖1.對照組;2.模型組A;3.模型組B
本研究首先比較了兩種給藥方式誘導的小鼠死亡率,與模型組A比較,模型組B呈現較低的死亡率,并且隨著實驗周期延長,模型組A小鼠的死亡率呈現大幅增加,分析原因為腹腔注射ISO引起小鼠腹膜血管擴張,導致腹腔充血;腹腔注射操作不當刺破內臟;模型動物因心力衰竭死亡。與對照組比較,模型組A和模型組B小鼠均出現心臟重量增加,心室腔變大,心功能下降,心肌纖維增生,心肌膠原蛋白表達增加,表明心肌纖維化模型構建成功。心肌組織膠原蛋白定量和Masson染色結果表明,模型組A和模型組B纖維化相關指標比較,差異無統計學意義。同時模型組A小鼠LW/BW值明顯升高,出現肺水腫,小鼠已表現出心力衰竭,表明模型組A小鼠心功能受損比模型組B更嚴重。腹腔注射ISO對小鼠心功能降低更明顯,并引發一系列并發癥,加快心力衰竭進程。
本研究發現,兩種給藥方式結果的差異可能是小鼠機體對ISO的藥代動力學差異。腹膜表面密布血管和淋巴管,且面積大,具有很強的吸收能力,起效快且作用強烈[15]。皮下結締組織間隙多,血管少,血流速度慢,藥物吸收緩慢,作用維持時間長且可維持穩定的藥效[16]。心肌纖維化是一種長期慢性病變結果[17]。腹腔注射ISO方法可能更適用于心力衰竭和急性心肌缺血損傷等模型。本研究在多層面上評價了腹腔注射和皮下多點注射ISO兩種方法建立的小鼠心肌纖維化模型,皮下多點注射ISO方法具有較低的死亡率和較高的心肌纖維化發生率,在構建小鼠心肌纖維化模型上效果更好,為研究心肌纖維化提供了很好的實驗基礎。

