白皮杉醇對膿毒癥肺損傷小鼠代謝重編程的影響
熊 娟 高明朗 范國華
膿毒癥肺損傷是膿毒血癥最常見的并發癥之一,也是ICU住院患者最常見的死亡原因之一[1]。膿毒癥肺損傷的發病機制復雜,目前已被公認的發病機制包括炎癥風暴、氧化應激、多種形式的細胞死亡及代謝重編程[2,3]。巨噬細胞的代謝重編程在調節其抗炎/促炎表型方面發揮重要作用[4]。既往研究表明,膿毒癥肺損傷時,肺組織發生了明顯的代謝重編程,糖酵解被顯著激活。相反抑制糖酵解可顯著減輕小鼠膿毒癥肺損傷[5]。組蛋白去乙酰化酶7(histone deacetylase 7, HDAC7)是具有調控染色體的結構修飾和調節并影響基因表達的酶,可通過驅動Toll樣受體4(Toll like receptor 4,TLR4)介導的糖酵解促進巨噬細胞炎性反應[6,7]。白皮杉醇是一種存在于各種水果和蔬菜中的小分子天然多酚二苯乙烯化合物,具有重要的抗炎活性,同時也是一種重要的HDAC7抑制劑,但在膿毒癥肺損傷中的作用目前尚未見報道[8,9]。本研究觀察并探討白皮杉醇預處理對膿毒癥小鼠急性肺損傷的影響及潛在作用機制,旨在為今后膿毒血癥及急性肺損傷的預防和治療提供一定的參考依據。
材料與方法
1.材料與試劑:脂多糖(lipopolysaccharide, LPS,純度:98.61%)購自Sigma-Aldrich(上海)貿易有限公司;白皮杉醇(純度:98.09%,批號:HY-13518)購自MedChemExpress(中國)公司;一抗GLUT1(批號:ab115730)、HK2(批號:ab209847)、PDK2(批號:ab68164)、PKM2(批號:ab85555)、HDAC7(批號:ab166911)、GAPDH(批號:ab8245)、羊抗兔IgG(批號:ab52947)購自英國Abcam公司。
2.實驗動物及膿毒癥肺損傷模型的建立:無特定病原體(specified-pathogens free, SPF)級雄性C57/B6小鼠(平均體質量為24.11±2.83g,8~10周齡)購自湖北省實驗動物研究中心。實驗動物實驗和管理批號:WDRM20180401。采用隨機數字表法,將32只小鼠隨機分為4組,即對照組、模型組、低劑量治療組和高劑量治療組,每組各8只。對照組不做任何處理,其他3組采用脂多糖(lipopdysaccharide,LPS,10mg/kg)單次腹腔注射的方式構建膿毒癥肺損傷小鼠模型,其中低劑量治療組和高劑量治療組小鼠于LPS注射前7天分別給予25mg/(kg·d)和100mg/(kg·d)的白皮杉醇灌胃,對照組和模型組給予等量0.9%氯化鈉溶液灌胃。LPS腹腔注射12h后,處死小鼠并留取支氣管肺泡灌洗液(bronchoalveolar lavage fluid,BALF)和肺組織標本。本研究中所有操作均在武漢大學人民醫院實驗動物護理和使用委員會獲得批準[批號:WDRM動(福)第20210305號]。
3.BALF中乳酸含量及乳酸脫氫酶活性的測定:LPS刺激12h后,腹腔注射濃度為1%的戊巴比妥鈉麻醉小鼠,暴露小鼠胸腔后行氣管插管,用特定的血管夾夾閉小鼠右肺門。隨后,使用0.3ml的磷酸鹽緩沖液向小鼠左肺灌注,并收集灌洗液。重復灌注2次后,將兩次的灌洗液混合均勻,并于4℃下在離心機中以1000r/min的轉速離心10min。獲得上清液后,根據酶聯免疫吸附試驗(enzyme linked immunosorbent assay,ELISA)繪制標準曲線,并根據各個樣本的吸光度計算BALF中乳酸含量及乳酸脫氫酶活性。
4.HE染色:取小鼠肺組織于多聚甲醛(4%)中固定1天,分別用自來水和蒸餾水沖洗,并使用梯度乙醇脫水,制成蠟塊后切片。將得到的肺組織切片在溫箱中烘烤1h后,使用梯度乙醇脫水、二甲苯脫蠟、蘇木精-伊紅(hematoxylin-eosin,HE)染色后在光學顯微鏡下觀察并拍照。同時對各組小鼠肺損傷情況進行評分,具體如下:0分:肺組織正常;1分:損傷少于25%;2分:損傷為25%~50%;3分:損傷為50%~75%;4分:損傷≥75%。
5.實時熒光定量聚合酶鏈反應(real-time fluorescence quantitative polymerase chain reaction,RT-qPCR)檢測促炎性細胞因子:使用Trizol法提取各組小鼠肺組織中總RNA后,通過反轉錄試劑盒獲取cDNA。采用SYBRGreen PCR試劑盒進行RT-qPCR反應。具體程序如下:95℃ 60s,95℃ 15s,60℃ 20s,72℃ 45s,共40個循環,72℃延伸5min,通過2-△△CT計算各目的基因mRNA的相對表達水平,以GAPDH作為內參基因。RT-qPCR的引物序列詳見表1。

表1 RT-qPCR的引物序列
6.Western blot法檢測:提取各組小鼠肺組織樣本中的總蛋白,并通過BCA法測定各樣本中蛋白濃度,并將其煮沸變性后置于-80℃長期保存。隨后對各組蛋白進行SDS-PAGE電泳,并將蛋白樣品轉到PVDF膜上。脫脂牛奶封閉條帶后,加入對應一抗進行孵育過夜。次日,使用TBST漂洗條帶后,使用二抗于搖床孵育1h。最后,使用化學發光法對各蛋白條帶進行曝光,最后使用Image Lab對各泳道的灰度值進行半定量分析。
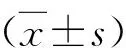
結 果
1.白皮杉醇對膿毒癥小鼠肺病理損傷的影響:HE染色結果顯示,模型組小鼠較對照組小鼠肺組織中出現了明顯的炎性細胞浸潤、肺水腫及肺泡腔出血(圖1),其肺損傷評分明顯增加(表2);與模型組比較,低劑量治療組和高劑量治療組小鼠肺組織的上述病理損傷明顯減輕,肺損傷評分明顯降低(表2)。此外,低劑量治療組和高劑量治療組小鼠肺泡灌洗液中乳酸含量和乳酸鹽脫氫酶活性較模型組明顯降低(P<0.05,表2)。

圖1 小鼠肺病理切片(HE染色,×200)A.對照組;B.模型組;C.低劑量治療組;D.高劑量治療組
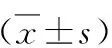
表2 各組小鼠肺損傷評分及肺泡灌洗液中損傷標志物水平
2.白皮杉醇對膿毒癥小鼠肺組織炎性反應的影響:RT-qPCR檢測結果顯示,與對照組比較,模型組小鼠肺組織中IL-1β、IL-6和TNF-α的mRNA表達水平明顯升高(P<0.05);與模型組比較,低劑量治療組和高劑量治療組小鼠肺組織中IL-1β、IL-6和TNF-α的mRNA表達水平則明顯降低(P<0.05,表3)。
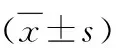
表3 各組小鼠肺組織中促炎性細胞因子的mRNA相對表達水平
3.白皮杉醇對膿毒癥小鼠肺組織糖酵解的影響:Western blot法檢測結果顯示,與對照組比較,模型組小鼠肺組織中糖酵解標志蛋白(GLUT1、HK2、PDK2和PKM2)的相對表達水平明顯升高(P<0.05);與模型組比較,低劑量治療組和高劑量治療組小鼠肺組織中GLUT1、HK2、PDK2和PKM2的相對表達水平明顯降低(P<0.05,圖2,表4)。
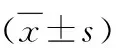
表4 各組小鼠肺組織中糖酵解標志蛋白的相對表達水平
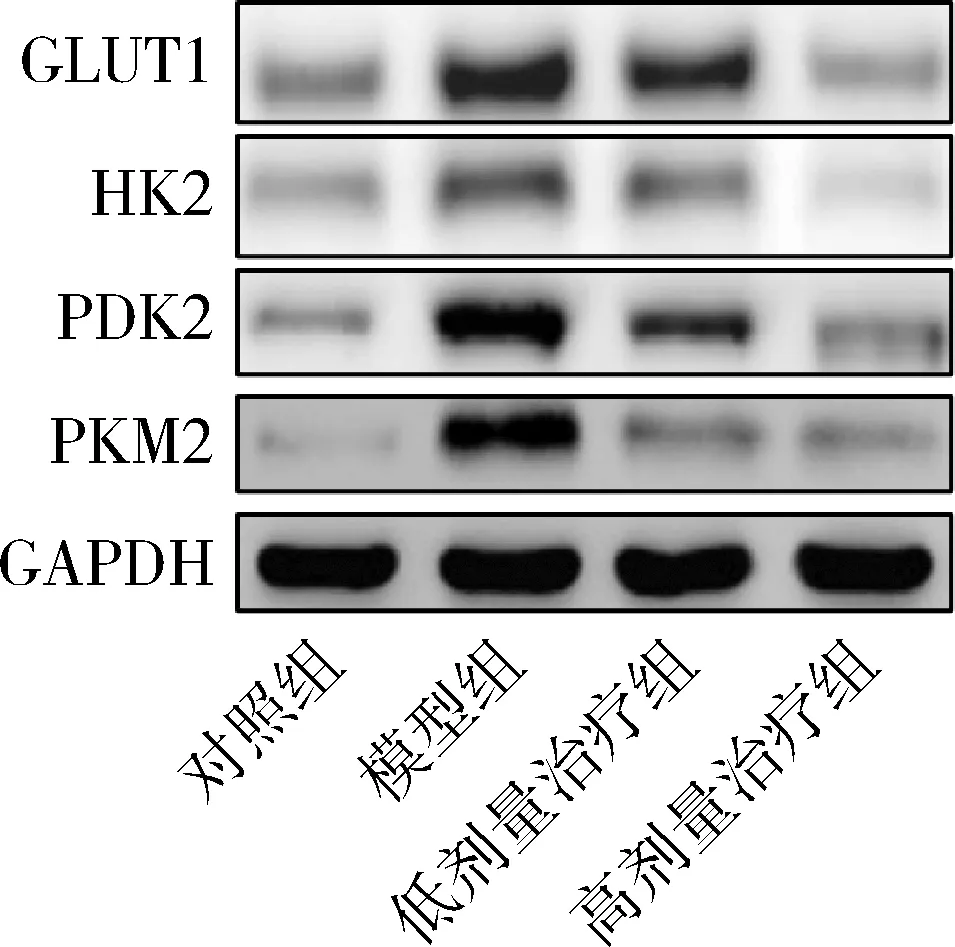
圖2 小鼠肺組織中糖酵解標志蛋白的Western blot法條帶圖
4.白皮杉醇對膿毒癥小鼠肺組織HDAC7蛋白表達的影響:Western blot法檢測結果顯示,與對照組比較,模型組小鼠肺組織中HDAC7的蛋白相對表達水平明顯升高(4.23±0.29 vs 1.55±0.17,P<0.05);與模型組比較,低劑量治療組和高劑量治療組小鼠肺組織中HDAC7的蛋白相對表達水平明顯降低(1.39±0.12、1.03±0.08 vs 4.23±0.29,P<0.05,圖3)。
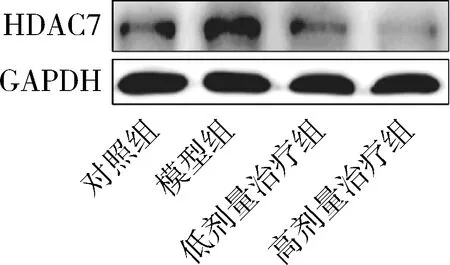
圖3 小鼠肺組織中HDAC7的Western blot法條帶圖
討 論
急性肺損傷是膿血毒癥患者死亡的主要原因之一,糖酵解增加及代謝重編程可通過激活炎性反應加速肺損傷進程[10,11]。本研究中,膿毒癥肺損傷小鼠肺組織促炎性細胞因子的mRNA表達水平增加,GLUT1、HK2、PDK2和PKM2的蛋白表達升高。而25mg/(kg·d)和100mg/(kg·d)的白皮杉醇預處理可明顯減輕LPS誘導的小鼠肺損傷,抑制肺部炎性反應,同時降低肺組織糖酵解水平。進一步的研究揭示白皮杉醇的這種肺保護作用可能與其對HDAC7的抑制有關。
糖酵解是提供能量的重要代謝途徑之一,主要發生在細胞質中,可將葡萄糖轉化為丙酮酸[12]。巨噬細胞在體內主要存在兩種表型,分別是促炎的M1表型和抗炎/促修復的M2表型[13]。既往觀點認為,M1型巨噬細胞能量來源主要依賴于糖酵解,并在三羧酸循環中出現兩次斷裂,導致琥珀酸和衣康酸的積累。過量的琥珀酸進一步導致糖酵解基因轉錄的激活,從而誘發了巨噬細胞的代謝重編程。巨噬細胞的代謝重編程則可進一步加速巨噬細胞衰老,同時激活炎性反應[14,15]。既往研究顯示,在膿毒癥肺損傷發生時,肺組織中糖酵解水平明顯升高,同時伴有大量乳酸堆積。而使用2-脫氧-D-葡萄糖(2-DG)抑制糖酵解后可顯著減輕膿毒癥小鼠肺病理損傷及炎性反應,同時小鼠肺組織中NLRP3炎性小體的激活被明顯抑制[5]。本研究發現,白皮杉醇干預可明顯降低膿毒癥小鼠肺組織中IL-1β、IL-6和TNF-α,同時還抑制了肺組織中的糖酵解水平。
白皮杉醇作為一種多靶點的天然多酚化合物,存在于日常的多種食物中,包括藍莓、葡萄、百香果和花生。作為白藜蘆醇的前體,白皮杉醇同樣表現出重要的藥理活性,包括抗衰老、抗癌、抗糖尿病、抗炎癥、抗肥胖和抗氧化效應[16]。例如,白皮杉醇可通過激活SIRT3/FOXO3a信號通路減輕神經元細胞的線粒體功能障礙,最終抑制神經元凋亡[17]。白皮杉醇還能通過提高谷胱甘肽水平和過氧化氫酶活性,顯著減輕四氯化碳誘導的肝氧化性損傷和纖維化[18]。在膿毒癥心肌損傷中,白皮杉醇可直接抑制JAK2,改善小鼠心臟功能[19]。既往研究顯示,HDAC7可促進巨噬細胞中TLR4依賴的促炎性細胞因子表達并激活炎性反應,且這種效應與HDAC7對巨噬細胞的糖酵解調控有關[6]。本研究表明,白皮杉醇預處理可顯著抑制膿毒癥小鼠肺組織中HDAC7的蛋白表達,因此推測白皮杉醇對膿毒癥小鼠肺組織的糖酵解抑制可能與其對HDAC7蛋白表達下調有關。
綜上所述,白皮杉醇可能通過抑制HDAC7介導的糖酵解減輕膿毒癥小鼠肺損傷和炎性反應,進而發揮肺保護作用,但白皮杉醇對HDAC7的抑制機制還需要未來進一步探索。

