不同養殖模式黃鱔胃腸道微生物群落結構分析
鄭菲菲,單宇峰,祝東梅,楊禧文,陳 菲,葉 可,馬 帥,王玉軍
(華中農業大學水產學院,水產養殖國家級實驗教學示范中心,武漢 430070)
黃鱔(Monopterusalbus)隸屬于合鰓魚科黃鱔屬,常棲息于稻田、河流湖泊等淤泥質水底層,適應能力強。黃鱔味道鮮美、營養價值高,富含各種微量元素及不飽和脂肪酸等營養物質,作為滋補佳品深受人們喜愛,因而市場需求大幅增加,野生黃鱔已供不應求,目前多采用網箱進行高密度集約化養殖[1,2]。在集約化養殖過程中黃鱔會過量食用投喂的高蛋白、高脂肪餌料,但其消化能力較其它淡水肉食性魚類弱,過量及不均衡的飲食會增加胃腸及肝膽的負擔,加之高密度的養殖環境導致水質惡化快,極易引發黃鱔出血病、腸炎病、赤皮病、腐皮病等,甚至造成大量死亡,嚴重影響了黃鱔產業的健康發展[2,3]。
在長期進化過程中,魚類與其胃腸道內的微生物間互惠雙贏,形成了復雜的共生關系[4]。研究表明,不同養殖模式會對魚類腸道微生物菌群產生影響。趙月季等[5]研究發現,4種養殖模式下凡納濱對蝦(Penaeusvannamei)腸道微生物群落結構存在顯著差異,而淡水池塘養殖模式腸道微生物菌群最穩定。此外,邱楚雯等[6]研究發現養殖模式能夠通過改變水體中氮、磷的含量對水體和暗紋東方鲀(Takifuguobscures)腸道的微生物群結構產生一定的影響。盛鵬程等[7]發現投喂不同飼糧也會對烏鱧(Channaargus)腸道生物群落結構和微生物多樣性產生影響,丁紅秀等[8]研究發現4種不同生境來源的草魚(Ctenopharyngodonidellus)腸道微生物組成和群落特征隨著養殖水體的餌料和環境因子的變化而產生較大差異。另外,魚類腸道不同區段的生理生化環境也會對相應區段微生物菌群產生影響[9]。但是,目前關于不同養殖模式下黃鱔腸道微生物的差異仍未有系統研究。
目前,黃鱔多以網箱養殖為主,主要分為投喂魚漿與投喂水蚯蚓,以及與蝦蟹混放散養等養殖模式。究竟哪種養殖模式更有益于黃鱔腸道菌群值得探究。因此,本實驗通過高通量測序的方法,對蝦塘散養、蟹塘散養、網箱投喂魚漿及網箱投喂水蚯蚓4種養殖模式下黃鱔胃及腸道的微生物進行檢測,分析比對不同養殖模式黃鱔胃及腸道微生物菌群的異同,探究不同養殖模式對黃鱔胃及腸道微生物菌群的影響,以期為黃鱔的健康養殖提供一定的理論依據。
1 材料與方法
1.1 樣品采集
4種不同養殖模式黃鱔采取自仙桃市西流河鎮,每種養殖模式隨機選取9尾,體重約為(117.75±31.77) g。用MS222麻醉后,用75%酒精擦拭黃鱔體表消毒,迅速在BSC-1300型無菌操作臺內解剖,分別取胃和腸道[10],每3尾黃鱔的相同位置的部分組織放入一個2 mL凍存管中混為一個樣本,每種養殖模式取3個混合樣本。樣品取好后迅速放于液氮中凍存備用。蝦塘散養組、蟹塘散養組、網箱投喂魚漿組和網箱投喂水蚯蚓組的黃鱔樣品編號分別為:A、B、C和D;胃編號為X,腸道編號為Y。
1.2 DNA提取和PCR擴增
用DNA提取試劑盒(Omega Bio-Tek公司,美國)提取黃鱔胃、腸微生物總DNA,用Nanodrop NC2000定量DNA,同時用1%瓊脂糖凝膠電泳檢測DNA質量。
兩步建庫法:第一步以DNA為模板,設計帶接頭的引物進行PCR,第二步以第一步的PCR產物為模板在9902型96 well PCR儀進行PCR。用16S rRNA V3-4區通用引物(338F:5′-ACTCCTACGGGAGGCAGCA-3′,806R:5′-GGACTACHVGGGTWTCTAAT-3′)進行目標區域PCR擴增;擴增體系(30 μL):基因組DNA 50 ng±20%、338F(10 μmol/L) 0.9 μL、806R(10 μmol/L) 0.9 μL、KOD FX Neo Buffer 15 μL、dNTP(2 mmol/L each) 6 μL、KOD FX Neo(NEB公司,美國) 0.6μL、ddH2O補至30 μL;PCR程序:98 ℃ 2 min;98 ℃ 30 s,50 ℃ 30 s,72 ℃ 60 s,30個循環;72 ℃ 5 min,4 ℃直到停止。Solexa PCR(20 μL體系):目的區域PCR純化產物5 μL、2 μmol/L MPPI-a 2.5 μL、2μmol/L MPPI-b 2.5 μL、2×Q5 HF MM 10 μL,反應條件:98 ℃ 30 s;98 ℃ 10 s,65 ℃ 30 s,72 ℃ 30 s,10個循環;72 ℃ 30 s;72 ℃ 5 min;1.8%的瓊脂糖凝膠,DYY-6C型電泳儀電壓為120 V,電泳40 min;將PCR產物根據電泳定量結果,按照質量比1∶1進行混樣;混樣后,采用OMEGA DNA純化柱(Monarch公司,美國)進行過柱純化;1.8%的瓊脂糖凝膠,120 V 40 min電泳后,切目的片段并回收;構建好的文庫在武漢擎科生物技術有限公司用illumina Novaseq6000 PE250進行高通量測序。
1.3 測序數據分析
用Trimmomatic v0.33軟件對測序得到的原始序列進行過濾,然后使用cutadapt 1.9.1軟件進行引物序列的識別與去除,得到不包含引物序列的高質量序列,使用QIIME2 2020.6軟件中的DADA2方法進行去噪并去除嵌合體序列,得到最終有效序列;利用USEARCH version 10.0軟件在相似性97%的水平上對序列進行可操作分類單元(operational taxonomic unit,OUT)分析;再利用R語言工具繪制稀釋性曲線圖、等級豐度曲線圖、Venn圖、群落結構圖和熱圖;使用QIIME2軟件對樣品Alpha多樣性指數進行評估,分析樣品間物種多樣性。
2 測序結果
2.1 樣品測序質量分析
基于Illumina Novaseq測序及數據預處理總共獲得3 689 315條有效序列;以97%相似性水平為標準劃分各樣品的OTU數量。利用已測得的rDNA序列中已知的各OTU相對比例與其相對應的OTU數量的期望值來構建稀釋性曲線,各樣品曲線都達到平臺期(圖1),等級豐度曲線反映出4組黃鱔胃腸道內物種分布均勻(圖2)。綜上所述,說明隨著測序深度的增加測序量達到飽和且測序質量比較好、數據量合理,測序的深度基本能夠覆蓋不同養殖模式黃鱔胃腸道微生物的所有物種。
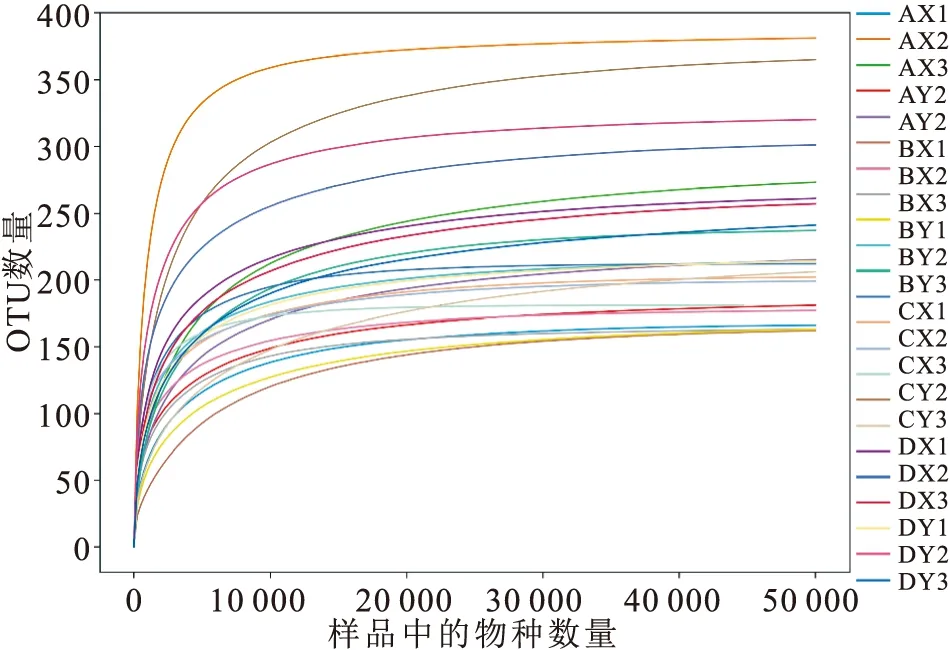
圖1 不同養殖模式樣品高通量測序結果的稀釋曲線Fig.1 The rarefaction curve of high-through sequencing result of samples from different culture modes
2.2 胃腸道微生物Alpha多樣性分析
根據4種養殖模式中黃鱔胃腸道微生物OTU數量,進行Alpha指數分析。通過覆蓋率來評估抽樣的完整性,本研究中各樣品OTUs的覆蓋率是99.95%~100%,說明各樣品中的全部微生物種類幾乎都被檢測到(表1)。OTU、Chao1和ACE表征豐富度,數值越高,表明群落的總數越高即豐富度越高;Shannon和Simpson指數表征物種多樣性,數值越高,表明群落的多樣性越高。
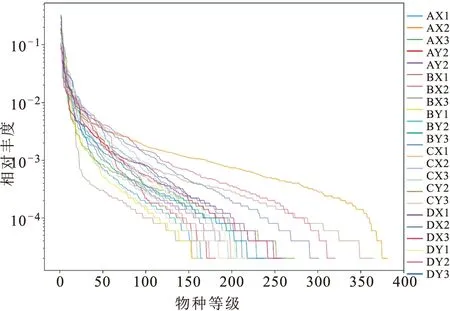
圖2 等級豐度曲線圖Fig.2 Curves of rank abundance
4種養殖模式胃的OTU、Chao1和ACE指數表明,網箱投喂水蚯蚓組和蝦塘散養組菌落豐富度都較高,網箱投喂魚漿組次之,蟹塘散養組豐富度最低;胃的Shannon和Simpson指數表明網箱投喂魚漿組的物種多樣性最高,其次是網箱投喂水蚯蚓組和蝦塘散養組,物種多樣性最低的是蟹塘散養組。
4種養殖模式腸道的OTU、Chao1和ACE指數表明,網箱投喂魚漿組和網箱投喂水蚯蚓組的黃鱔菌落豐度都較高,蟹塘散養組次之,蝦塘散養組豐富度最低;腸道的Shannon和Simpson指數表明網箱投喂水蚯蚓組的物種多樣性最高,其次是網箱投喂魚漿組和蝦塘散養組,物種多樣性最低的是蟹塘散養組。
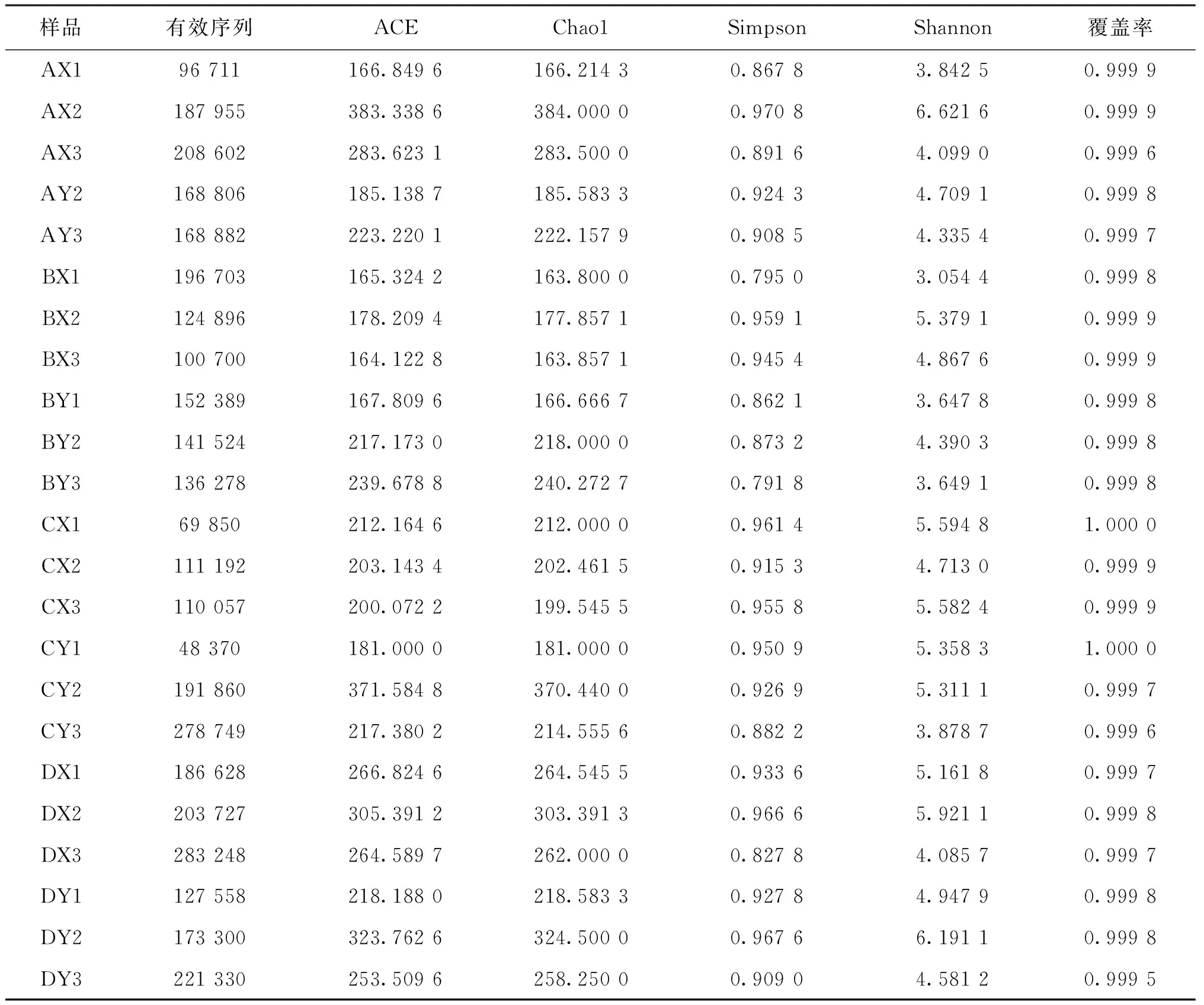
表1 不同養殖模式黃鱔胃腸道微生物Alpha多樣性分析Tab.1 Alpha-diversity of stomach and intestines microbial community of M.albus in different culture modes
2.3 Venn圖分析
為分析4種不同養殖模式胃腸道樣品中共有和獨有的OTU的數目,根據樣本的OTU繪制Venn圖。如圖3所示,蝦塘散養組、蟹塘散養組、網箱投喂魚漿組和網箱投喂水蚯蚓組胃的OTU數分別為474、337、392和470個,共有的OTU數量為152個,特有的OTU數量分別為89、30、43和103個,分別占各自所有OTU總數的18.78%、8.90%、10.97%和21.91%。4種養殖模式腸道的OTU數量分別為308、389、478和458個,共有的OTU數量為143個,特有的OTU數量分別為49、50、86和83個,分別占各自所有OTU總數的15.91%、12.85%、17.99%和18.12%。
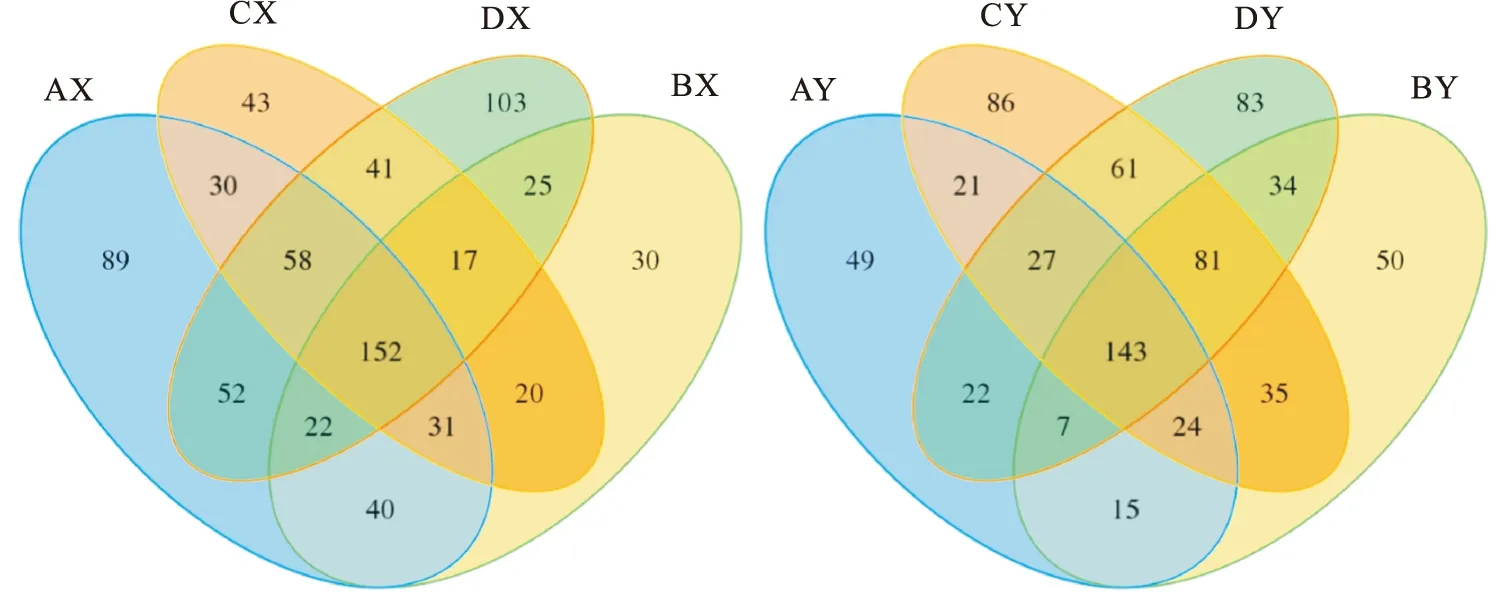
圖3 不同養殖模式樣品OTU分布Venn圖Fig.3 OTU Venn analysis of samples from different culture modes
2.4 腸道微生物群落結構和組成分析
樣品中所有OUT經物種注釋,在門和屬的水平分析不同組別的優勢菌種。圖4為門水平上微生物的相對豐度,4種養殖模式下黃鱔的胃腸道微生物主要由厚壁菌門、變形菌門、放線菌門、擬桿菌門和疣微菌門組成,但優勢菌群存在一定差異。不同養殖模式黃鱔消化道的不同區段優勢菌群也不同,4種養殖模式下黃鱔胃的最主要優勢菌均是厚壁菌門,變形菌門在蝦塘散養、蟹塘散養和網箱投喂魚漿養殖環境下也較多,疣微菌門只在網箱投喂魚漿及網箱投喂水蚯蚓養殖環境下占優勢,擬桿菌門只在網箱投喂水蚯蚓養殖環境下占有優勢。除蟹塘散養外,其余3種養殖模式黃鱔腸道的優勢菌均為厚壁菌門,蟹塘散養養殖模式中黃鱔腸道的優勢菌為變形菌門。
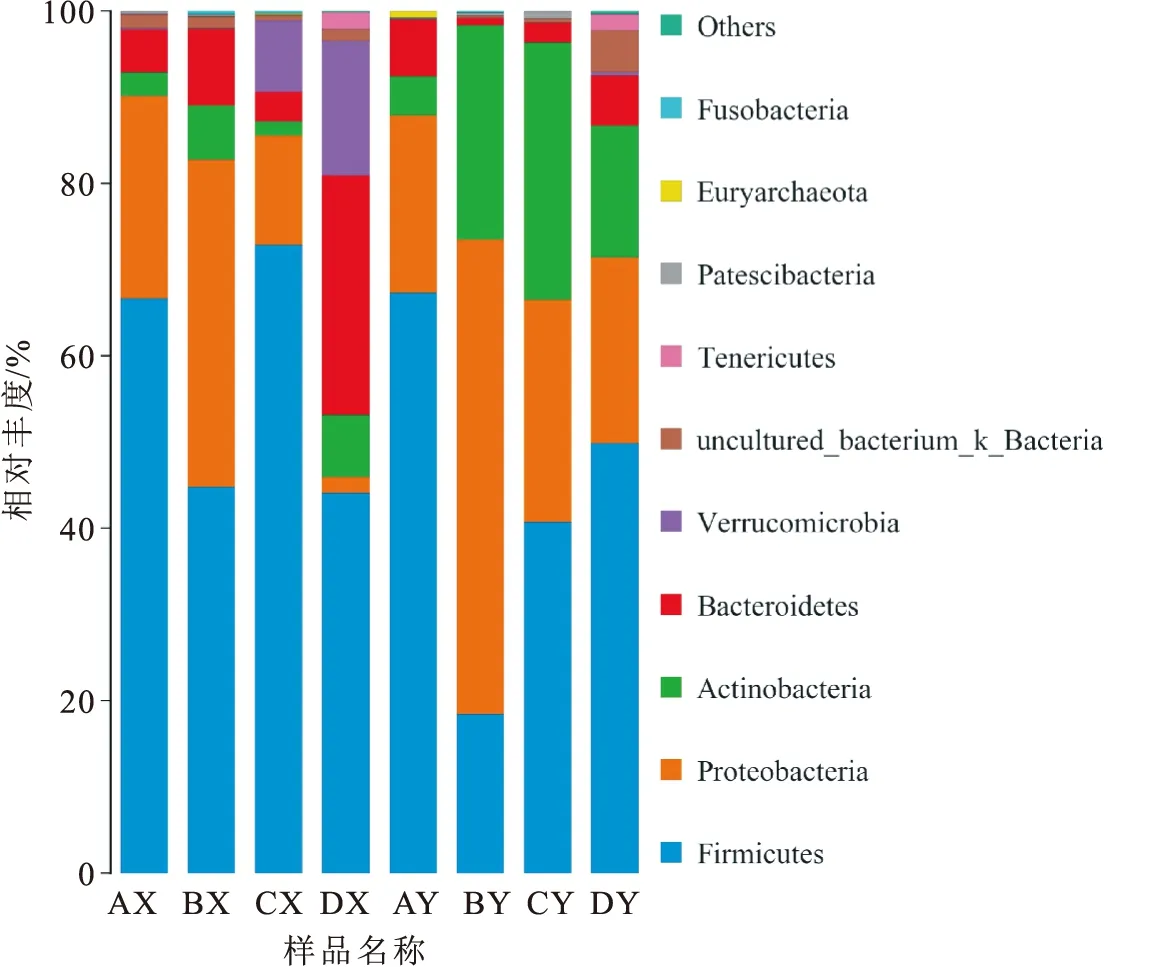
圖4 門水平上微生物相對豐度Fig.4 Microbial community structure of different samples in phylum
圖5為屬水平上微生物的相對豐度,4種養殖模式黃鱔消化道優勢菌群均差異明顯。就黃鱔胃而言,蝦塘散養和網箱投喂魚漿組的優勢菌群為韋榮球菌屬(Veillonella),分別占細菌總數的51.81%、38.53%;蟹塘散養組優勢菌群為韋榮球菌屬和綠膿桿菌屬(Pseudomonas),分別占細菌總數的25.46%、27.22%;網箱投喂水蚯蚓組的優勢菌群為糞桿菌屬(Faecalibacterium)與嗜黏蛋白阿克曼菌屬(Akkermansia),分別占細菌總數的22.13%、15.53%。綜上所述,除網箱投喂水蚯蚓組外,其余3種養殖模式中黃鱔胃的優勢菌群都有韋榮球菌屬。就黃鱔腸道而言,除蝦塘散養組的優勢菌為瘤胃球菌屬(Ruminococcus),占細菌總數的26.56%,其余3種養殖模式的優勢菌群中都有雙歧桿菌屬。其中蟹塘散養組的優勢菌為克雷伯氏菌屬(Klebsiella)、雙歧桿菌屬(Bifidobacterium),分別占細菌總數的25.70%和23.58%;網箱投喂魚漿組的優勢菌為雙歧桿菌屬,占細菌總數的24.63%;網箱投喂水蚯蚓組的優勢菌為雙歧桿菌屬和流感嗜血桿菌屬(Haemophilus),分別占細菌總數的13.28%、14.99%。

圖5 屬水平上微生物相對豐度Fig.5 Microbial community structure of different samples in the genus
2.5 腸道微生物群落相對豐度
對黃鱔胃腸道微生物在屬水平上進行聚類式熱圖分析,由圖6可看出,4種養殖模式下黃鱔胃腸道微生物主要聚為兩大分支,多數胃樣品聚為一支,多數腸道樣品聚為一支。
就黃鱔胃而言,蝦塘散養組中的韋榮球菌屬豐度顯著高于其它組;蟹塘散養組中綠膿桿菌屬和柯林斯菌屬(Collinsella)豐度顯著高于其它組;網箱投喂魚漿組中霍爾德曼氏菌屬(Holdemanella)、韋榮球菌屬、疣微菌屬等豐度顯著高于其它組;網箱投喂水蚯蚓組中豐度較高的菌群有糞桿菌屬、嗜黏蛋白阿克曼菌屬、擬桿菌屬(Bacteroides)和另枝菌屬(Alistipes)等。
就黃鱔腸道而言,蝦塘散養組中瘤胃球菌屬、毛螺菌科的豐度顯著高于其它組;蟹塘散養組中豐度顯著較高的為克雷伯氏菌屬(Klebsiella)、腸桿菌屬(Enterobacter)、雙歧桿菌屬和埃希氏菌屬(Escherichia);羅氏菌屬(Roseburia)、考拉桿菌屬(Phascolarctobacterium)和雙歧桿菌屬等在網箱投喂魚漿組中豐度顯著較高;網箱投喂水蚯蚓組中流感嗜血桿菌屬、罕見小球菌屬(Subdoligranulum)等豐度較高。

圖6 微生物群落在屬水平的熱圖分析Fig.6 Microbial community heatmap analysis of different samples in genus
3 討論
綜上所述,蟹塘散養組胃腸道微生物物種多樣性和豐度均最低,而網箱投喂水蚯蚓組黃鱔胃腸道微生物多樣性和豐度都較高。研究表明,腸道微生物多樣性與機體的健康密切相關,腸道微生物多樣性的降低可能會成為多種疾病的誘因,例如炎癥性腸病等[11]。朱昊俊等[12]也發現,黃顙魚腸道微生物多樣性更高,穩定性更好,對疾病的抵抗力可能更強。但腸道菌群是否健康不僅和腸道微生物多樣性相關,還和優勢菌群關系密切。比如,飼喂畜禽內臟飼料的烏鱧腸道細菌群落多樣性比飼喂冰鮮魚組的高,但是其存在潛在致病菌,從烏鱧腸道微生物健康角度考慮,冰鮮魚較畜禽內臟更適合作為烏鱧的飼糧[7]。
分析發現4種養殖模式下黃鱔胃腸道微生物主要由厚壁菌門、變形菌門、擬桿菌門、放線菌門和疣微菌門組成。研究表明,異育銀鯽(Carassiusauratusgibelio)和斑馬魚(Daniorerio)腸道都有核心菌群[13,14],本研究發現除蟹塘散養組黃鱔腸道的優勢菌為變形菌門,其余3種養殖模式黃鱔胃腸道優勢菌群均為厚壁菌門。推測不同養殖模式對菌群種類影響不大,只是影響各菌群所占比例;黃鱔胃腸道微生物的核心菌群可能是厚壁菌門。朱昊俊等[12]研究發現,厚壁菌門豐度的提高有利于從相同飲食中獲取更多能量。并且有研究報道指出,變形菌門豐度的增高可能是腸道菌群失衡的一個重要標志[15]。
通過分析研究結果發現蝦塘散養組、蟹塘散養組和網箱投喂魚漿組養殖模式中黃鱔胃的優勢菌種均為韋榮球菌屬。研究發現韋榮球菌產生的內毒素會引發慢性炎癥,誘導細胞因子TNF-α、IL-6、IL-1β和IL-10的釋放[16];ZHAO等[17]發現長期食用高脂肪、低纖維的食物會導致腸道菌群失調,尤其是革蘭氏陰性菌增多,從而產生過多的內毒素引發炎癥反應,并造成肥胖、糖尿病等慢性病的發生,推測蝦塘散養、蟹塘散養與網箱魚漿養殖模式存在較高的潛在患病風險,并且黃鱔由于貪食高脂肪、高蛋白餌料,養殖過程中經常暴發的腸炎病可能與韋榮球菌相關。網箱投喂水蚯蚓組養殖模式中黃鱔胃中糞桿菌屬和嗜黏蛋白阿克曼菌屬占比最多。糞桿菌在人腸道中分布廣泛,是健康的標志,并有研究表明糞桿菌屬的普拉梭菌在腸道黏膜屏障保護及炎癥抑制等方面發揮重要作用,在益生菌開發或生物治療藥物方面前景光明[18,19];嗜黏蛋白阿克曼菌也是腸道菌群中的“明星菌”,在抗衰老、抗腫瘤、機體代謝、免疫調節等方面發揮重要作用[20]。蝦塘散養組黃鱔腸道的優勢菌群為瘤胃球菌屬,這可能與蝦塘散養組黃鱔捕食小龍蝦有一定的關系;其它三種養殖模式黃鱔腸道的優勢菌群均為雙歧桿菌,雙歧桿菌在促進腸道健康、延緩衰老、提高機體免疫、降血糖、降血脂和降膽固醇等方面發揮功效[21]。黃鱔腸道優勢菌群的差異也印證了前人的研究,魚類攝食不同類型的食物會影響腸道微生物菌群[8]。并且黃鱔胃和腸道中的優勢菌群存在差異,可能是由于其胃和腸道的組織結構、消化酶活力等不同有關,胃的蛋白酶和淀粉酶活力高,有較強的消化能力但沒有吸收細胞分布,而腸道的吸收能力則較強[10,22]。
水蚯蚓是一種優質的開口餌料,研究發現其體內含有抑菌活性物質[23],飼料中添加抗菌肽可以調節黃鱔腸道菌群結構,提高菌群多樣性[24]。并且,江為民等[25]發現用水蚯蚓搭配少量配合飼料在網箱中養殖黃鱔成活率高,品質好,經濟效益高。
4 結論
綜合比較發現,網箱投喂水蚯蚓組黃鱔消化道微生物豐度和多樣性都較高,胃腸道益生菌群占比高,潛在的致病菌少;而網箱投喂魚漿的養殖模式雖然黃鱔生長較快,但是魚漿對水質污染嚴重易導致疾病大爆發,并且胃腸道潛在的致病菌較多,養殖風險高。因此,在養殖黃鱔時,推薦使用網箱養殖并適當調整養殖密度,水蚯蚓作為開口餌料或育肥餌料,養殖過程中則按照一定比例添加魚漿與配合飼料以降低成本。

