微小RNA-27a-5p對抑郁癥大鼠橈骨骨折愈合的影響
王振龍, 劉 勇, 祝 茂, 葉章勇
(1. 西南醫(yī)科大學(xué)附屬中醫(yī)醫(yī)院 骨傷科, 四川 瀘州, 646000;2. 四川省瀘州市敘永縣中醫(yī)醫(yī)院 骨傷科, 四川 瀘州, 646400)
抑郁癥可損害患者骨代謝機能, 導(dǎo)致骨組織骨量流失,并影響骨折愈合[1-2]。慢性束縛應(yīng)激可通過誘導(dǎo)炎癥造成抑郁,促炎因子白細胞介素(IL)-2在其中起關(guān)鍵作用[3-4]。微小RNA(miRNA)-27a在抑郁癥患者中表達降低[5], 其家族成員miR-27a-5p也具有顯著抑制炎癥功能[6], 且與股骨骨密度呈正相關(guān)[7], 由此推測miR-27a-5p可能通過其抗炎作用促進骨折愈合。骨折修復(fù)是由成骨細胞和免疫細胞參與調(diào)控的復(fù)雜過程。IL-2是免疫細胞分泌的促炎因子,其可通過介導(dǎo)炎癥參與骨折愈合過程。查詢Starbase數(shù)據(jù)庫可知, miR-27a-5p與IL-2之間有結(jié)合位點,預(yù)測miR-27a-5p可能通過靶向調(diào)節(jié)IL-2促進抑郁癥大鼠橈骨骨折愈合。本研究上調(diào)及下調(diào)抑郁癥橈骨骨折大鼠及大鼠骨髓間充質(zhì)干細胞(BMSC)中miR-27a-5p的表達,并對此假設(shè)進行探討。
1 材料與方法
1.1 材料
1.1.1 動物: SD大鼠,約6周齡,雄性,體質(zhì)量200~220 g, SPF級,購自斯貝福(北京)生物技術(shù)有限公司,生產(chǎn)許可證號: SCXK(京)2019-0010。大鼠飼養(yǎng)在約25 ℃、12 h明暗循環(huán)照明的動物房中,相對濕度約為55%, 大鼠自由取食飲水。
1.1.2 試劑與材料: miR-27a-5p mimics、miR-27a-5p mimics陰性對照、miR-27a-5p inhibitor、miR-27a-5p inhibitor陰性對照、miR-27a-5p agomir陰性對照、miR-27a-5p agomir、miR-27a-5p antagomir陰性對照、miR-27a-5p antagomir、野生型IL-2 3′-UTR報告質(zhì)粒、突變型IL-2 3′-UTR報告質(zhì)粒、miR-27a-5p及IL-2、U6、β-actin引物、大鼠骨保護素(OPG)酶聯(lián)免疫吸附測定(ELISA)試劑盒(貨號D731022-0096)、大鼠核因子κ B受體活化因子配體(RANKL)ELISA試劑盒(貨號D731112-0096)均購自上海生工生物工程股份有限公司; 大鼠骨髓間充質(zhì)干細胞(BMSC, 貨號CP-R131)、大鼠BMSC完全培養(yǎng)基(CM-R131)、大鼠BMSC成骨誘導(dǎo)分化培養(yǎng)基(PD-008)均購自武漢普諾賽生命科技有限公司; 脂質(zhì)體2000(貨號L7800)、大鼠IL-2 ELISA試劑盒(貨號SEKR-0003)、總RNA提取試劑盒(貨號R1200)、大鼠IL-6 ELISA試劑盒(貨號SEKR-0005)、一步法實時熒光定量聚合酶鏈反應(yīng)(qRT-PCR)試劑盒(貨號T2210)、偶氮偶聯(lián)法堿性磷酸酶染色液(貨號G1480)、雙熒光素酶報告基因檢測試劑盒(貨號D0010)均購自北京索萊寶科技有限公司等。
1.1.3 儀器: 強迫游泳系統(tǒng)(型號LE803/4)購自上海然哲儀器設(shè)備有限公司; microCTμ100掃描儀購自瑞士Scanco公司; 全自動酶標儀(型號UMR-9600T)購自杭州優(yōu)米儀器有限公司; 生物光學(xué)顯微鏡(型號LW200ET-A)購自上海尖端光電科技有限公司; 熒光定量PCR儀(型號CFX96 Touch Deep Well)購自美國Bio-Rad公司等。
1.2 方法
1.2.1 制備大鼠模型及分組給藥: 首先制備大鼠抑郁模型[8]。通過慢性溫和不可預(yù)知應(yīng)激刺激誘導(dǎo)大鼠抑郁,該應(yīng)激因素包括禁食禁水、傾斜鼠籠、晝夜顛倒、懸尾、足底電刺激(40 V, 50次)、驚嚇刺激(150 dB, 25 Hz, 10 s/次),每天從以上應(yīng)激中任選2種刺激大鼠,共持續(xù)刺激28 d即可完成造模,隨機分為骨折+抑郁組、miR-27a-5p agomir陰性對照組、miR-27a-5p agomir組、miR-27a-5p antagomir陰性對照組、miR-27a-5p antagomir組,每組12只大鼠,另選12只SD大鼠和上述抑郁模型大鼠均通過腹腔注射45 mg/kg的戊巴比妥鈉溶液麻醉后,將右前肢脫毛、備皮、消毒、切開,分離肌肉組織暴露雙側(cè)橈骨,以骨鉗折斷其中段,固定骨折處后縫合,手術(shù)盡量保證無菌環(huán)境,最終完成骨折模型制備,只進行骨折手術(shù)操作不誘導(dǎo)抑郁的12只SD大鼠作為骨折對照組。造模完成后馬上開始給藥,記為第1天,參照各自說明書指導(dǎo)將miR-27a-5p agomir、miR-27a-5p agomir陰性對照、miR-27a-5p antagomir及miR-27a-5p antagomir陰性對照溶于生理鹽水,均以100 nmol/kg的劑量分組尾靜脈注射,模型組和骨折對照組大鼠尾靜脈注射等劑量的生理鹽水,每周注射1次,共注射4次。
1.2.2 大鼠抑郁癥狀檢測: 給藥后第29天,進行強迫游泳實驗和蔗糖偏好實驗檢測各組大鼠抑郁癥狀。強迫游泳實驗: 向玻璃缸中注入19 cm深、35 ℃的干凈水,將大鼠小心放入水中,記錄5 min內(nèi)大鼠靜止不動的時間,休息20 min后再次測量,取3次檢測平均值。蔗糖偏好實驗: 對大鼠禁食禁水, 24 h后向鼠籠中放入含有10 g/L蔗糖水溶液的飲水瓶,使大鼠自由飲用, 24 h后測定蔗糖水消耗量=(蔗糖水總量-剩余蔗糖水量)/蔗糖水總量×100%, 取3次檢測平均值。
1.2.3 大鼠骨折段骨痂量和骨微結(jié)構(gòu)檢測及采集標本: 抑郁癥狀檢測后24 h, 以氣體乙醚麻醉各組大鼠,取尾靜脈血后(1 000轉(zhuǎn)/min、4 ℃, 離心半徑為12 cm)離心15 min, 將上清吸入干凈的EP管中,標記組別后置于-80 ℃?zhèn)溆? 斷頭處理各組大鼠,剝離右前臂雙側(cè)橈骨,清除干凈軟組織后測量橈骨直徑、骨痂直徑和長度,計算出其體積=2πR1(R2-R1)L,R1為橈骨半徑,R2為骨痂半徑,L為骨痂長度; 然后通過micro CT檢測脛骨骨折段骨微結(jié)構(gòu),將上述右前臂橈骨水平放在樣品架中,對骨折線上下各5 mm區(qū)域進行掃描(電壓80 kV, 電流500 μA), 分析得出骨折段骨體積分數(shù)、骨小梁厚度和骨小梁數(shù)量,可以作為正向的成骨指標; 截取骨折處上下各1 cm的骨痂組織,以20%EDTA脫鈣后,置于液氮備用。
1.2.4 大鼠血清炎性因子IL-2、IL-6及核因子κ B受體活化因子配體(RANKL)、骨保護素(OPG)水平檢測: 取出1.2.3中各組大鼠血清進行解凍,參照ELISA試劑盒說明步驟測量IL-2、IL-6及RANKL、OPG水平。
1.2.5 大鼠骨痂組織miR-27a-5p、IL-2mRNA表達檢測: 取出1.2.3中各組大鼠骨痂組織,加入提取試劑研碎,并參照總RNA提取試劑盒說明步驟提取純化總RNA, 采用一步法qRT-PCR試劑盒并參照其說明配制PCR反應(yīng)體系,混勻后置于熒光定量PCR儀中進行PCR擴增, miR-27a-5p的內(nèi)參基因選用U6,IL-2的內(nèi)參基因選用β-actin, 運用2-ΔΔCt算法計算各基因相對表達量,引物序列見表1。

表1 引物序列
1.2.6 細胞培養(yǎng)及分組處理: 大鼠BMSC細胞置于39 ℃水浴快速凍融,復(fù)蘇后(1 000轉(zhuǎn)/min、37 ℃)離心,以大鼠BMSC細胞完全培養(yǎng)基重懸細胞沉淀,混勻接種于25 cm2培養(yǎng)瓶,置于37 ℃、5%CO2恒溫細胞培養(yǎng)箱中無菌培養(yǎng),細胞長滿瓶底時進行傳代,接種于24孔板,置于37 ℃、5%CO2恒溫細胞培養(yǎng)箱中無菌培養(yǎng), 24 h后隨機分為對照組、miR-27a-5p mimics組、miR-27a-5p mimics陰性對照組、miR-27a-5p inhibitor組、miR-27a-5p inhibitor陰性對照組,使用脂質(zhì)體2000并參照試劑說明進行細胞轉(zhuǎn)染, miR-27a-5p mimics組細胞轉(zhuǎn)染miR-27a-5p mimics, miR-27a-5p mimics陰性對照組細胞轉(zhuǎn)染miR-27a-5p mimics陰性對照, miR-27a-5p inhibitor組細胞轉(zhuǎn)染miR-27a-5p inhibitor, miR-27a-5p inhibitor陰性對照組細胞轉(zhuǎn)染miR-27a-5p inhibitor陰性對照, 24 h后收集各組細胞。
1.2.7 細胞miR-27a-5p、IL-2mRNA表達及成骨分化檢測: 采用試劑盒提取1.2.6中收集的細胞總RNA后,進行qRT-PCR實驗,步驟及引物序列與1.2.5中相同。將大鼠BMSC細胞傳代后接種于24孔板,置于37 ℃、5%CO2恒溫細胞培養(yǎng)箱中無菌培養(yǎng)24 h, 按照1.2.6中步驟分組并轉(zhuǎn)染24 h后,將大鼠BMSC細胞完全培養(yǎng)基更換為大鼠BMSC成骨誘導(dǎo)分化培養(yǎng)基,誘導(dǎo)成骨分化7 d后,棄去分化培養(yǎng)基,磷酸鹽緩沖液(PBS)漂洗, 4%多聚甲醛固定細胞后,加入堿性磷酸酶染色液孵育后漂洗,采用顯微鏡觀察各組細胞染色情況并攝取圖片,計數(shù)堿性磷酸酶(ALP)陽性細胞,計算ALP陽性細胞相對比例=實驗組/對照組×100%。
1.2.8 大鼠BMSC中miR-27a-5p對IL-2的靶向調(diào)控檢測: 將大鼠BMSC細胞傳代后接種于24孔板,置于37 ℃、5%CO2恒溫細胞培養(yǎng)箱中無菌培養(yǎng)24 h, 隨機分為野生IL-2+miR-27a-5p mimics陰性對照組、野生IL-2+miR-27a-5p mimics組、突變IL-2+miR-27a-5p mimics陰性對照組、突變IL-2+miR-27a-5p mimics組,按照1.2.6中步驟以脂質(zhì)體2000對細胞分組進行轉(zhuǎn)染,以野生型IL-2 3′-UTR報告質(zhì)粒和miR-27a-5p mimics陰性對照質(zhì)粒轉(zhuǎn)染野生IL-2+miR-27a-5p mimics陰性對照組細胞,以野生型IL-2 3′-UTR報告質(zhì)粒和miR-27a-5p mimics質(zhì)粒轉(zhuǎn)染野生IL-2+miR-27a-5p mimics組細胞,以突變型IL-2 3′-UTR報告質(zhì)粒和miR-27a-5p mimics陰性對照質(zhì)粒轉(zhuǎn)染突變IL-2+miR-27a-5p mimics陰性對照組細胞,以突變型IL-2 3′-UTR報告質(zhì)粒和miR-27a-5p mimics質(zhì)粒轉(zhuǎn)染突變IL-2+miR-27a-5p mimics組細胞,轉(zhuǎn)染24 h后采用雙熒光素酶報告基因檢測試劑盒檢測各組細胞雙熒光素酶相對活性。
1.3 統(tǒng)計學(xué)分析
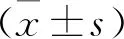
2 結(jié) 果
2.1 miR-27a-5p對各組大鼠抑郁癥狀的影響
與骨折對照組相比,骨折+抑郁組大鼠強迫游泳不動時間延長,蔗糖水消耗量降低,差異有統(tǒng)計學(xué)意義(P<0.05)。與骨折+抑郁組相比, miR-27a-5p agomir組大鼠強迫游泳不動時間縮短,蔗糖水消耗量增加,差異有統(tǒng)計學(xué)意義(P<0.05), miR-27a-5p antagomir組大鼠強迫游泳不動時間延長,蔗糖水消耗量降低,差異有統(tǒng)計學(xué)意義(P<0.05); miR-27a-5p agomir陰性對照組、miR-27a-5p antagomir陰性對照組大鼠強迫游泳不動時間、蔗糖水消耗量比較,差異無統(tǒng)計學(xué)意義(P>0.05)。見表2。
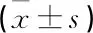
表2 各組大鼠強迫游泳實驗與蔗糖水消耗實驗結(jié)果
2.2 miR-27a-5p對各組大鼠骨折段骨痂量和骨微結(jié)構(gòu)的影響
與骨折對照組相比,骨折+抑郁組大鼠骨痂量、骨體積分數(shù)、骨小梁厚度、骨小梁數(shù)量減少,差異有統(tǒng)計學(xué)意義(P<0.05)。與骨折+抑郁組相比, miR-27a-5p agomir組大鼠骨痂量、骨體積分數(shù)、骨小梁厚度、骨小梁數(shù)量增多,差異有統(tǒng)計學(xué)意義(P<0.05); miR-27a-5p antagomir組大鼠骨痂量、骨體積分數(shù)、骨小梁厚度、骨小梁數(shù)量減少,差異有統(tǒng)計學(xué)意義(P<0.05), miR-27a-5p agomir陰性對照組和miR-27a-5p antagomir陰性對照組大鼠骨痂量、骨體積分數(shù)、骨小梁厚度、骨小梁數(shù)量比較,差異無統(tǒng)計學(xué)意義(P>0.05)。見表3。
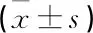
表3 各組大鼠骨痂量、骨體積分數(shù)、骨小梁厚度、骨小梁數(shù)量比較
2.3 miR-27a-5p對各組大鼠IL-2、IL-6及RANKL、OPG水平的影響
與骨折對照組相比,骨折+抑郁組大鼠血清OPG水平降低,炎性因子IL-2、IL-6及RANKL水平升高,差異有統(tǒng)計學(xué)意義(P<0.05)。與骨折+抑郁組相比, miR-27a-5p agomir組大鼠血清OPG水平升高,炎性因子IL-2、IL-6及RANKL水平降低,差異有統(tǒng)計學(xué)意義(P<0.05), miR-27a-5p antagomir組大鼠血清OPG水平降低,炎性因子IL-2、IL-6及RANKL水平升高,差異有統(tǒng)計學(xué)意義(P<0.05); miR-27a-5p agomir陰性對照組和miR-27a-5p antagomir陰性對照組大鼠血清炎性因子IL-2、IL-6及RANKL、OPG水平比較,差異無統(tǒng)計學(xué)意義(P>0.05)。見表4。
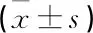
表4 各組大鼠血清炎性因子IL-2、IL-6及RANKL、OPG水平比較
2.4 各組大鼠骨痂組織miR-27a-5p、IL-2 mRNA表達的檢測結(jié)果
與骨折對照組相比,骨折+抑郁組大鼠骨痂組織miR-27a-5p表達降低,IL-2mRNA表達升高,差異有統(tǒng)計學(xué)意義(P<0.05)。與骨折+抑郁組相比, miR-27a-5p agomir組大鼠骨痂組織miR-27a-5p表達升高,IL-2mRNA表達降低,差異有統(tǒng)計學(xué)意義(P<0.05), miR-27a-5p antagomir組大鼠骨痂組織miR-27a-5p表達降低,IL-2mRNA表達升高,差異有統(tǒng)計學(xué)意義(P<0.05); miR-27a-5p agomir陰性對照組和miR-27a-5p antagomir陰性對照組大鼠骨痂組織miR-27a-5p、IL-2mRNA表達比較,差異無統(tǒng)計學(xué)意義(P>0.05)。見表5。
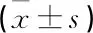
表5 各組大鼠骨痂組織miR-27a-5p、IL-2 mRNA表達水平比較
2.5 各組細胞成骨分化及miR-27a-5p、IL-2 mRNA表達的檢測結(jié)果
與對照組相比, miR-27a-5p mimics組細胞ALP陽性細胞相對比例、miR-27a-5p表達升高,IL-2mRNA表達降低,差異有統(tǒng)計學(xué)意義(P<0.05), miR-27a-5p inhibitor組細胞ALP陽性細胞相對比例、miR-27a-5p表達降低,IL-2mRNA表達升高,差異有統(tǒng)計學(xué)意義(P<0.05); miR-27a-5p mimics陰性對照組、miR-27a-5p inhibitor陰性對照組與對照組比較,差異無統(tǒng)計學(xué)意義(P>0.05)。見圖1、表6。

A: 對照組ALP染色; B: miR-27a-5p mimics陰性對照組ALP染色; C: miR-27a-5p mimics組ALP染色; D: miR-27a-5p inhibitor陰性對照組ALP染色; E: miR-27a-5p inhibitor組ALP染色。圖1 各組細胞ALP染色結(jié)果(放大400倍)
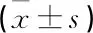
表6 各組細胞ALP陽性細胞相對比例
2.6 大鼠BMSC中miR-27a-5p對IL-2的靶向調(diào)節(jié)
查詢Starbase數(shù)據(jù)庫可知miR-27a-5p與IL-2之間有結(jié)合位點,與野生IL-2+miR-27a-5p陰性對照組比較,野生IL-2+miR-27a-5p mimics組相對熒光素酶活性降低,差異有統(tǒng)計學(xué)意義(P<0.05); 突變IL-2+miR-27a-5p陰性對照組與突變IL-2+miR-27a-5p mimics組相對熒光素酶活性比較,差異無統(tǒng)計學(xué)意義(P>0.05)。見圖2、表7。

圖2 miR-27a-5p與IL-2之間結(jié)合位點
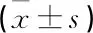
表7 檢測miR-27a-5p對IL-2的靶向調(diào)節(jié)時各組相對熒光素酶活性值
3 討 論
精神壓力和抑郁障礙會對骨生物學(xué)產(chǎn)生負面影響,增加骨折風(fēng)險,改善骨折患者抑郁癥狀可有利于其骨折愈合,因此探尋其中的作用機制對改善抑郁及骨折患者預(yù)后具有積極意義[9-10]。本研究通過慢性溫和不可預(yù)知應(yīng)激刺激SD大鼠建立抑郁模型,然后切斷前右肢橈骨中段制備骨折模型,結(jié)果顯示,相比只做了橈骨骨折處理的大鼠,抑郁后橈骨骨折的大鼠強迫游泳不動時間延長及血清IL-2、IL-6及RANKL水平、骨痂組織IL-2mRNA表達升高,蔗糖水消耗量、骨痂量、骨體積分數(shù)、骨小梁厚度、骨小梁數(shù)量減少及血清OPG表達水平降低,表明慢性溫和不可預(yù)知應(yīng)激刺激可誘發(fā)促炎因子IL-2、IL-6過量表達,引發(fā)炎癥,下調(diào)OPG表達,促進RANKL表達,減少骨折大鼠骨形成,破壞骨微結(jié)構(gòu),抑制其骨折愈合,提示抑郁對骨折愈合起到負面影響,抑郁后骨折大鼠模型構(gòu)建成功。
IL-2、IL-6、IL-8、腫瘤壞死因子-α(TNF-α)等促炎因子引發(fā)的炎癥是抑郁癥的重要致病因素[11], 炎癥可介導(dǎo)成骨分化及骨形成,抑制炎癥可緩解抑郁癥狀,促進骨折愈合[4, 12], OPG、RANKL可作為骨炎癥的預(yù)測標志物,抑制炎癥,增加OPG/RANK比率,可逆轉(zhuǎn)重度抑郁障礙患者的骨密度降低[13]。miR-27a-5p作為一種微小RNA, 可介導(dǎo)炎性級聯(lián)反應(yīng),過表達miR-27a-5p可減輕急性胰腺炎引發(fā)的細胞炎癥損傷[14], 還可刺激成骨細胞的成骨分化,增加去卵巢骨量,促使骨形成,減輕患者骨質(zhì)疏松癥狀[15]。本研究以miR-27a-5p agomir上調(diào)抑郁后骨折模型大鼠的miR-27a-5p表達,可增加其蔗糖水消耗量、骨痂量、骨體積分數(shù)、骨小梁厚度、骨小梁數(shù)量和增高血清OPG水平,縮短大鼠強迫游泳不動時間,降低血清IL-2、IL-6及RANKL水平; 而以miR-27a-5p antagomir下調(diào)抑郁后骨折模型大鼠的miR-27a-5p表達,則起到相反作用,表明miR-27a-5p可調(diào)控抑郁大鼠體內(nèi)炎癥,進而參與介導(dǎo)其骨折愈合過程,過表達miR-27a-5p可減輕炎癥,促進OPG表達同時下調(diào)RANKL表達,并促進骨折大鼠骨形成,增強骨痂生長,積極促使骨折愈合,減輕抑郁負面作用。另外以miR-27a-5p mimics上調(diào)大鼠BMSC細胞的miR-27a-5p表達,可增高其ALP陽性細胞相對比例,而miR-27a-5p inhibitor作用相反,表明miR-27a-5p可促進成骨分化,總之,上調(diào)miR-27a-5p表達可抑制炎癥,增強成骨分化,促使抑郁大鼠骨折愈合。
骨折患者會發(fā)展為創(chuàng)傷后骨關(guān)節(jié)炎, IL-2在此過程中具有關(guān)鍵調(diào)控作用, IL-2在關(guān)節(jié)內(nèi)骨折膝蓋滑膜中表達升高,可引發(fā)軟骨降解[16-17], 并可通過調(diào)控炎癥和成骨細胞分化參與介導(dǎo)骨折愈合過程。本研究通過Starbase數(shù)據(jù)庫查詢到miR-27a-5p與IL-2之間有結(jié)合位點,并以雙熒光素酶報告基因?qū)嶒炞C實miR-27a-5p可靶向下調(diào)大鼠BMSC細胞IL-2表達,以miR-27a-5p agomir上調(diào)抑郁后骨折模型大鼠的miR-27a-5p表達,可顯著下調(diào)IL-2表達,而miR-27a-5p antagomir起到相反作用; 另外以miR-27a-5p mimics上調(diào)大鼠BMSC細胞的miR-27a-5p表達,可降低其IL-2mRNA表達, miR-27a-5p inhibitor作用相反,表明靶向下調(diào)IL-2表達可能是miR-27a-5p促使抑郁大鼠骨折愈合的作用機制。
綜上所述, miR-27a-5p調(diào)控BMSC的成骨分化及炎癥反應(yīng),參與介導(dǎo)抑郁大鼠骨折愈合過程,過表達miR-27a-5p可促進大鼠BMSC成骨分化,并減輕大鼠抑郁癥狀,抑制其炎癥發(fā)生進展,促進骨折段骨痂生長,改善骨微結(jié)構(gòu),減少抑郁骨折愈合的負面作用。靶向下調(diào)IL-2表達可能是積極促使骨折愈合的作用機制之一,證實了miR-27a-5p可通過靶向下調(diào)IL-2, 進而促進抑郁癥大鼠橈骨骨折愈合。本研究有利于深入理解抑郁影響骨折愈合的分子機制,并為改進促使抑郁患者骨折愈合的方法提供了新思路。

