氮化硼晶體作為丙烷氧化脫氫的無金屬催化劑研究
周春艷
(河北金廠峪礦業有限責任公司,河北 唐山 064300)
引言
催化劑的表面狀態是多相催化中非常關注的問題,對提高催化活性和反應選擇性起著關鍵作用。目前,引入氧空位是最流行的改變表面狀態的策略之一。氧空位是一種具有不飽和配位的陰離子缺陷,往往會產生局部電子,可以在反應中提供部分能量[1-3]。在過去的幾十年中,許多報道表明氧空位可以調節催化劑的配位、電子態、電導率、表面結構和酸堿性質。在氧空位存在的情況下,吸附反應物分子的優化和進一步活化有助于提高催化性能。例如,氧空位是促進脂肪酸在可還原氧化物如TiO2、ZrO2、Fe2O3和CeO2上吸附形成醛的重要位點。氧空位促進了TiOx 的導電性并提供了強大的金屬-載體相互作用,以使金屬顆粒尺寸更小,實現更高的催化活性和負載金屬納米顆粒的更高穩定性。氧空位和表面晶格羥基構成受挫的路易斯對,可以加速羥基氧化物上的CO2光催化還原[4]。迄今為止,相當多的研究集中在氧空位在金屬氧化物上的催化作用。然而,由于非金屬氧化物的還原困難和非金屬氧化物種類的限制,對非金屬氧化物中氧空位的研究仍然很少。因此,氧空位如何影響非金屬氧化物上的催化反應值得研究者繼續關注。
一些過渡金屬(例如,Bi、Mo)也被用作添加劑,以改變氧化釩-氧化鋁基催化劑的酸堿性質并提高ODHP 的活性[5]。然而,無論使用何種添加劑,都不能同時提高丙烯的選擇性和丙烷的轉化率,改善它們的關鍵在于丙烯的快速解吸和更高的丙烷吸附能力。考慮到氧空位在調節酸堿性質中的作用,期望一種合理的策略來構建具有氧空位的ODHP 活性催化劑[6]。本文通過高溫還原方法在由具有三明治狀結構的少層BN 覆蓋的BPO4空心球表面產生氧空位。通過NH3-TPD 和BET 評估其密度。由于氧空位和BN 之間的協同作用,氮化硼晶體對丙烯的活性和選擇性均有所提高。氧空位增加了丙烷的吸附量,密閉空間減弱了丙烯的吸附。此外,反應動力學模型在富含氧空位的受限空間中經歷了從Eley-Rideal 機制到Langmuir-Hinshelwood 機制的轉變。這項研究增強了對氧空位對非金屬氧化物的作用的理解。
1 實驗部分
1.1 樣品制備
將氧化硼(B2O3)和磷酸氫二銨[(NH4)2HPO4]以摩爾比2∶1 混合,并在研缽中研磨。將混合物在環境大氣壓下于800 ℃加熱2 h。冷卻至室溫后,用稀鹽酸和超純水研磨洗滌得到產物。將所獲得的BPO4球放入管式爐中,并在NH3氣氛下在900 ℃下退火0.5 h。通過延長退火時間來調整BN 質量含量制備了一系列BN/BPO4樣品。退火前,系統用NH3吹掃2 h,以確保從爐中去除氧氣。
1.2 程序升溫脫附(TPD)測試
該測試在配備FID 的在線氣相色譜儀(PannatekA90)上進行。測試前,粉末樣品(20 mg)在U型石英管(內徑4 mm,外徑6 mm)中于300 ℃下在N2(20 mL/min)中預處理1 h。然后將預處理過的樣品冷卻至室溫,并用丙烷或丙烯(10 mL/min)飽和30 min。隨后,系統用N2(20 mL/min)沖洗1 h,以確保去除物理吸附的丙烷或丙烯。在從室溫到800 ℃的溫度范圍內以10 ℃/min 的升溫速率對探測氣體進行解吸。樣品的酸量在AutoChemII2920 儀器上通過NH3程序升溫脫附質譜(NH3TPD-MS)進行。
2 結果與討論
2.1 催化活性和動力學
各種樣品用于催化丙烷選擇性氧化為丙烯。BN/BPO4的丙烷轉化率為13.6%,遠高于BPO4球體(1.6%)和空白對照(0.9%)(表1)。而對于反應所用的BN/BPO4中含有相同BN 質量(2.75 mg)的商業BN,BN/BPO4比商業BN 具有更好的丙烷轉化率,具有幾乎相同的選擇性。如表1 所示,BN 顯然是ODHP 的催化活性來源。當增加商業BN 質量(5 mg)以獲得與BN/BPO4相似的轉化率時,丙烯選擇性從75.3%下降到73.0%。總體而言,相同BN 含量的BN/BPO4優于商業BN,體現在相同丙烷轉化率下丙烯選擇性更高。為了更深入地了解BN 質量含量對催化活性的影響,通過改變退火時間制備了不同BN 質量含量(1、3、5 h)的BN/BPO4樣品。結果表明,隨著退火時間的增加,樣品的微觀形貌沒有明顯變化。BN 厚度的增加提高了BN/BPO4樣品的BN 質量含量。此外,丙烷轉化率隨著BN 質量含量的增加迅速上升然后保持穩定甚至下降(圖1-1)。轉化率的增長可歸因于BN 含量的增加,而生長受阻甚至下降趨勢是由BPO4和BN 之間的界面面積減少引起的。相比之下,具有與BN/BPO4相似質量水平的商業BN 的活性隨著BN 質量的增加而不斷增長。此外,通過繪制丙烯選擇性與丙烷轉化率的關系(圖1-2),BN/BPO4樣品在與商業BN 相似的轉化率水平下顯示出更高的丙烯選擇性。

表1 各種催化劑對丙烷氧化脫氫制丙烯的催化性能

圖1 反應動力學
BN/BPO4和商業BN 的表觀活化能在低于10%的丙烷轉化率下測量BN/BPO4的表觀活化能(186 kJ/mol)低于商業BN(239 kJ/mol)(圖1-3)。活化能的明顯降低揭示了反應機理的變化和氧空位的關鍵作用。根據Hermans 的報告,Eley-R 理想機理適用于BN 催化劑的ODHP,并且隨著O2分壓的增加,有達到C3H8消耗速率極限的平穩趨勢。然而,反應速率在這項工作中達到峰值然后下降(圖1-4),這是Langmuir-Hinshelwood(LH)過程的典型特征。LH 模型的C3H8速率方程可描述為式(1):
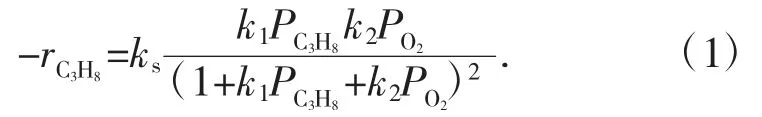
式中:rC3H8代表C3H8的消耗率;ks是速率常數;k1和k2分別是C3H8和O2的平衡吸附常數。考慮到常數(速率表達式可簡化為:PC3H8=0.2 atm),速率表達式可簡化為式(2):
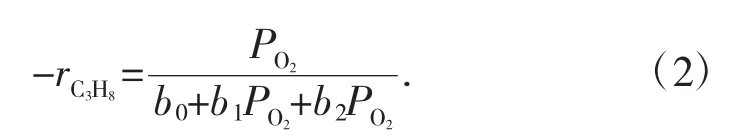
實驗數據與式(2)很好地擬合,如圖1-4 所示。因此,該反應遵循BN/BPO4催化劑上的Langmuir-Hinshelwood 機理。由于丙烷轉化率最高,研究了BN/BPO4與質量分數8.5%BN 的長期穩定性。它在低O2濃度下表現出穩定的催化性能,揭示了在此條件下氧空位的相對穩定性。丙烯的選擇性隨著反應開始時氧氣濃度的降低而下降,這是由于丙烷在催化劑表面的催化裂化引起的,進一步證實了Eley-Rideal 機理向Langmuir-Hinshelwood 的轉變。
2.2 反應機理
基于上述結果和討論,第23 頁圖2 給出了BN/BPO4上ODHP 制丙烯的示意圖。丙烷分子通過孔隙進入密閉空間后與BPO4表面的氧空位結合,氧分子被吸附在BN 表面。由于BPO4和BN 表面的限制,分子氧和丙烷的反應可以看作是在同一個準平面上。然后,活性氧分子與吸附的丙烷分子而不是離解的丙烷反應,因此反應動力學模型經歷了從純BN 表面的Eley-Rideal 機制到BN/BPO4的Langmuir--Hinshelwood 機制的轉變。由于受限空間效應導致吸附減弱,生成的丙烯分子迅速逸出。因此,在BN/BPO4上,ODHP 的氧空位和受限空間之間存在協同效應。
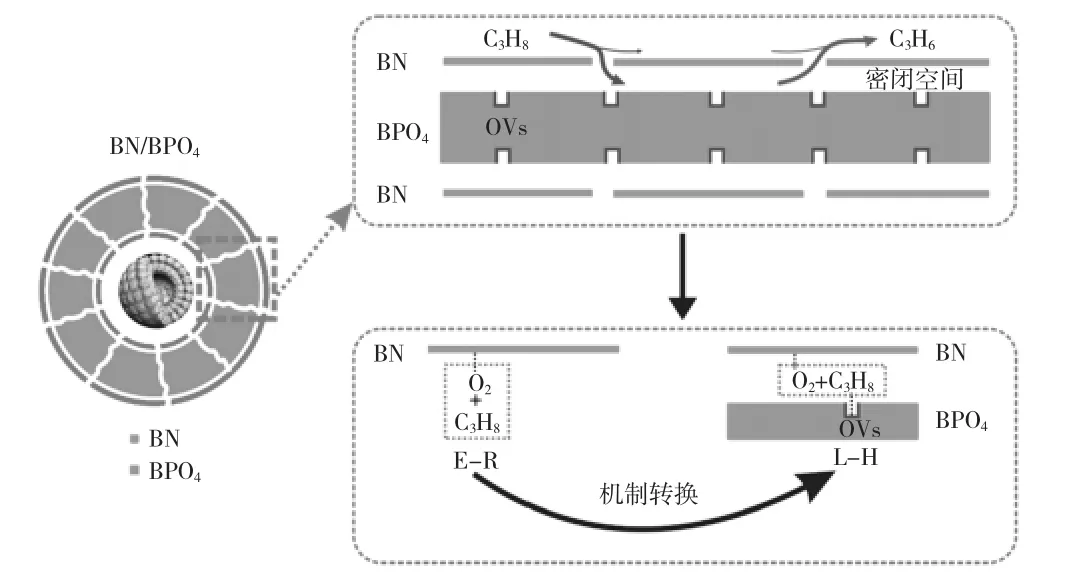
圖2 反應機理示意圖E-R:Eley-Rideal 機制,L-H:Langmuir--Hinshelwood 機制
3 結論
本文通過合理的催化劑設計對非金屬氧化物中的氧空位進行了詳細研究。在BN 覆蓋下的BPO4表面上構建了氧空位,具有三明治狀空心球結構。所獲得的催化劑BN/BPO4在ODHP 中的活性和選擇性優于商業BN 催化劑。氧空位和受限空間導致ODHP 的反應動力學模型從Eley-Rideal 機制(僅適用于BN)轉變為Langmuir-Hinshelwood 機制。實驗結果表明,富含氧空位的BPO4增加了丙烷的吸附量,密閉空間使丙烯更容易解吸,有利于活性位點的循環利用。因此,氧空位和密閉空間的協同作用提高了ODHP。該工作拓寬了具有氧空位的非金屬氧化物在多相催化領域的應用。

