外周血循環腫瘤細胞、EB病毒DNA水平對鼻咽癌患者預后預測價值
黃偉義, 梁錦輝, 劉家豪, 鄧 濱, 董良哲, 程宇文, 羅泳林, 顏建業, 寧錦燕, 陳 永
梧州市紅十字會醫院 腫瘤科,廣西 梧州 543200
鼻咽癌是頭頸部常見的惡性腫瘤之一,早期不易被發現,80%的患者就診時已為中晚期。放射治療是鼻咽癌的主要治療方法[1],調強放療后患者5年總存活率可達80%以上,但仍有約30%的患者治療失敗,主要原因為局部區域復發和遠處轉移[2]。測定患者鼻咽癌組織或血清、血漿中分子標志物,預測治療后復發、轉移危險度,精準識別高危患者,有利于早期對患者進行個體化治療,從而降低復發率和轉移率,改善患者預后[3-4]。目前,多數鼻咽癌相關轉移標志物存在敏感性差、特異性差的問題,進一步尋找具有較高敏感性、特異性的標志物尤為重要[5]。外周血循環腫瘤細胞(circulating tumorcells,CTCs)、EB病毒DNA(EB virus DNA,EBV-DNA)水平與鼻咽癌復發、遠處轉移密切相關,監測CTCs可早于常規影像學檢查手段預估腫瘤復發風險[6]。本研究旨在探討外周血CTCs、EBV-DNA水平對鼻咽癌患者預后的預測價值。現報道如下。
1 對象與方法
1.1 研究對象 選取自2018年3月至2019年3月梧州市紅十字會醫院收治的100例鼻咽癌患者為研究對象。納入標準[7]:(1)經病理組織學確診為鼻咽癌;(2)入組前未接受過手術或局部放化療治療;(3)預計生存期>6個月。排除標準:(1)合并其他惡性腫瘤;(2)合并心、肝、腎等臟器功能衰竭;(3)不愿配合本研究。其中,男性54例,女性46例;年齡32~75歲,平均(48.8±4.6)歲;病理類型:低分化型37例,中分化型48例,高分化型15例;T分期:T1期22例,T2期34例,T3期24例,T4期20例;臨床分期:ⅢB期58例,Ⅳ期42例。本研究經醫院倫理委員會批準。所有患者均簽署知情同意書。
1.2 研究方法
1.2.1 治療方法 Ⅰ~Ⅱ期患者接受根治性放療;Ⅲ~Ⅳ期患者接受 2~3個周期的誘導化療(PF/TPF/GP方案),然后行根治性同步放化療,鼻咽部劑量為68~70 Gy/33 F,頸部陽性淋巴結劑量為66~70 Gy/33 F,預防照射劑量為54 Gy/33 F。
1.2.2 CTCs檢測方法 采集患者清晨空腹靜脈血5 ml,EDTA抗凝。微孔濾膜過濾法分離外周血CTCs,采用專用的細胞染色液進行染色,CTCBIOPSY?檢測系統購自武漢友芝友醫療科技有限公司。原位雜交技術檢測EB病毒編碼的RNAs(EBERs),確定受檢外周血中鼻咽癌CTCs及其數量,EBERs原位雜交試劑盒購自北京中杉金橋生物技術有限公司。將貼有濾膜的載玻片依次放入100%乙醇、95%乙醇、75%乙醇中脫色;0.4%胃蛋白酶消化10 min;EBERs探針雜交過夜;信號檢測采用過氧化物酶結合抗地高辛抗體和3,30-二氨基聯苯胺;蘇木精復染。陽性信號呈棕黃色,局限于細胞核內。
1.2.3 CTCs判斷標準 在光學顯微鏡下觀察CTCs形態學特征。(1)細胞體積較大,呈圓形、橢圓形或梭形,長徑>10 μm。(2)細胞核異型性,呈折疊、扭曲、結節或分葉狀等;核深染且著色不均勻,核膜增厚,出現凹陷或褶皺;核偏位,或巨大核仁。(3)多數核質比>0.8。同一個標本中符合上述標準的細胞≥2個為CTCs陽性[8]。
1.2.4 EBV-DNA測定 在10%胎牛血清中培養CNE1鼻咽癌細胞系,分別加入100 U/ml鏈霉素和100 U/ml青霉素,以含EBV B95-8細菌株構建BAC質粒,設計EBER1同源重組正向引物,按照Trizol法提取鼻咽癌細胞EBV-RNA并進行逆轉錄,根據CFX-96 PCR系統設計反應引物,采用熒光定量PCR測定EBV-DNA。
1.3 觀察指標 隨訪12.5~33.4個月,中位隨訪時間為25.6個月。記錄患者無進展生存期(progression free survival,PFS)、總生存期(overall survival,OS)。
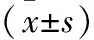
2 結果
2.1 患者局部復發和(或)轉移發生情況 將CTCs和(或)EBV-DNA陽性的患者納入陽性組(n=81),將CTCs和EBV-DNA陰性的患者納入陰性組(n=19)。陰性組治療前、治療后1個月、治療后3個月的局部復發和(或)轉移發生率均低于陽性組,差異均有統計學意義(P<0.05)。見表1。

表1 患者局部復發和(或)轉移發生情況/例(百分率/%)
2.2 CTCs陰性與陽性患者PFS、OS比較 CTCs陽性患者PFS、OS分別為(4.22±0.98)個月、(7.14±1.02)個月,均短于CTCs陰性患者的(7.14±1.02)個月、(18.36±2.47)個月,差異均有統計學意義(P<0.05)。
3 討論
鼻咽癌發生與遺傳有關,同時受環境、病毒等因素的影響,最后于鼻咽位置形成腫瘤[9]。臨床多選擇手術、化療等方式對其進行治療[10]。有研究報道,80%的鼻咽癌患者可通過對癥治療達到控制病情的目的,同時延長生存時間[11]。在此期間,臨床可通過監測病理參數分析患者病情,如CTCs、EBV-DNA等[12]。與腫瘤組織樣本比較,血液樣本更易獲取、創傷性小、可反復采集,是臨床常規檢測較為理想的標本來源[13]。有研究報道,CTCs檢測有助于腫瘤復發轉移監控,判斷患者預后,可指導術后輔助治療等[14]。CTCs常以多種形態分布在機體的外周血內,即可呈單個游離狀態,也可聚集成團,同時可隨著血液進入淋巴系統,轉移腫瘤細胞[15]。
本研究中,CTCs和EBV-DNA陰性患者治療前、治療后1個月、治療后3個月的局部復發和(或)轉移發生率均低于CTCs和(或)EBV-DNA陽性患者。CTCs變化可以反映腫瘤的增殖活性及對治療的敏感性,CTCs持續增多提示腫瘤復發或轉移[16]。EBV-DNA作為診斷鼻咽癌的重要方式,能夠觀察到EB病毒的DNA情況,若結果顯示陽性,提示患者機體中存在EB病毒感染,需及時采取對應的抗病毒藥物進行治療[17]。有研究報道,EBV-DNA作為非洲淋巴細胞瘤病毒,其水平一旦>500份/mm,提示患者預后極差[18]。此外,治療后腫瘤轉移或復發患者的治療前血漿EBV-DNA拷貝數較未出現臨床進展患者高,治療前血漿EBV-DNA水平可以作為鼻咽癌患者預后的獨立預測因素,血漿EBV-DNA水平每升高10倍,腫瘤遠處轉移和局部復發的危險度就會增加[19-21]。
本研究結果顯示,陰性組治療前、治療后1個月、治療后3個月的局部復發和(或)轉移發生率均低于陽性組,提示CTCs和(或)EBV-DNA陽性為腫瘤遠處轉移和局部復發的危險因素,可以作為鼻咽癌患者預后的獨立預測因素。本研究從鼻咽癌患者化療結束后隨訪至2020年6月,隨訪結束時,化療前CTCs陽性患者PFS、OS短于CTCs陰性患者(P<0.05),提示CTCs為腫瘤遠處轉移和局部復發的危險因素,可以作為鼻咽癌患者預后的獨立預測因素。
綜上所述,CTCs、EBV-DNA陽性鼻咽癌患者的局部復發和(或)轉移發生率升高,CTCs、EBV-DNA陽性提示預后不良。

