基于磁共振ADC圖像的深度學習和ADC值評估慢性乙型肝炎肝纖維化程度價值比較
朱桂娟,張鑫,葉曉航,李鋒
淮安市第四人民醫院 影像科,江蘇 淮安 223000
引言
肝纖維化是慢性肝炎發展過程中最常見的病理變化,是肝硬化最終發展的基礎和必要階段。研究表明,肝纖維化的病理損害過程是可逆的[1-2],因此,肝纖維化的早期診斷和早期干預尤為重要。肝活檢病理是診斷肝纖維化的“金標準”[3],但肝活檢是一種侵入性手術,存在一定的臨床并發癥和醫療風險,也影響了患者的接受度。目前診斷肝纖維化的影像學方法主要有超聲、CT和MRI。MRI在診斷和評估肝纖維化方面具有獨特的潛力和優勢。彌散加權成像(Diffusion Weighted Imaging,DWI)可用于檢測活組織中水分子的布朗運動[4-5],這使得它可以安全無創地診斷肝纖維化。
2006年,Hinton等[6]提出了深度學習的概念,它起源于人工神經網絡的研究。Chen等[7]提出了一種新的卷積神經網絡(Convolutional Neural Network,CNN)架構,稱為密集資源-感應網絡,以改進卷積層進行學習醫學圖像的特征。Gu等[8]提出了一種基于注意力的綜合CNN,可以同時感知最重要的空間位置、通道和尺度,從而實現更準確和可解釋的醫學圖像分割。因此,基于深度學習的計算機輔助診斷系統已經開發醫學成像(非自然圖像)領域,目前,人工智能技術評估肝纖維化是肝纖維化研究方向的熱點,但將人工智能應用于 MRI表觀彌散系數(Apparent Diffusion Coefficient,ADC)圖像診斷肝纖維化的研究相對較少。基于此,本文擬采用基于深度卷積神經網絡(Deep Convolutional Neural Network,DCNN)的肝纖維化自動檢測方法對123例經病理確診的肝纖維化患者的ADC圖像進行分析,旨在評估ADC圖像特征與肝纖維化程度的關系。
1 資料與方法
1.1 一般資料
回顧性分析123例慢性乙型肝炎患者的磁共振ADC圖像,123例患者肝纖維化分級經肝穿刺病理證實。由具有20多年從業經驗的病理學主任醫師閱讀所有標本,肝硬化患者的分級采用國際METAVIR方法[9],確定了5組肝纖維化階段(F0~F4),其中F0表示無肝纖維化,F1表示輕度肝纖維化,F2表示明顯肝纖維化或肝纖維化,F3表示晚期肝纖維化,F4表示肝硬化。F0期12例,男6例、女6例,年齡24~56歲,平均(41.00±11.68)歲;F1期26例,男13例、女13例,年齡22-64歲,平均(42.00±10.91)歲;F2期20例,男12例、女8例,年齡24~71歲,平均(44.20±11.40)歲;F3期26例,男17例、女9例,年齡30~70歲,平均(45.42±10.18)歲;F4期39例,男20例、女19例,年齡21~72歲,平均(50.08±10.97)歲。本文使用二元分類的方法,其中F0、F1納為一組為陰性,F2、F3、F4納為一組為陽性。本研究已獲得淮安市第四人民醫院倫理委員會批準(批號 :2020011)。
1.2 方法
1.2.1 肝穿刺組織學檢查
穿刺的位置和深度由彩色多普勒超聲確定(肝右葉,遠離大血管)。首先常規皮膚消毒,局部麻醉,囑患者屏氣后,用16G肝穿刺針(Rraun,德國)負壓抽吸肝組織(樣本長15~25 mm);然后用4%甲醛固定,石蠟包埋,連續切片,HE和Masson染色;最后在多視場光學顯微鏡(奧林巴斯CX31,日本)下觀察。
1.2.2 MRI檢查
所有受試者均進行了上腹部MRI掃描和DWI檢查,檢查前禁食6 h以上并進行呼吸訓練。MRI檢查設備選用GE MR3551.5T超導MRI系統。患者取足先進、仰臥位、八通道相控陣體線圈,先行常規MRI掃描,掃描范圍為膈肌頂部至肝下緣。DWI采用單次平面回波成像序列,掃描參數為:TE 61.8 ms,TR 9230.8 ms,矩陣256×256,切片厚度6.0 mm,間隔1.5 mm,信號激勵數2次,b值為800 s/mm2。
1.2.3 磁共振的ADC值測量
在ADC圖像中不同層面上隨機繪制3個感興趣區域(Region of Interest,ROI)。ROI的大小約為 100 mm2。ROI的選擇應避開肺門和第二肺門的大血管。測量由2名副主任醫師同時進行,結果協商一致,最后測得3個ADC值,并計算平均值。
1.2.4 DCNN結構方法
本文主要提出了一種5層DCNN結構,用于慢性乙型肝炎肝纖維化的自動分類。神經網絡自提出以來,一直被研究人員不斷的優化和深化[10-13]。本文提出的5層DCNN結構由輸入層、3個卷積層、3個池化層、2個全連接層和輸出層組成,見圖1。
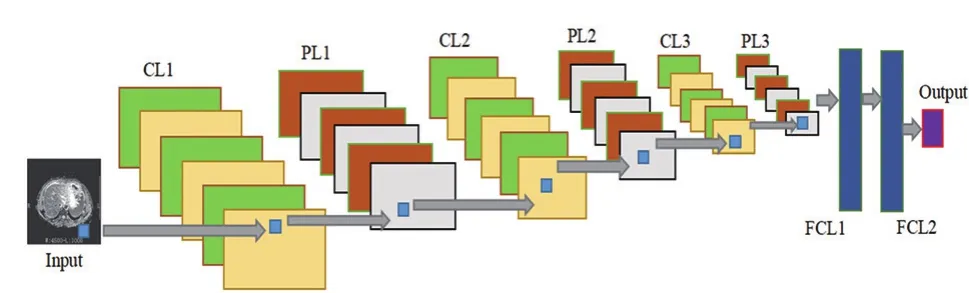
圖1 5層DCNN流程圖
(1)卷積:卷積層是DCNN的重要組成部分之一。在 DCNN中,卷積層為3D輸入和3D濾波器實現了2D卷積,因為輸入和濾波器的通道是相同的[14]。在DCNN中,卷積層的工作原理是過濾器掃描輸入進行卷積運算,提取特征[15]。由于卷積具有“權重共享”的特性,可以降低計算成本,防止參數過多導致的過擬合。
如圖2所示,輸入矩陣大小為4×4,濾波器矩陣大小為3×3,輸出矩陣大小為2×2。假設輸入大小為Wk×Hk×Dk過濾器的數量一般是不確定的。研究人員通常根據經驗確定過濾器的數量。輸出計算如公式(1)~(3)所示。卷積層的流程圖如圖3所示。
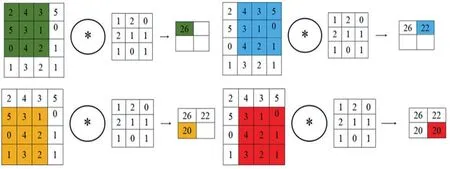
圖2 卷積操作
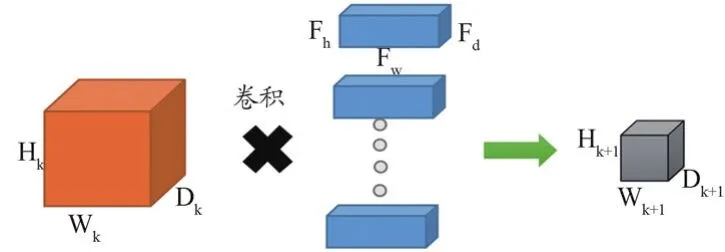
圖3 卷積層流程圖
式中,Wk代表輸入的寬度,Hk代表輸入的高度,Dk代表輸入的深度,Fw代表濾波器的寬度,Fh代表濾波器的高度,Fd代表濾波器的深度,B代表填充,Q代表步幅,M代表濾波器個數。輸出的大小為Wk+1×Hk+1×Dk+1。
(2)匯集:在深度卷積神經網絡中,通常在1層或多層卷積層之后加入池化層。池化層操作不需要特定的內核。池化層有2個優點:① 有助于獲得平移不變性;② 降低維度以減少計算量[16]。通常使用2個池化層:最大池化和平均池化。如圖4a所示,在池區域內選擇最大值的最大池化。池化層的寬度和高度將降低1/2,步幅為2。池化操作的輸出是一個2×2的矩陣,而輸入是一個4×4的矩陣。池化操作使得輸入尺寸的維度大大減小。如圖4b所示,平均池化的工作原理與最大池化類似,只是用平均值代替了最大值。
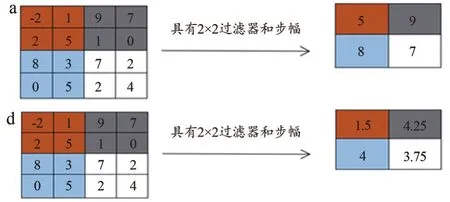
圖4 池化層
假設給定一個矩形區域Rij,其中i為行數,j為列數。最大池化計算方式如公式(4)所示,平均池化計算方式如公式(5)所示。
式中,mij表示通過矩形區域Rij最大池化的輸出值,xpq表示矩形區域Rij中(p,q)處的元素。
式中,aij表示通過矩形區域Rij平均池化的輸出值,xpq表示矩形區域Rij中(p,q)處的元素,|Rij|表示矩形區域Rij中的元素個數。
對123例患者圖片利用5層DCNN結構建立了肝纖維化自動診斷模型。卷積層、池化層、激活層和全連接層構成了DCNN的框架,見表1。每個卷積層都與一個池化層相連。每個卷積層都有不同數量的卷積核。第一個卷積層有32個卷積核,第二個卷積層有64個卷積核,第三個卷積層有96個卷積內核。每個卷積層的卷積核為3×3。3次卷積后和池化計算,參數為24576(16×16×96),第一個完全的參數連接層到第二層為24576×300,第二個全連接層的輸出是300×2。DCNN結構流程圖如圖5所示。

表1 DCNN結構流程圖

圖5 DCNN流程圖
1.2.5 統計學分析
使用SPSS 23.0進行統計學分析,計量資料以±s表示,采用t檢驗;使用Microsoft Visio 2013繪圖軟件。十折交叉驗證方法是一種通過“交叉”(將原始數據拆分為多種不同的數據組合)來“驗證”(準確度評估:損失函數、方差、偏差)模型對象的處理工具,主要是對原始數據進行分組。
2 結果
基于DCNN采集ADC圖像的準確度、敏感度、特異性、精密度、F1、馬修斯相關系數(Matthews Correlation Coefficient,MCC)和福爾克斯–馬洛斯指數(Fowlkes–Mallows Index,FMI)分別為88.13%±1.47%、81.45%±3.69%、91.12%±1.72%、80.49%±2.94%、80.90%±2.39%、72.36%±3.39%、80.94%±2.37%,見表2。MRI測得圖像ADC值的準確度、敏感度、特異性、精密度、F1、MCC和FMI分別為75.07%±13.35%、90.03%±9.24%、42.67%±35.42%、78.44%±11.42%、83.30%±8.18%、16.00%±60.46%、83.77%±7.98%,見表3。基于DCNN采集ADC圖像的準確度、特異性、MCC均顯著高于MRI測得ADC值結果,敏感度顯著低于MRI測得ADC值結果,DCNN采集ADC圖像的準確度、敏感度、特異性、MCC與MRI測得ADC值比較差異有統計學意義(t=3.075、-2.727、4.320、2.943,P=0.007、0.014、<0.001、0.009);基于DCNN采集ADC圖像的精密度、F1、FMI與MRI測得圖像ADC值比較差異無統計學意義(t=0.550、-0.892、-1.075,P=0.589、0.384、0.297)。
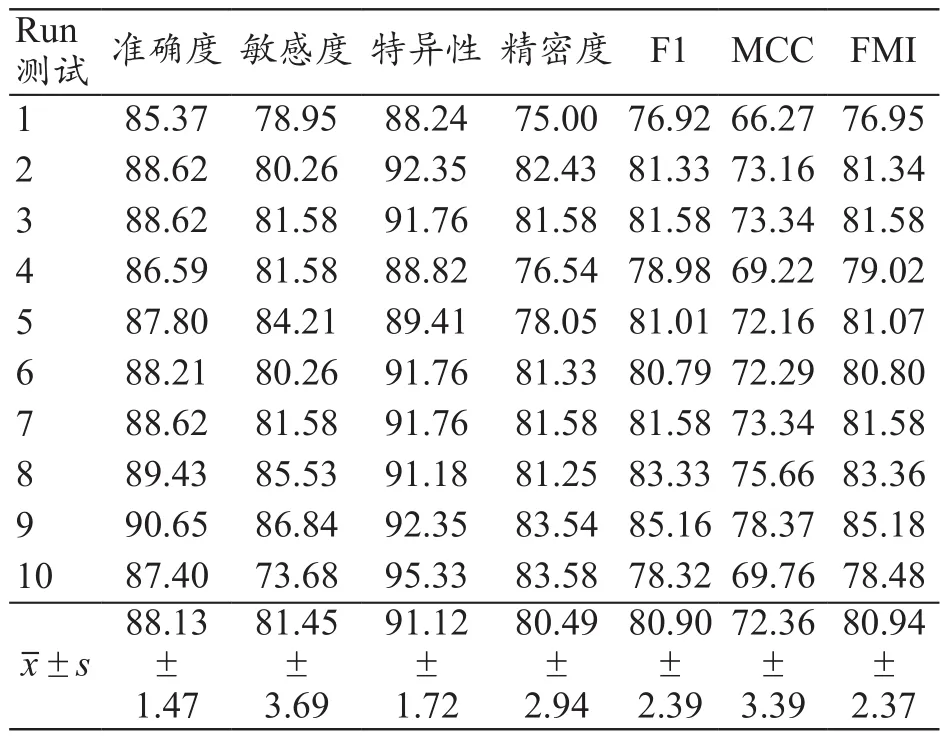
表2 基于DCNN ADC圖像自動檢測結果(%)
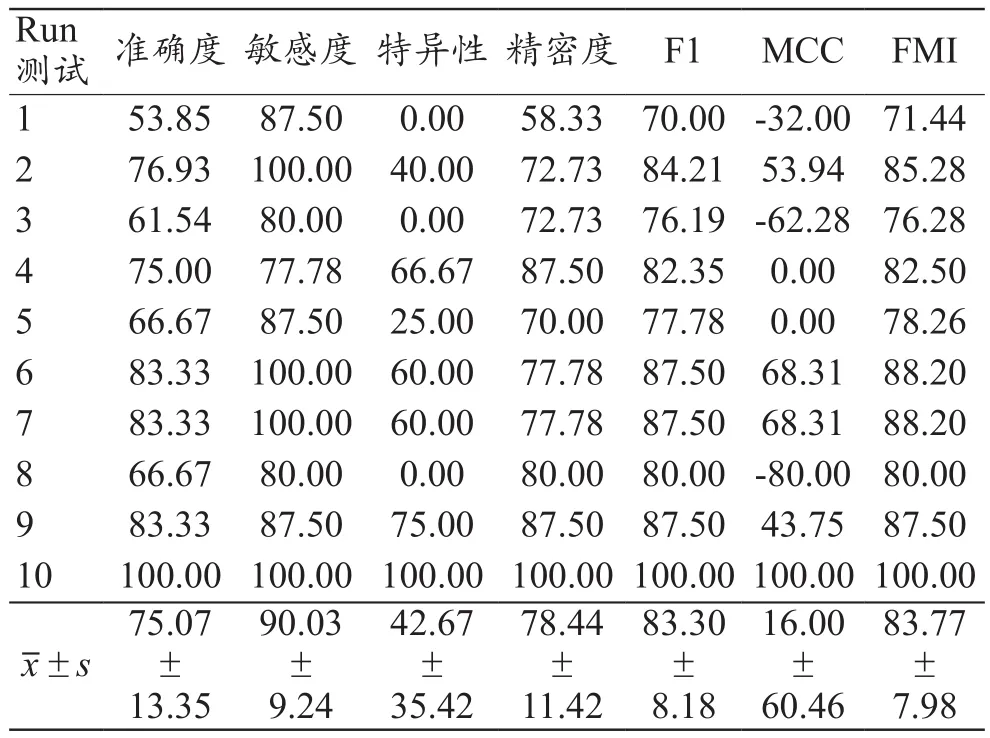
表3 MRI測得ADC值結果(%)
3 討論
肝纖維化是肝炎發展過程中常見的病理變化,隨著技術的逐漸成熟,尤其是近年來肝臟的研究和應用[17],MRI DWI可以通過水分子的微觀條件判斷人體組織的生理病理特征[18]。正常肝細胞形態和排列規則有序,實質細胞和細胞基質穩定。當慢性肝病患者發生肝纖維化時,肝臟內的纖維細胞增殖,膠原纖維沉積在肝臟的細胞間質中,水分子的活性受到限制,導致病變組織的ADC值降低[19-21]。對于較嚴重的肝纖維化病變,ADC值可以更準確地診斷,但在最初的肝纖維化病變中,ADC值的敏感度較低,可能與病變早期的肝內細胞外基質沉積及膠原纖維分布較少、對水分子運動的限制不足有關。
深度學習是人工智能領域的重要突破[22-26],在放射學領域,尤其是在腫瘤的影像診斷方面優勢明顯[27]。它在提取成像數據和圖像分析、提取圖像特征(包括形狀和空間關系特征)方面得到發展,具有提取小特征的潛力。基于MRI的深度學習模型在肝纖維化分期方面也顯示出優勢。Yasaka等[27]使用增強MRI肝膽成像構建深度學習模型,對肝纖維化分期具有較高的診斷價值。本研究提出了一種用于肝纖維化自動診斷的5層DCNN結構,其準確度高于MRI工作站測量的ADC值的準確度,說明CNN自動檢測方法在肝纖維化分期中具有較高的診斷價值。分析原因為MRI工作站測得的ADC值即是圖片上勾畫ROI內像素均值,而DCNN自動檢測是提取圖片的成像數據和圖像分析、圖像特征,所以獲得圖片信息高于ADC值。另外,MRI工作站測得的ADC值是需要在圖片上勾畫ROI,而ROI面積較小,需要在每個圖片上測量較多ADC值,并且要測量所有圖片,這顯著增加了醫師工作量及工作時間,此外,不同的醫師技能水平不同,可能會受到主觀因素的影響,誤測位置進而影響診斷,而人工智能自動檢測所有圖片,這可以大大減少醫師工作量及工作時間,通過對比得出DCNN可以更準確地得到結果,即DCNN可以作為一種輔助手段對慢性乙型肝炎肝纖維化進行診斷。
本研究存在以下不足之處:① 訓練數據集較小,隨著病例數的增加和訓練量的增加,系統的性能會達到更高的準確度;② 本研究收集的數據來自同一家醫院,可能存在數據偏倚,未來需收集來自不同中心的其他 MRI檢查,以評估此測試的效率。
4 結論
DCNN自動檢測方法在慢性乙型肝炎肝纖維化分期中具有較高的診斷價值,自動檢測方法的準確度優于MRI測量的ADC值,可以更全面、深入地分析圖像特征,減少人工診斷主觀性帶來的誤差,進一步提高肝纖維化早期診斷的準確性,有望成為一種診斷監測肝纖維化和評估患者預后的有效方法,為臨床治療提供重要依據。

