短肽AKRA(Ala-Lys-Arg-Ala)對酒精性肝損傷保護作用的研究
姚逸萍,趙德義,陳杉彬*,曹建全,張曉蒙,孫偉,趙文梅,劉建波,楊海存,郝飛克
1(中國食品發酵工業研究院有限公司,北京, 100015)2(山東景芝白酒有限公司,山東 安丘, 262119)3(酒類品質與安全國際聯合研究中心, 北京, 100015)
酒精進入人體后首先經過血液進入肝臟,通過肝臟功能代謝分解,主要對肝臟造成嚴重壓力。短期飲酒會造成嘔吐、記憶力減退、情緒不穩定等神經問題。長期過量飲酒可能會造成脂肪肝、酒精性肝炎及肝硬化等疾病。酒精中毒和酒精造成的損傷已成為普遍問題。飲酒后可能主要對體內產生氧化應激刺激,在體內產生過多的自由基。自由基過多及清除自由基時可能會發生自由基防御體系障礙,會引起過氧化反應而對機體產生傷害。自由基積累增多會引起細胞、組織的結構和功能發生改變,進而造成氧化損傷,同時還能引起機體炎癥的發生。細胞自噬是細胞內依賴溶酶體介導的長壽命蛋白質或受損細胞器降解的主要機制。自噬在真核生物中普遍存在,在胚胎發育、細胞自我保護以及生存等生理、病理過程中發揮關鍵作用[1]。細胞通過響應應激信號,如營養缺乏,會迅速啟動自噬信號通路,形成閉合的雙層膜結構,包裹細胞內錯誤折疊的/長壽命蛋白、受損細胞器或侵入的病原體,與溶酶體融合,形成自噬溶酶體進行降解并回收利用降解產物以應對不利環境[2]。炎癥是微生物病原體感染或組織損傷所激活的機體保護性反應。細胞自噬與炎癥反應密切相關,模式受體Toll樣受體的激活能夠誘導細胞自噬的發生,而細胞自噬又對炎癥反應有調控作用[3-5]。
中國白酒含有復雜的成分。其中包含多種小分子活性肽,小分子活性肽具有清除體內過量氧自由基活性氧自由基(reactive oxygen species,ROS),保護線粒體結構,減少脂質過氧化,提高機體免疫力,抗疲勞,調節免疫、抗腫瘤、促進酒精代謝等功能。霍嘉穎等[6]采用直接濃縮并結合液液萃取法從芝麻香型白酒中分離純化出一種三肽,并通過高效液相色譜-四極桿飛行時間質譜聯用儀確定其氨基酸序列為 Arg-Asn-His(RNH),含量為(18.78±0.34) μg/L。進一步研究發現,RNH通過增加細胞內抗氧化酶包括過氧化氫酶(catalase, CAT)、超氧化物歧化酶(superoxide dismutase,SOD)、谷胱甘肽過氧化物(glutathione peroxidase, GSH-PX)酶的活性來清除氧化損傷產生的ROS,同時可以抑制過氧化產物丙二醛(malondialdehyde,MDA)含量的上升,從而提高細胞抗氧化能力[7]。WU[8]等在一種芝香型白酒中檢測出短肽Ala-Lys-Arg-Ala(AKRA),并發現其在HepG2細胞中可以減少ROS的生成,增加SOD活性,并減少MDA的含量,有具有一定的抗氧化作用,但未進一步深入探討其作用機理。除RNH、AKRA外,還有2條抗氧化肽曾被報道過,其氨基酸序列分別為Pro-His-Pro(PHP)[9]和Asp-Arg-Ala-Arg(DRAR)[10]。
目前關于短肽AKRA的相關功能研究較少,僅初步通過體外實驗判斷其具有一定的抗氧化能力,但這種抗氧化能力的具體作用機理還未進行深入研究。本研究通過人正常肝細胞,對短肽AKRA的抗氧化作用,調控細胞自噬和抑制炎癥反應的具體機理進行了進一步研究,并通過酒精性肝損傷模型觀察了AKRA對酒精性肝損傷在體內的保護效應。
1 材料與方法
1.1 材料與試劑
Ala-Lys-Arg-Ala(AKRA),純度≥98%,由超純水配制為150 g/L,吉爾生化有限公司;人正常肝細胞LO2購買于國家實驗細胞資源共享服務平臺;實驗動物由斯貝福生物技術有限公司提供,為49~56日齡雄性C57BL/6 J小鼠,體重18~22 g,動物的飼養溫度為(23±2) ℃,相對濕度為(50±5) %,光照時間12 h/d,自由飲食,5 只/籠,合籠飼養,實驗動物的相關處理均嚴格遵守實驗動物福利倫理與保護相關規定,并隨時接受實驗動物倫理委員會的監督與檢查,許可證號為 (JK)2021-W-003;RPMI-1640培養基、雙抗HyClone青鏈霉素、0.25 %胰蛋白酶,美國Gibco公司;CCK-8,日本Dojindo公司;胎牛血清(fetal bovine serum,FBS)、AAPH,美國Sigma-Aldrich公司;Lysis Buffer細胞裂解液,北京康為世紀生物科技有限公司;核蛋白分步提取試劑盒BB-3104,貝博生物;CAT、GSH、SOD、MDA、總膽固醇(total cholesterol,T-cho/ TC)、血清中甘油三酯(triglyceride,TG)、高密度脂蛋白(high density lipoprotein, HDL)、低密度脂蛋白(low density lipoprotein, LDL)、谷草轉氨酶(aspartate aminotransferase,AST)和谷丙轉氨酶(alanine aminotransferase,ALT),南京建成生物技術研究所;脫脂牛奶、BCA試劑盒,北京索萊寶科技有限公司;5×蛋白質上樣緩沖液(P1040),索萊寶公司;Marker(1610374),BIO-RAD公司;一抗:核因子E-2-相關因子(nuclear factor erythroid-2-related factor 2,Nrf2) (16396-1-AP)、Kelch樣ECH關聯蛋白1(Kelch-like ECH-associated protein 1, Keap1) (10503-2-AP)、炎性因子核因子κB (nuclear factor kappa-B, NF-κB) (10745-1-AP)、一氧化氮合酶(inducible nitric oxide synthase,INOS) (18985-1-AP)、環氧化酶(cyclooxygenase,COX2) (12375-1-AP),英國Proteintech公司;LC3(PM036),P62(PM045),日本MBL公司;3-磷酸甘油醛脫氫酶(5174S) (glyceraldehyde-3-phosphate dehydrogenase,GAPDH),CST公司;二抗:Rabbit(7074S),CST公司;ECL曝光液,聚偏二氟乙烯膜(polyvinylidene fluoride,PVDF), 美國Merck millipore公司。
1.2 儀器與設備
Milli-Q超純水儀,美國Millipore公司;細胞培養箱,美國賽默飛科技有限公司;SpectraMax iD3多功能酶標儀,美國Molecular Devices公司;高速冷凍離心機,美國賽默飛科技有限公司;標準電泳裝置, 美國Bio-Rad公司;標準濕式轉膜裝置,北京百晶生物技術有限公司;ChemiScope 6200 Touch科學發光成像系統,上海勤翔科學儀器有限公司。
1.3 實驗方法
1.3.1 細胞培養
用含10%(體積分數)FBS與1%(體積分數)雙抗的RPMI-1640培養液于5% CO2、37 ℃的細胞培養箱中培養LO2細胞,該細胞屬于單層貼壁生長細胞,待細胞貼壁達到80%~90%時,使用體積分數為0.25%的胰蛋白酶消化傳代,每2~3 d進行1次傳代。
1.3.2 細胞存活率測定
取處于指數生長期的LO2細胞,加入適量0.25%胰蛋白酶消化約3 min。用含10%FBS與1%雙抗的RPMI-1640的培養液,接種于96孔板,每孔100 μL,接種細胞量為1.6×104每孔。分為空白組、正常對照組和不同劑量AKRA組(AKRA濃度為0~6.4 mg/mL),每組3個平行。置于恒溫培養箱中培養24 h后,取出培養板,每孔加入100 μL CCK8預混液[V(完全培養液)∶V(CCK8)=9∶1],置于培養箱中繼續培養2 h, 采用SpectraMax iD3酶標儀于450 nm 波長處測定每孔的吸光度值,測定完成后按照公式(1)計算細胞存活率:

(1)
式中:OD實驗組為測定孔讀數數值;OD空白孔為無添加讀數數值;OD正常對照組為只加1640培養基處理細胞讀數數值。
1.3.3 AKRA對氧化損傷細胞內MDA含量和抗氧化酶活性的影響
取處于指數生長期的LO2細胞,加入1 mL 0.25%胰蛋白酶消化約3 min。用含10%FBS與1%雙抗的RPMI-1640的培養液,接種于6孔板,每孔2 mL, 接種細胞量為2×105每孔。分為空白對照組、AAPH處理組(400 μmol/L)、低劑量AKRA組(AKRA質量濃度為1 mg/mL)、中劑量AKRA組(AKRA質量濃度為3 mg/mL)和高劑量AKRA組(AKRA質量濃度為6 mg/mL),首先用AKRA對細胞進行預處理21 h, 然后再用AKRA+AAPH同時處理3 h,經由冷PBS清洗2次后,用Lysis Buffer裂解細胞,取上清液嚴格按照BCA試劑盒說明書進行蛋白濃度的測定,同時,測定脂質氧化產物MDA、抗氧化酶(CAT、SOD)活力和GSH含量。
1.3.4 蛋白免疫印跡
在收集的蛋白樣品中加入5×蛋白上樣緩沖液, 98 ℃金屬浴加熱5 min。將蛋白樣品上樣到SDS-PAGE膠加樣孔,通過Bio-Rad的標準電泳裝置,每塊膠以電流為20 mA的電流強度進行恒流電泳。在目的蛋白泳動至距膠下緣1 cm以上時結束或在溴酚藍到達膠的底端處附近即可停止電泳,關閉電源,進行轉膜。使用標準濕式轉膜裝置,將目的蛋白轉移至PVDF膜,轉膜電壓為120 V,轉膜時間為60 min。轉膜完畢后,把PVDF膜放置到含5%(體積分數)脫脂牛奶的TBS/T溶液 (tris-HCl tween)中,室溫封閉60 min。封閉結束,用封閉緩沖液稀釋一抗,室溫下孵育2 h,使用TBS/T緩沖液,重復洗滌3次,每次5 min。用封閉緩沖液稀釋二抗,室溫下孵育40 min。使用TBS/T緩沖液,重復洗滌3次,每次5 min。利用ChemiScope 6200 Touch科學發光成像系統進行顯影。使用Image J對蛋白進行半定量分析。
1.3.5 實驗動物分組與造模
實驗小鼠適應性喂養一周后,將50只小鼠隨機分成5組,分別為空白對照、食用酒精組、低劑量AKRA組、中劑量AKRA組、高劑量AKRA組。其中食用酒精組、AKRA低劑量組、AKRA中劑量組、AKRA高劑量組分別灌胃120 μL的 52%vol食用酒精,空白組灌胃等劑量生理鹽水。其中AKRA低劑量組、AKRA中劑量組、AKRA高劑量組分別每天注射0.1 g/kg bw AKRA、0.2 g/kg bw AKRA和0.4 g/kg bw AKRA,30 d,最后一次注射后禁食不禁水,8 h后,眼球取血,頸椎脫臼處死小鼠,取肝臟組織和血液進行后續實驗,其中,將右半部肝臟組織通過10%(體積分數)中性多聚甲醛固定制備石蠟切片,肝臟組織病理學變化采用蘇木精-伊紅染色法(hematoxylin-eosin staining, HE)染色后觀察;其余肝臟組織存于-80 ℃冰箱低溫保存備用。
1.3.6 小鼠肝臟組織病理學檢查
肝臟組織用10%中性多聚甲醛固定24 h后轉入70%(體積分數)酒精溶液中脫水處理24 h,常規石蠟包埋后制作厚度約4 μm的切片,使用C8H10進行脫蠟處理,酒精梯度(95%、90%、80%、75%,體積分數)脫水;蘇木精染色;鹽酸醇分化;0.5%伊紅染色后常規梯度酒精(75%、80%、90%、95%,體積分數)脫水后經100%乙醇Ⅰ(10 min),100%酒精Ⅱ(10 min);最后經二甲苯透明后中性樹膠封片,在Nikon光學顯微鏡Eclipse Ci-L下,選取不同的視野拍照并分析肝臟組織病理學變化。
1.3.7 小鼠肝功能和血脂水平的檢測
小鼠眼球取血,靜置時間30 min,經3 000 r/min離心10 min,得到血清,并將其轉移至-80 ℃冰箱進行低溫保存。按照試劑盒使用說明書,通過賴氏法檢測血清轉氨酶AST和ALT水平。小鼠體內血清中TC水平、血清中TG水平、HDL和LDL的水平分別通過膽固醇氧化酶-過氧化物酶偶聯法(cholesterol oxidase-peroxidase,COD-PAP)、磷酸甘油氧化酶-過氧化物酶偶聯法(glycerophosphate oxidase-peroxidase,GPO-PAP)、直接檢測法進行測定。
1.4 數據分析
用Prism 9.0分析處理數據,組間檢驗采用t檢驗,所有實驗數據均為3個平行試驗的平均值,用平均值±標準誤差(standard error, SE)表示;圖表由Prism 9.0繪制。
2 結果與分析
2.1 不同濃度AKRA對細胞存活率及相關氧化指標的影響
由圖1可知,與空白組相比較,通過用不同質量濃度(0~6.4 mg/mL)的AKRA處理人肝源細胞LO2 24 h,細胞存活率無顯著性差異(P>0.05),均在80%以上,表明AKRA在此質量濃度下對LO2細胞增殖無明顯影響和毒性作用,細胞活力正常。因此后續選用0~6 mg/mL進行后續實驗。由圖2可知,與空白組相比較,AAPH處理后,LO2細胞SOD、CAT、GSH水平均呈現不同程度的降低,MDA含量升高。與模型組比較,AKRA處理細胞后,SOD(P>0.05)、CAT(P>0.05)和GSH(P>0.05)活性在6 mg/mL條件下顯著升高,而MDA活性在6 mg/mL條件下則顯著降低(P>0.05)。通過用AAPH對人源肝細胞進行氧化性損傷,多肽AKRA能夠緩解這種損傷,表明AKRA對AAPH造成的LO2細胞氧化應激損傷具有保護作用。
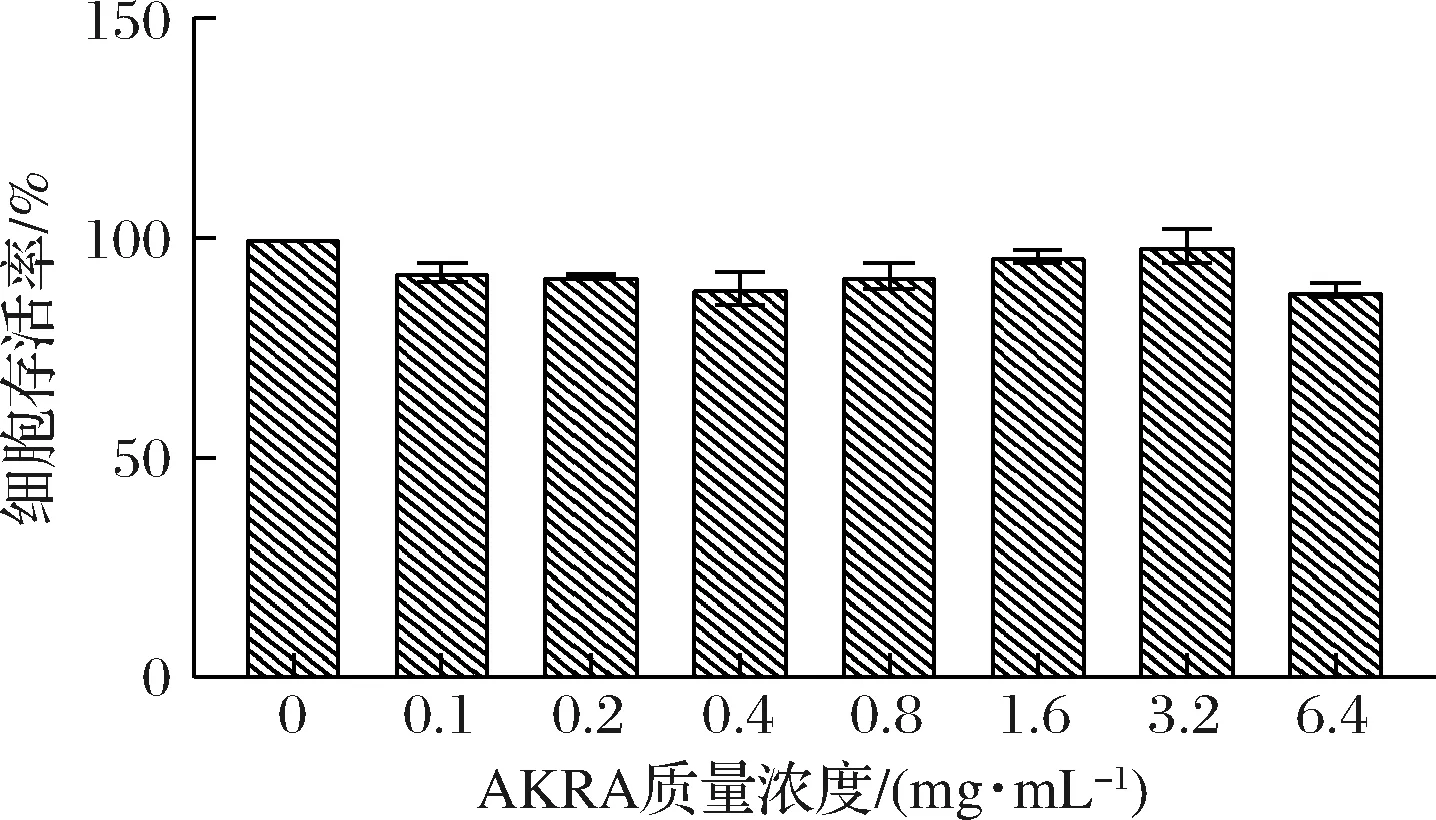
圖1 細胞存活率

a-SOD活力;b-CAT活力;c-GSH活力;d-MDA活力
2.2 不同濃度AKRA對細胞氧化通路的影響
Nrf2屬于核轉錄因子家族,主要參與調節細胞氧化應激反應[11-12]。在生理條件下,Nrf2與Keap1結合,形成蛋白復合物,定位于細胞質。當細胞面臨氧化壓力時,Nrf2與Keap1解離,進入細胞核,并激活抗氧化反應元件 (anti-oxidative response element, ARE) 的基因表達,以保護細胞免受氧化應激所引起的損傷[13-14]。如圖3所示,AKRA處理LO2細胞后,細胞核中Nrf2蛋白水平升高,Keap1蛋白降低,說明Keap1蛋白與Nrf2解離后,經蛋白酶體或自噬降解。提示AKRA是通過調控Nrf2-Keap1蛋白復合物,實現其抗氧化作用。
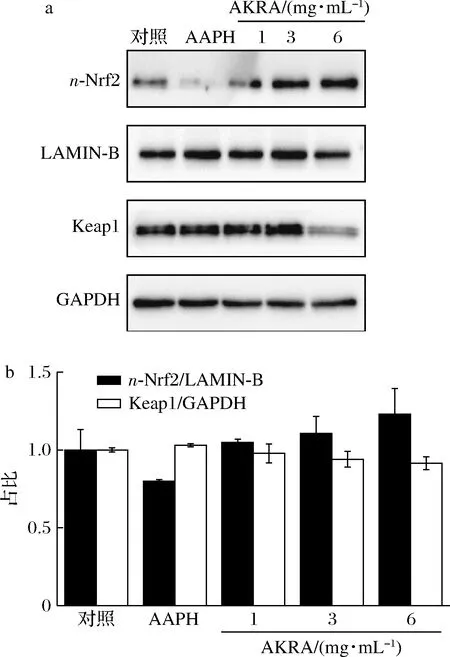
a-氧化通路關鍵蛋白表達;b-半定量分析
2.3 不同濃度AKRA對細胞自噬通路的影響
自噬是細胞為維持自身代謝發生的胞質組分降解的動態過程, LC3與P62蛋白是自噬標記蛋白[15-17]。P62蛋白可通過競爭性結合Keap1蛋白,促使其自噬性降解,以增加Nrf2的入核數量并促進其轉錄抗氧化基因[18]。因此,進一步觀察了AKRA是否通過Nrf2影響自噬活性。如圖4所示,LO2細胞經AKRA處理后,LC3蛋白隨AKRA濃度增高而增加,而P62蛋白隨AKRA濃度增高則呈現下降的趨勢。提示AKRA對細胞自噬有促進作用,這一作用可能與作用于氧化通路的關鍵蛋白Nrf2有關。
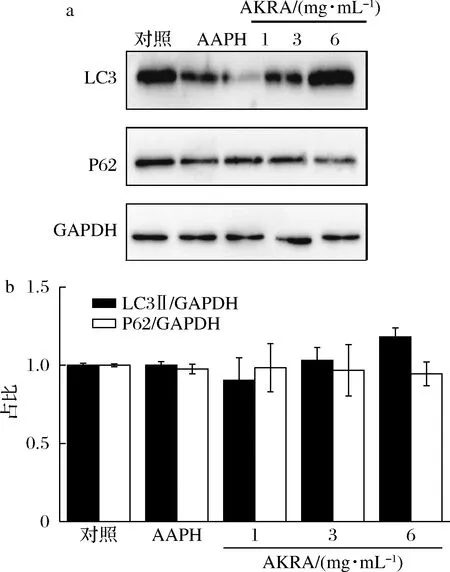
a-自噬通路關鍵蛋白表達;b-半定量分析
2.4 不同濃度AKRA對細胞炎癥通路的影響
炎癥與氧化應激相輔相成,為進一步探索AKRA在LO2細胞中的抗炎作用,觀察了NF-κB、INOS蛋白及COX2蛋白水平的變化。如圖5所示,與對照組相比,AAPH處理LO2細胞后,NF-κB、INOS及COX2等炎性因子表達增多。經過不同濃度的AKRA處理后,炎癥相關蛋白NF-κB、INOS、COX2呈現不同趨勢下降。且NF-κB隨AKRA濃度升高,下降趨勢更為顯著。該結果提示AKRA具有一定的抑制炎癥的作用。

a-炎癥通路關鍵蛋白表達;b-半定量分析
2.5 不同濃度AKRA對小鼠氧化應激的影響
進一步觀察AKRA在小鼠體內的生理作用。如圖6所示,與食用酒精組比較,不同劑量AKRA處理組小鼠肝組織SOD(P>0.05)、GSH(P>0.05)、CAT(P>0.05)活性呈濃度依賴性升高,MDA(P>0.05)含量剛呈濃度依賴性下降。上述結果提示,AKRA在體內同樣具有抗氧化作用。酒精在肝臟內的代謝過程是氧化還原過程,因此,進一步觀察AKRA是否能夠通過提高小鼠肝臟的抗氧化能力,達到在一定程度上保護酒精造成的肝損傷。
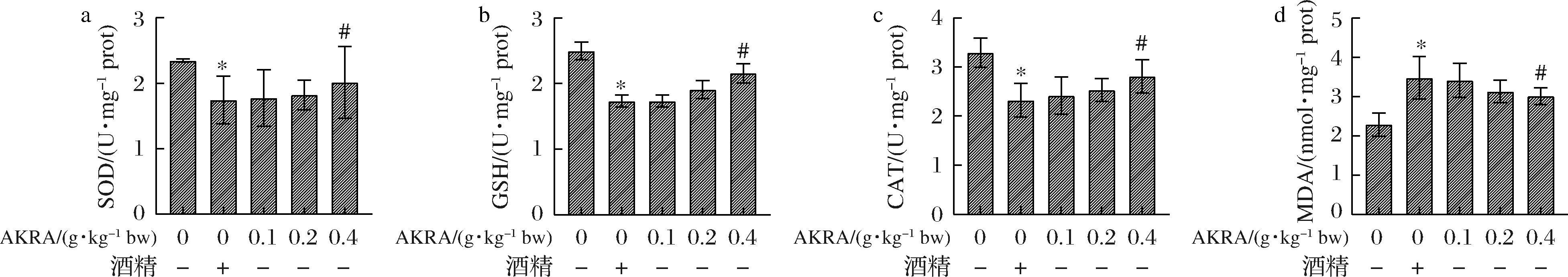
a-SOD活力;b-GSH活力;c-CAT活力;d-MDA活力
2.6 不同濃度AKRA對小鼠肝組織病理形態學的影響
如圖7所示,通過HE染色,空白對照組小鼠肝組織基本無明顯病理變化,肝組織排列緊密,肝細胞正常生長,無變性情況;食用酒精組小鼠肝組織結構、肝細胞出現排列紊亂、纖維化、脂肪滴空泡,其中炎性細胞較多(圖7-b)。低濃度AKRA組出現肝細胞排列緊密,肝細胞胞漿疏松淡染,小葉出現炎性細胞小灶性浸潤(圖7-c);中濃度AKRA組:門管區肝細胞胞漿輕度疏松淡染小葉偶見炎性細胞小灶性浸潤(圖7-d)。高濃度AKRA組出現較少的炎性細胞小灶性浸潤(圖7-e)。長期飲酒后,已經對肝細胞出現一定影響,主要包括肝細胞變性,炎性侵染等,但不同處理均有一定差別,通過施加AKRA處理后,肝細胞狀態明顯優于食用酒精,AKRA對由食用酒精造成的肝損傷起到了一定的保護作用,從而減少酒精帶來的肝損傷危害。

a-空白對照組;b-食用酒精組;c-0.1 g/kg bw AKRA;d-0.2 g/kg bw AKRA;e-0.4 g/kg bw AKRA
2.7 不同濃度AKRA對小鼠肝臟功能和血脂水平的影響
如圖8所示,與食用酒精組相比較,AKRA處理組小鼠在血清中AST、ALT水平均有一定程度降低。在AST(P<0.05)水平上,不同濃度AKRA處理組分別是食用酒精組的0.900、0.877和0.854倍,但三者之間無顯著性差異。而在ALT(P<0.05)水平上,不同濃度AKRA處理組不同程度的低于食用酒精組,分別是食用酒精的0.739、0.699和0.682倍,但三者之間無顯著性差異。在ALP(P<0.05)水平上,不同濃度AKRA處理組分別是食用酒精組的0.899、0.878 和0.849倍,但三者之間無顯著性差異。與食用酒精組相比較,AKRA不同劑量組小鼠血清中TC(P<0.05)、TG(P>0.05)、LDL(P>0.05)水平相較食用酒精組出現下降的現象(P<0.05),同時HDL(P>0.05)水平上升;表明AKRA能在一定程度上緩解食用酒精造成的肝損傷,但無法使這種損傷恢復至初始狀態。
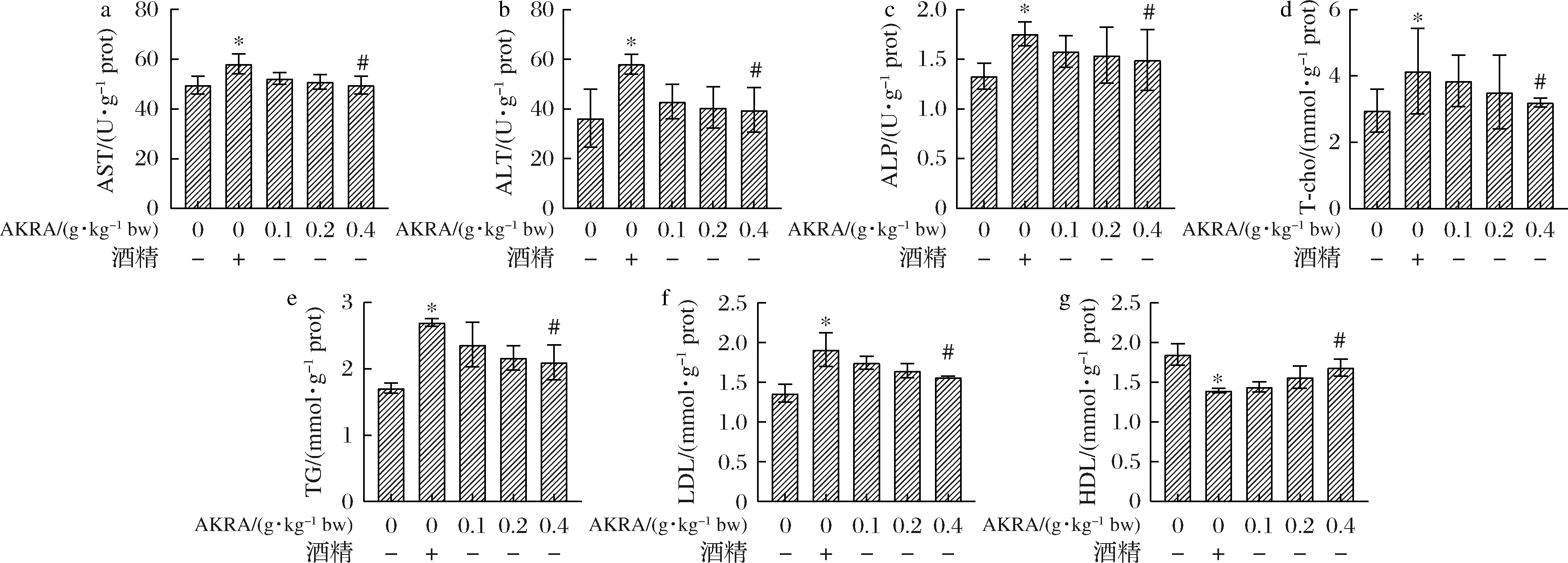
a-AST活性;b-ALT活性;c-ALP活性;d-T-cho活性;e-TG活性;f-LDL活性;g-HDL活性
3 結論與討論
為探究一品景芝酒中一種四肽AKRA (Ala-Lys-Arg-Ala)的生理功能及其緩解酒精性肝損傷的可能作用機理,本研究用不同濃度的AKRA對人源肝細胞LO2及C57小鼠進行處理,觀察在氧化應激條件下的LO2細胞及酒精性肝損傷模型小鼠的影響作用。AKRA處理細胞后,可以提高其抗氧化酶活力,不同程度減少由AAPH帶來的氧化損傷。Nrf2-Keap1是抗氧化信號通路中的一條關鍵蛋白復合物,在各種組織、器官中均能夠表達。Nrf2的缺失能夠增加小鼠急性酒精暴露導致的死亡率[19-21]。AKRA處理細胞后,可以加速Nrf2與Keap1解離,能夠促進Nrf2進入細胞核中發揮其轉錄功能。Nrf2蛋白解離的Keap1蛋白,可能與P62蛋白結合,通過自噬途徑進行降解,而Nrf2蛋白入核后,可以通過調控下游抗氧化蛋白進而提高下游抗氧化相關酶的活力[21]。本研究中使用AKRA處理細胞后發現,LC3蛋白含量升高,同時P62降解,提高了LO2細胞的自噬活性。AKRA處理LO2細胞后,炎性因子NF-κB、INOS、COX2表達均下降,提示AKRA具有一定的抑制炎癥反應的作用。
肝組織病理形態學提示,食用酒精組小鼠肝組織呈炎性改變;AKRA各濃度處理組肝細胞變性數量及情況均要優于食用酒精組小鼠。同時在對不同組小鼠肝臟健康相關指標進行比較,結果表明用AKRA處理誘導的酒精性肝損傷小鼠,能夠在一定程度上緩解的酒精性肝損傷的發生。目前研究表明酒精能夠產生氧化應激引起機體產生相應反應。乙醇代謝產物乙醛可直接與組織SOD、GSH-PX等抗氧化酶和抗氧化蛋白GSH結合而導致抗氧化酶活性下降, 造成系統抗氧化功能降低[22-24]。能夠發現AKRA處理組中的氧化相關指標CAT、GSH、SOD活力均比食用酒精組中不同程度升高,MDA水平降低,表明AKRA對小鼠的酒精性肝損傷有一定的保護作用,而這種能力是通過調控體內抗氧化通路達到的。
目前研究結果表明,體內體外實驗均能夠一定程度表明AKRA是通過調控抗氧化物酶的活力來達到緩解氧化應激損傷,保持氧化水平,這與目前針對AKRA的作用的相關研究是相符合的。本研究深入探究了AKRA的調控機理,發現其主要是通過調控抗氧化關鍵通路Nrf2-Keap1進而影響下游相關抗氧化酶的合成。同時還通過影響細胞自噬通路關鍵蛋白及炎癥通路關鍵蛋白的表達,進而改善酒精性肝損傷。但這種緩解能力是有一定限度的,可能是AKRA直接作用與抗氧化通路的某些關鍵蛋白帶來的影響。AKRA能夠通過作用于抗氧化通路關鍵蛋白、細胞自噬通路關鍵蛋白和炎癥通路關鍵蛋白,提高抗氧化酶活力,減少氧化應激損傷,同時緩解炎癥損傷,進而減緩酒精帶來的肝臟損害。

