低苦味多肽固體飲料的制備及其體外模擬消化研究
尹樂斌,劉椏麗,何平,李樂樂,羅雪韻,楊學為,鄒文廣,賀超,孫孟京
1(邵陽學院 食品與化學工程學院,湖南 邵陽,422000)2(豆制品加工與安全控制湖南省重點實驗室,湖南 邵陽,422000)3(貴州亮歡寨生物科技有限公司,貴州 凱里,556000)
大豆蛋白是一種具有較高營養價值的植物性蛋白,大豆多肽是大豆蛋白的水解產物,其氨基酸組成和大豆蛋白一致。但大豆多肽分子質量比大豆蛋白更小,從而更容易被吸收。大豆多肽還具有降血壓、降血脂、抗氧化及抗腫瘤等多種活性功能[1-2],關于大豆多肽的生理活性功能探究也是目前的研究熱點。FANG等[3]比較了不同酶解方法制備多肽對蛋白質提取率、抗氧化及免疫活性的影響,LI等[4]概述了大豆多肽在降高血壓中的作用。
固體飲料是指以食品或植物提取物為原料,添加適當的輔料或食品添加劑制成的粉末狀、顆粒狀的固態制品,具有風味獨特、貯存期長、易攜帶等特點[5-6]。多肽固體飲料既保留了固體飲料原有特點,同時還具備了大豆多肽的活性功能,能夠一定程度地提高免疫力,提供營養和能量的同時能夠增加飽腹感,減少多余熱量的攝入等。但由于多肽具有一定的苦味,在一定程度上也限制了多肽類產品的發展[7-8]。目前與大豆多肽相關的研究大多集中在其制備工藝、分離純化及生理活性的探究上,尹樂斌等[9]探究了酶解豆清液制備大豆多肽的工藝條件,最后還進行了抗氧化活性的研究;肖聰麗等[10]對大豆多肽進行分離純化,最后鑒定并篩選出5個多肽。目前有關大豆多肽固體飲料的研究還鮮有報道。
本文以大豆分離蛋白為原料,采用包埋掩蓋脫苦方式以酶解后大豆多肽為芯材,β-環糊精為壁材進行包埋從而降低大豆多肽的苦味制備一款低苦味多肽固體飲料,并進行結構表征及體外模擬消化探究,以期為大豆多肽的產品開發提供新思路。
1 材料與方法
1.1 材料與試劑
大豆分離蛋白,浙江一諾生物科技有限公司;β-環糊精,廣州嘉業食品配料有限公司;堿性蛋白酶,河南仰韶生物酶制劑有限公司;ABTS,合肥巴斯夫生物科技有限公司;其余試劑均為國產分析純。
1.2 儀器與設備
TDZ5臺式低速離心機,Dynamica Scientific Ltd.;ZNCL-BC磁力攪拌器,上海越眾儀器有限公司;D-7型紫外可見分光光度計,上海舜宇恒平儀器有限公司;DX-2700BH X射線衍射掃描儀,丹東通達科技公司;DSC3熱量掃描差示儀,梅特勒-托利多公司。
1.3 實驗方法
1.3.1 工藝流程
低苦味多肽固體飲料工藝流程如下:
堿性蛋白酶 β-環糊精
↓ ↓
大豆分離蛋白→酶解→離心→純化→低苦味多肽固體飲料的制備
1.3.2 低苦味多肽固體飲料的制備
將大豆分離蛋白3%(質量分數)分散于水中,先在(80±2) ℃條件下處理15 min,冷卻至預定溫度后恒溫水浴,調節pH至8.0,加入堿性蛋白酶[V(酶)∶V(底物)=1∶100]于50 ℃水浴中酶解。酶解4 h后,調節pH至7.0,立即沸水滅酶10 min,待溶液冷卻后離心(8 000 r/min,15 min),取上清液過5 kDa超濾膜純化后備用[11]。
取一定量的大豆多肽溶液,添加一定量的β-環糊精,在一定溫度下恒溫磁力攪拌反應一段時間后,于-20 ℃下預凍后取出并冷凍干燥20 h,粉碎后即得低苦味多肽固體飲料[12]。
1.3.3 多肽含量的測定
參考呂凱波等[13]的方法略作修改:取樣品溶液2 mL,按1∶1加入10%(質量分數)的三氯乙酸(trichloroacetic acid,TCA)溶液使其混合均勻,室溫下靜置10 min后在6 000 r/min 條件下離心10 min,取上清液加入雙縮脲試劑[V(樣液)∶V(雙縮脲試劑)=2∶3]混合均勻,37 ℃恒溫水浴30 min,測定吸光度(純水代替樣品做空白),根據標準曲線計算樣品中多肽含量。
1.3.4 包埋率與苦味值的測定
配制質量濃度為20 mg/mL的樣品溶液,充分溶解后于6 000 r/min 離心10 min測定其多肽含量,并計算包埋率,包埋率計算如公式(1)所示:

(1)
苦味評分標準參考孟雅瀟[14]方法稍作修改:取適量未包埋的大豆多肽凍干粉配制成質量濃度為20 mg/mL的溶液,將其苦味定義為10分,取20 mL包埋處理后的多肽液10份依次加入0、10、20、30、40、50、60、70、80、90 mL的去離子水,攪拌均勻將其苦味值分別定義為10、9、8、7、6、5、4、3、2、1。選取20名經專業培訓后的同學(10男10女)進行評分,最終結果取均值。
1.3.5 單因素試驗
分別以壁芯比(7∶1、8∶1、9∶1、10∶1、11∶1,分別記為7、8、9、10、11)、包埋溫度(35、40、45、50、55 ℃)、包埋時間(30、40、50、60、70 min)為單因素,考查各因素在制備過程中對低苦味多肽固體飲料的包埋率與苦味值影響。
1.3.6 響應面優化試驗
在單因素基礎上,以包埋率和苦味值為指標采用響應面分析法中Box-Menken的中心組合試驗設計優化低苦味多肽固體飲料制備工藝。
1.3.7 物理指標的測定
1.3.7.1 水分的測定
1.檢驗人員。食品檢驗是人員手工操作與儀器緊密結合的工作過程,需要檢驗工作人員熟練掌握儀器的使用并嚴格按照檢驗流程進行檢驗活動的開展,但在實際的檢驗工作過程中,卻存在著人員專業素質欠缺、技術能力不足和處理意外事件的反應能力較差等問題。加之對人員工作的管理力度不夠大,使得檢驗人員的工作過于隨意,忽視了對工作流程和各個環節的要求,影響了食品檢驗結果的準確性。
采用水分測定儀測定多肽固體飲料的水分含量。
1.3.7.2 流動性的測定
參考李鵬飛等[15]的方法進行測定,流動性使用Carr index(CI)來衡量,流動性CI值的計算如公式(2)所示:

(2)
1.3.8 結構表征
傅里葉轉換紅外光譜(Fourier-transform infrared spectroscopy,FT-IR):參考岳陽[16]的方法。X-射線衍射(diffraction of x-rays,XRD)分析、熱重-熱差同步分析:參考徐思鑫等[17]的方法。
1.3.9 體外模擬消化研究
胃消化過程:用HCl將消化液調節pH至2.0,隨后加入10 mL胃蛋白酶溶液(由HCl溶液配制,終質量濃度2 mg/mL),攪拌均勻,37 ℃下振蕩(100 r/min)2 h。從瓶中在0、1、2 h分別吸取10 mL消化液樣品,迅速低溫冷凍離心(4 ℃,5 000 r/min),取上清液,置于-20 ℃保存備用,分別作為胃消化階段0、1、2 h樣品,消化時間記為1、2、3。
腸消化過程:用NaOH將瓶中消化液調節pH至7.4,隨后加入胰酶和豬膽鹽混合液(終質量濃度分別為1.2、2.4 mg/mL),攪拌均勻,置于37 ℃下振蕩4 h(100 r/min)。分別在0、1、2、3、4 h吸取10 mL消化液樣品,迅速低溫冷凍離心,取上清液,置于-20 ℃保存備用,分別作為腸消化階段0、1、2、3、4樣品,消化時間記為4、5、6、7、8[18-19]。
1.3.10 抗氧化活性的測定
羥自由基清除率、ABTS陽離子自由基清除率的測定參考尹樂斌等[20]的方法。
1.4 數據處理
所有實驗重復3次,運用WPS Excel 2016和Design Expert 8.0.6 軟件對數據進行處理分析,Origin 9.0進行繪圖。
2 結果與分析
2.1 單因素試驗結果
由圖1可知隨著β-環糊精的增加,包埋率也隨之上升而后呈緩慢下降趨勢,當壁芯比為9∶1時,包埋率較好,達到52.06%。可能是因為β-環糊精含量較低,大豆多肽含量較高,使得β-環糊精不足以有效包埋大豆多肽,隨著β-環糊精含量的增加,大豆多肽被包埋進β-環糊精空腔中,但β-環糊精過多時,其內部空腔未能充分利用,從而導致大豆多肽微膠囊包埋率緩慢下降。隨著β-環糊精的添加,苦味值逐漸減小,而超過一定量后,苦味值增加,產生了焦糊味[21],因此選擇壁芯比為9∶1時進行包埋最合適。
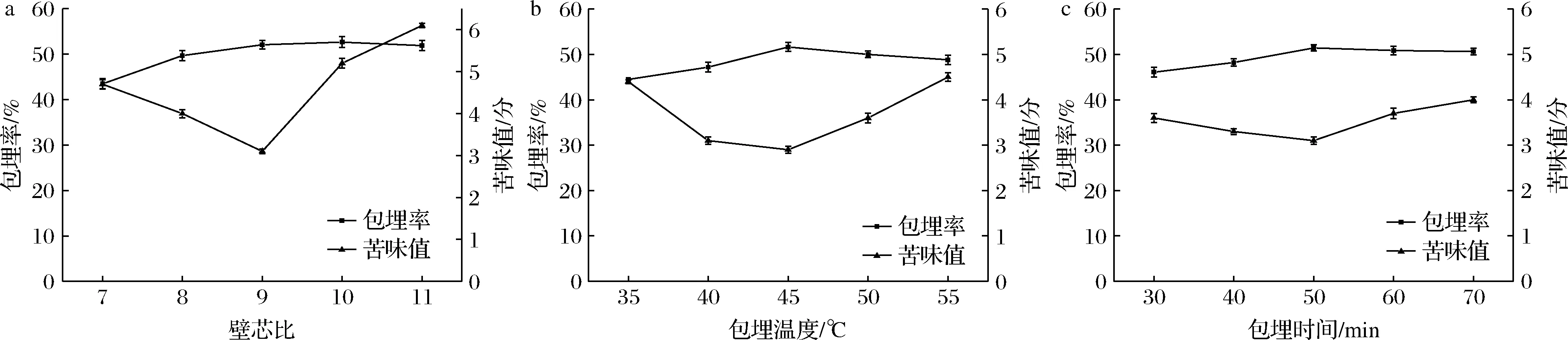
a-璧芯比;b-包埋溫度;c-包埋時間
隨著溫度的升高,樣品的包埋率逐漸升高,苦味值降低,當溫度為45 ℃時,苦味值最低,隨著溫度再次升高,苦味值開始增大,可能是因為高溫使得β-環糊精的內部結構發生變化,分子運動更為劇烈,大豆多肽又從β-環糊精空腔中移出[22]。綜合考慮,選擇45 ℃為最適包埋溫度。
隨著包埋時間的延長,包埋率逐漸增大,在包埋時間為50 min時包埋率趨于平緩。攪拌時間太短,大豆多肽與β-環糊精的接觸不充分,大豆多肽無法充分地進入β-環糊精的空腔內;一定時間后影響效果不明顯,可能是因為攪拌時間太長導致大豆多肽與β-環糊精之間的相互作用發生變化,造成包埋效果不良[23]。因此選擇時間為50 min進行包埋。
2.2 響應面優化試驗結果
響應面設計方案與優化結果根據單因素試驗結果,確定壁芯比(A)、包埋溫度(B)、包埋時間(C)為響應變量,運用Design-Expert8.0.6軟件Box-Behnken的中心組合設計,以包埋率(Y1)與苦味值(Y2)為響應值,優化低苦味多肽固體飲料制備工藝。實驗設計與結果見表1。
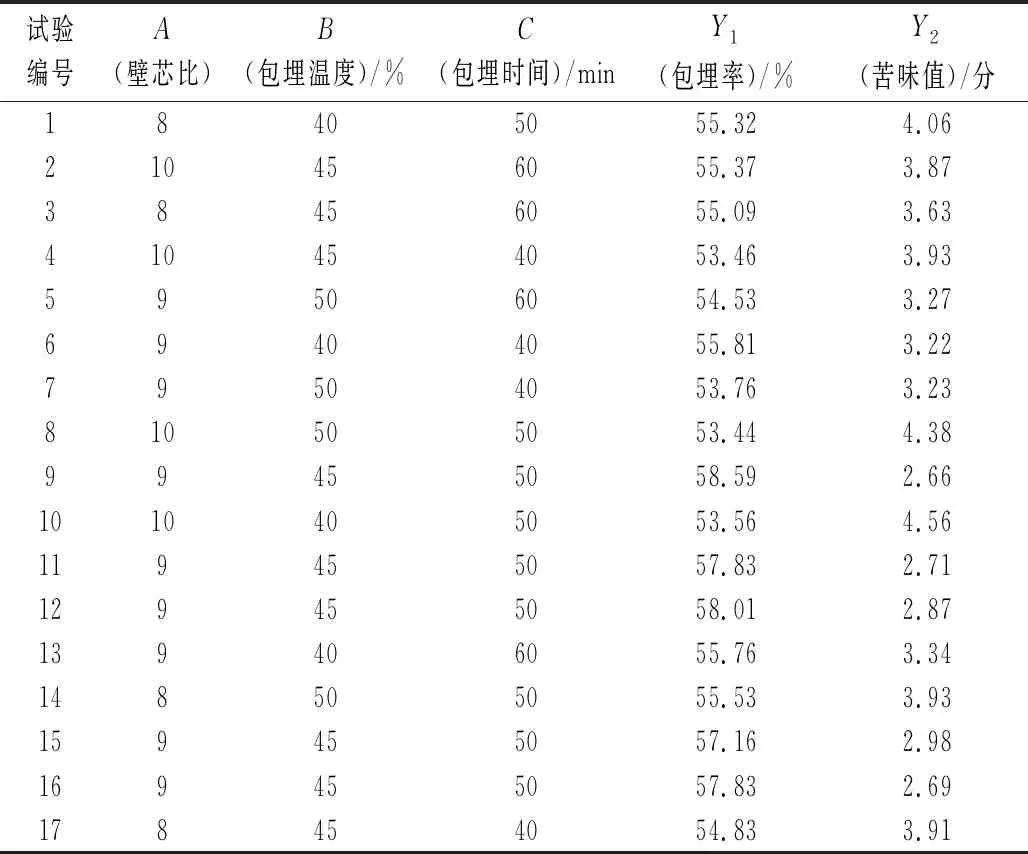
表1 Box-Behnken試驗設計與結果
運用Design-Expert 8.0.6軟件進行多元回歸擬合得到回歸方程:包埋率Y1=57.88-0.62A-0.40B+0.36C-0.083AB+0.41AC+0.21BC-1.85A2-1.57B2-1.35C2;苦味值Y2=2.78+0.15A-0.046B-0.023C-0.013AB+0.055AC-0.020BC+1.01A2+0.44B2+0.043C2。回歸方程進行方差分析見表2、表3。
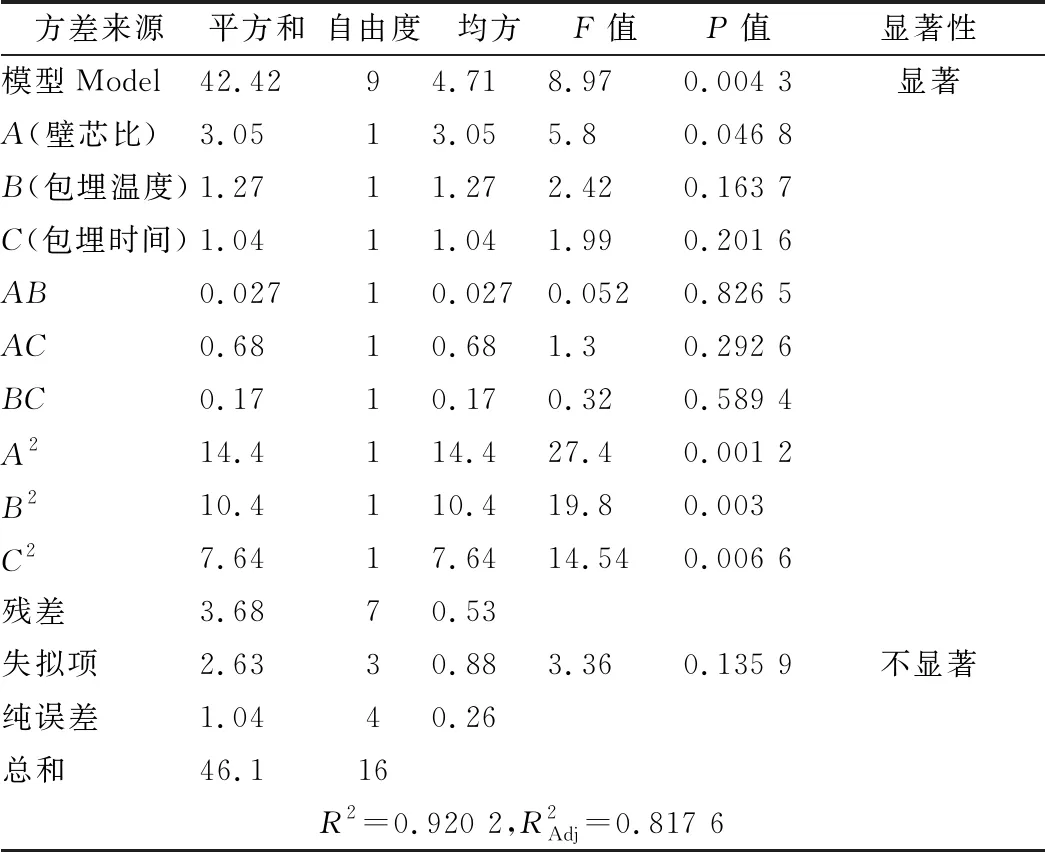
表2 包埋率回歸模型方差分析
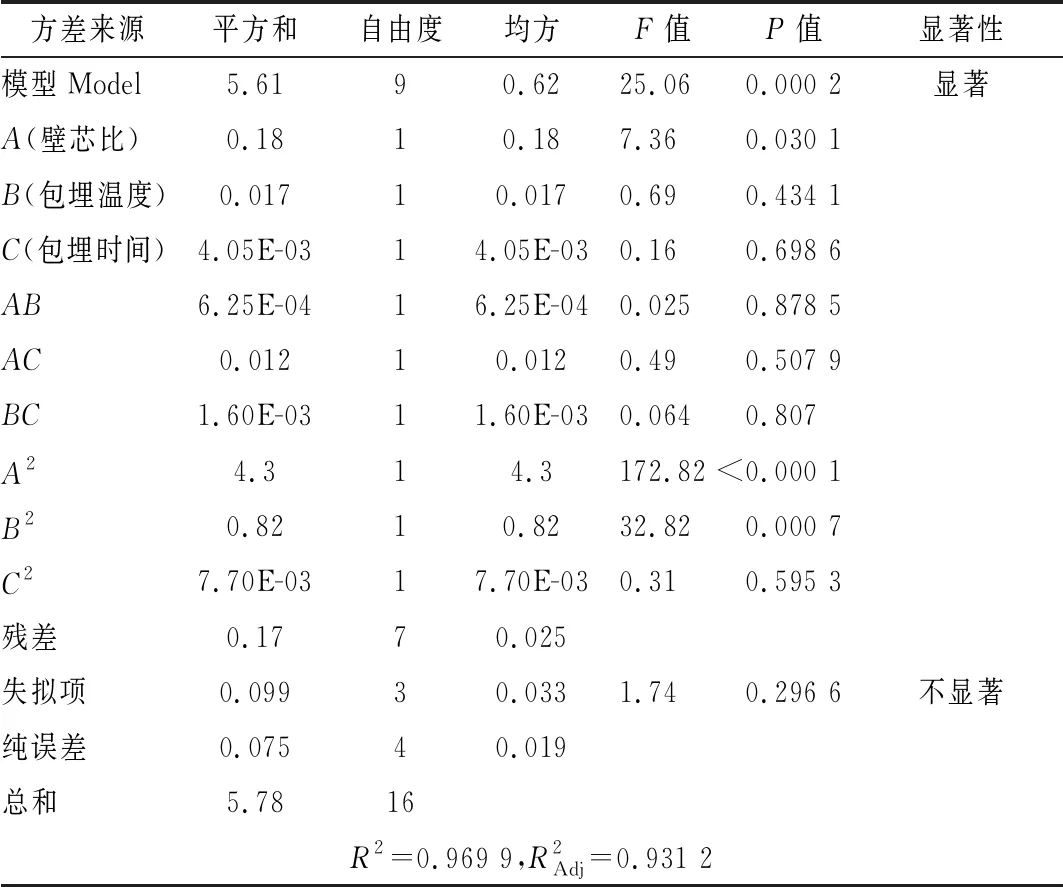
表3 苦味值回歸模型方差分析
2.3 最佳制備工藝的確定
經過Design-Expert 8.0.6軟件分析得到制備低苦味多肽固體飲料最佳條件為當壁芯比為8.85∶1,包埋溫度為44.42 ℃,包埋時間為51.02 min時,包埋率預測值達57.97%;當壁芯比為8.92∶1,包埋溫度為45.30 ℃,包埋時間為53.34 min時,苦味值預測為2.77分。結合實驗具體情況調整參數為壁芯比9∶1,包埋溫度為45 ℃,包埋時間為50 min。經3次平行實驗測得包埋率為(58.04±0.32)%,苦味值為(2.72±0.27)分,與預測值無明顯差異。
2.4 物理指標測定結果
對粉體的流動性CI值進行分級,<15表示流動性非常好,15~20較好,20~35一般,35~45較差,>45非常差。
由表4可知,固體飲料的水分含量為4.37%,低于國標要求6%,且其CI值為18.99%,流動性較好,顆粒間的吸附不強。

表4 低苦味多肽固體飲料物理指標測定結果
2.5 FT-IR紅外光譜分析


圖2 大豆多肽、β-環糊精及固體飲料紅外掃描光譜圖
2.6 XRD分析
由圖3可知β-環糊精在10°、12°、22°、27°均有較強的衍射峰,說明其具有較強的晶體結構,是以晶體形態存在的化合物,大豆多肽呈現無定型狀態,只在25°附近存在1個較寬泛的衍射峰,可能是由于α-螺旋結構引起。對比3種物質的XRD譜圖可看出,固體飲料峰的強度發生了明顯變化,與β-環糊精相比,峰值減弱或消失,說明固體飲料具有晶體結構,且結構發生了變化[26-27],也從側面證明芯材與壁材包埋成功。

圖3 大豆多肽、β-環糊精及固體飲料的XRD譜圖
2.7 熱重-差熱分析
熱重-差熱同步分析 (thermogravimetric-differential thermal analysis,TG-DTA)可對樣品熱穩定性、組成及熱反應變化有效表征。將圖4與圖5進行對比可知,當溫度在100 ℃附近時,二者均有一定程度的失重,可能是由于樣品中水分的蒸發所導致,隨著溫度的上升也可看出,固體飲料的失重曲線較為平緩,說明固體飲料與大豆多肽相比,具有更好的熱穩定性。隨著TG曲線的下降,DTA曲線峰值也發生變化,二者對比可發現固體飲料的DTA曲線變化更為顯著,115 ℃附近出現1個吸熱峰,可能是因為物質的脫水作用[28-29],由此也說明固體飲料在沖調飲用過程中的熱穩定性比大豆多肽更佳。

圖4 大豆多肽的TG-DTA曲線
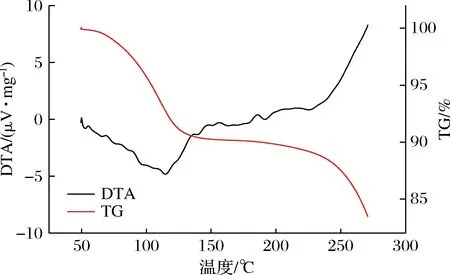
圖5 固體飲料的TG-DTA曲線
2.8 體外模擬消化過程中抗氧化活性變化情況
由圖6可知,在腸消化階段的羥自由基清除率比胃消化階段要高,隨著消化時間的延長,羥自由基清除率逐漸升高,最終達到74.55%;由圖7可知在腸消化階段其ABTS陽離子自由基清除率最高達到99.72%,接近100%,二者均說明β-環糊精能夠較好的包埋大豆多肽,隨著消化時間的延長,固體飲料的抗氧化活性也隨之增強,可能是胃、胰蛋白酶處理使得多肽中的抗氧化氨基酸殘基更充分暴露,使得抗氧化活性增長[30],也有可能是因為在腸消化階段包埋后的大豆多肽得到了一定的釋放,大豆多肽本身具有較好的抗氧化活性,因此表現出腸消化階段的抗氧化活性高于胃消化階段,更有利于人體的吸收利用。
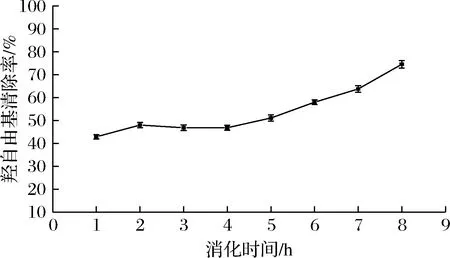
圖6 羥自由基清除率變化情況
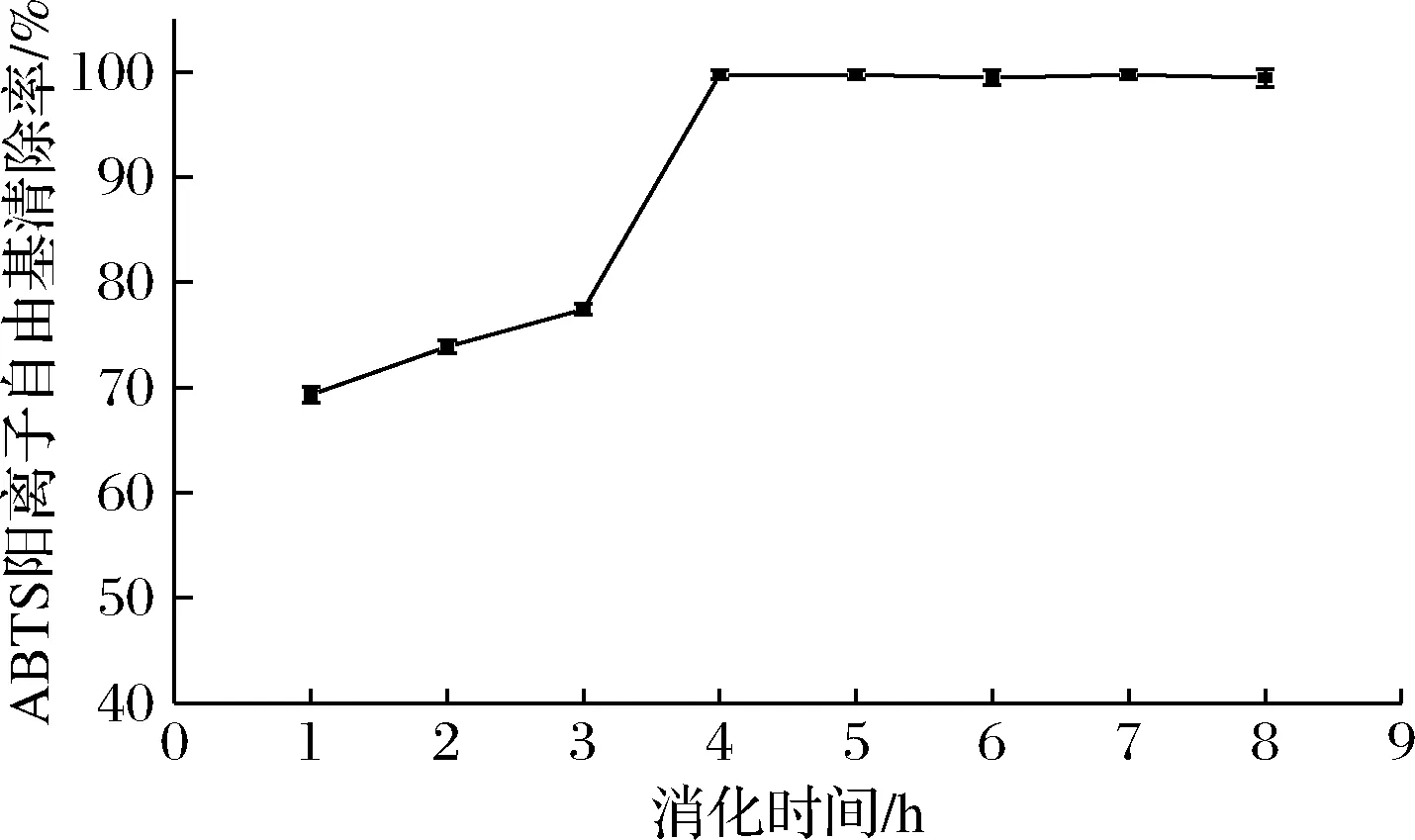
圖7 ABTS陽離子自由基清除率變化情況
3 結論
以酶解大豆分離蛋白所得大豆多肽為原料芯材,采用β-環糊精為壁材對其進行包埋掩蓋脫苦制備低苦味多肽固體飲料,以包埋率與苦味值為評價指標,在壁材與芯材比例、包埋溫度、包埋時間3個單因素的基礎上,采用響應面試驗進行工藝優化。得到最適的包埋條件為壁芯比為8.85∶1,包埋溫度為44.42 ℃,包埋時間為51.02 min,此時包埋率預測值達57.97%;壁芯比8.92∶1,包埋溫度為45.30 ℃,包埋時間為53.34 min時,苦味值預測為2.77。結合實驗具體情況調整參數為壁芯比9∶1,包埋溫度為 45 ℃,包埋時間為50 min。經3次平行實驗測得包埋率為(58.04±0.32)%,苦味值為(2.72±0.27)分與預測值無顯著差異。固體飲料結構表征結果說明,固體飲料的制備過程為物理包埋過程,體外模擬消化系統對其固體飲料抗氧化活性的影響情況可知,通過包埋掩蓋脫苦制得的多肽固體飲料既使多肽本身苦味得到掩蓋降低,又仍保持其良好的抗氧化活性。因此,通過包埋掩蓋方式制得的低苦味多肽固體飲料,將產生一定的經濟和社會效益,具有廣闊的開發應用前景。

