不同茶湯與乳清蛋白相互作用的研究
耿子蔚,丁玉婕,童群義
(江南大學 食品學院,江蘇 無錫,214122)
新式茶飲是以各種茶葉通過不同的萃取方式得到的濃縮液為原料,然后加入乳制品或水果混合而成的飲料[1]。隨著居民生活水平的提高和健康意識的增強,新式茶飲的市場份額將進一步擴大,人們對茶飲的要求也越來越高。茶飲料生產過程中,浸提是關鍵程序之一,它影響茶飲料的品質,而且浸提效果的好壞影響原料利用率和后續生產過程[2]。目前茶飲料生產大多采用高溫萃取,高溫萃取是企業主流生產技術[3]。高溫可提高茶多酚、咖啡堿、氨基酸等成分的提取率,但是制得的茶湯苦澀味較重、顏色較深。低溫萃取的茶湯清爽甘甜,同時能減少茶乳酪的生成從而使茶湯澄清透明,但是低溫條件下萃取率低,需要長時間浸泡茶葉[4]。
乳清蛋白是指牛乳在pH 4.6下沉淀酪蛋白后分離出的蛋白質,約占牛乳蛋白的五分之一,是一種優質天然蛋白[5]。乳清蛋白在食品生產加工中具有廣泛應用,因為它既有豐富的營養價值,又有乳化性、持水性等功能性質。茶多酚是茶葉中所有酚類化合物的總稱,主要有兒茶素類、黃酮及其衍生物、酚酸和縮酚酸類[6]。兒茶素類是茶多酚的主要物質,主要組成物質有表兒茶素(epicatechin,EC)、表沒食子兒茶素(epigallocatechin,EGC)、表沒食子兒茶素沒食子酸酯(epigallocatechin gallate,EGCG)、表兒茶素沒食子酸酯(epicatechin gallate,ECG)等。茶多酚有抗氧化、治療糖尿病、改善骨質疏松[7]等作用,但它會給人帶來苦澀味,因此人們喜歡將茶與牛奶混合飲用。牛奶作為輸送茶多酚類物質的有效載體[8],即可以減輕茶多酚的苦澀感,又提高了二者的營養價值。消費者除了關注食品的口感風味,還關注食品的營養與健康,他們更愿意選擇天然的食品。茶多酚與蛋白質發生相互作用后,不僅影響食品的功能特性,還可能影響食品的營養效能。牛奶蛋白主要是由酪蛋白和乳清蛋白組成,酪蛋白含量約為乳清蛋白的4倍[9]。HASNI等[10]研究表明,兒茶素與α-酪蛋白、β-酪蛋白均能結合改變酪蛋白的結構,更多的蛋白質去折疊,并推測牛奶對茶多酚抗氧化活性的影響是因為酪蛋白結構的變化。杜淑霞等[6]研究表明,牛奶蛋白與茶多酚混合會降低牛奶蛋白的離體消化率,且茶多酚含量≥2 g/kg 時牛奶蛋白的離體消化率隨茶多酚濃度的增加而顯著降低。關于不同浸提溫度制得的茶湯對乳清蛋白的影響比較少見。本文研究了不同溫度浸提的茶湯以及不同濃度的EGC、EGCG與乳清蛋白相互作用對乳清蛋白結構的影響,為含有多酚化合物的乳制品開發提供參考。
1 材料與方法
1.1 材料與試劑
雨前龍井茶,西湖牌;乳清蛋白(純度>80%),上海源葉生物科技有限公司;水合茚三酮、氯化亞錫二水合物,北京伊諾凱科技有限公司;福林酚,乙腈(色譜純),上海麥克林生化科技有限公司;蒽酮、堿式乙酸鉛、PBS磷酸鹽緩沖液片劑,無水碳酸鈉、沒食子酸,國藥集團化學試劑有限公司;EGC、EGCG標準品,南京春秋生物工程有限公司;咖啡因標準品,信陽萊耀生物科技有限公司。
1.2 儀器與設備
恒溫水浴鍋,鞏義市予華儀器有限公司;UV-2800A紫外分光光度計,麥儀科學儀器(上海)有限公司;HP1100 高效液相色譜儀,美國安捷倫科技有限公司;F-7000型熒光分光光度計,日本日立公司;IS10傅里葉紅外光譜儀,美國Nicolet公司。
1.3 實驗方法
1.3.1 茶湯的制備
取茶葉2 g,按照茶水比1∶50浸提,浸提時間30 min,取茶湯備用。浸提溫度分別為45、55、65、75、85 ℃。
1.3.2 茶湯主要物質含量測定
茶多酚含量的測定方法采用福林酚比色法。
EGCG、EGC含量的測定采用HPLC法。流動相A:5%乙腈+95%水;流動相B:純乙腈;液相色譜柱:C18(250 mm×4.6 mm,5 μm);流動相流速:0.6 mL/min;柱溫:30 ℃;紫外檢測器:λ=278 nm;進樣量:5 μL;梯度條件:0~5 min,0% B相;5~35 min,0%~20% B相;35~45 min,20%~50% B相;45~50 min,50% B相;50~60 min,50%~0% B相;60~66 min,0% B相。
游離氨基酸總量的測定方法參考GB/T 8314—2013《茶 游離氨基酸總量的測定》,采用茚三酮比色法。
總糖含量的測定采用硫酸蒽酮比色法。
咖啡堿含量的測定方法參考GB/T 8312—2013《茶 咖啡堿測定》,采用紫外分光光度法。
1.3.3 溶液的配制
乳清蛋白用pH 7.4 PBS磷酸鹽緩沖液配置成5 mg/mL儲備液。EGCG和EGC用去離子水配置成1 mg/mL儲備液,現用現配。
1.3.4 紫外-可見吸收光譜測定
以相應試劑作為空白對照,測定乳清蛋白加入不同茶湯和不同濃度EGCG、EGC溶液后的紫外-可見吸收圖譜。取乳清蛋白儲備液(質量濃度為5 mg/mL)10 mL,分別加入0.1 mL不同溫度浸提的茶湯,用去離子水定容到20 mL。取乳清蛋白儲備液(質量濃度為5 mg/mL)10 mL,分別加入0、0.5、1.0、1.5、2.0、2.5、3.0 mL EGCG、EGC儲備液,用去離子水定容到20 mL。將混合溶液于37 ℃水浴反應2 h后取出。紫外吸收光譜波長掃描范圍為250~500 nm,采樣間隔1 nm。
1.3.5 傅里葉變換紅外光譜
取乳清蛋白儲備液(質量濃度為5 mg/mL)10 mL,分別加入2 mL不同溫度浸提的茶湯,用去離子水定容到20 mL。取乳清蛋白儲備液(質量濃度為5 mg/mL)10 mL,分別加入0、0.5、1.0、1.5、2.0、2.5、3.0 mL EGCG、EGC儲備液,用去離子水定容到20 mL。將混合溶液于37 ℃水浴反應2 h后取出,然后倒入平皿中進行冷凍干燥。將凍干后的樣品與KBr顆粒按照1∶100混合,研磨成粉末后用壓片機壓成片狀固體。記錄樣品400~4 000 cm-1的光譜。
用PeakFit軟件處理酰胺Ⅰ帶(1 600~1 700 cm-1)圖譜,然后根據峰的積分面積得出乳清蛋白二級結構的相對百分含量。
1.3.6 熒光光譜測定
取5 mg/mL乳清蛋白儲備液10 mL,分別加入0、0.5、1.0、1.5、2.0、2.5、3.0 mL EGC、EGCG儲備液,用去離子水定容到20 mL。將混合溶液于310 K(37 ℃)水浴反應2 h后進行熒光掃描。設置激發波長280 nm,發射波長290~500 nm,激發和發射的狹縫寬度均為5 nm。熒光光譜掃描條件不變,再次掃描290 K和300 K條件下反應的光譜。
1.4 數據分析
圖表中數據均為平均值,數據分析采用Microsoft Office Excel 2016、SPSS 軟件,作圖采用Origin 2018軟件。
2 結果與分析
2.1 茶湯中主要物質含量
不同溫度浸提的茶湯中主要物質含量如表1所示。浸提溫度影響茶湯主要物質的浸出量,茶湯中主要物質的浸出量隨浸提溫度的升高而增多。茶多酚是茶飲料中的主要功效成分,茶多酚含量是評判茶飲料品質的重要指標之一[11]。氨基酸是茶飲料鮮爽滋味的貢獻物質之一,它除了本身具有鮮味,還可以豐富產品原本的風味。可溶性糖在制茶過程中可以與氨基酸、多酚類等發生化學反應,或在烘焙過程中形成芳香成分以及呈色物質,能夠使茶湯甜醇[12]。咖啡堿是茶湯中主要的苦味物質,且易溶于80 ℃以上的熱水,所以高溫浸提時咖啡堿浸出量顯著增加(P<0.05)。茶湯中酯型兒茶素含量最多的是EGCG,非酯型兒茶素含量最多的是EGC[13]。如圖1所示,隨著浸提溫度升高,EGCG含量與EGC含量的比值越來越大。與非酯型兒茶素相比,酯型兒茶素喝起來苦澀味更重,更容易與蛋白質結合發生相互作用。
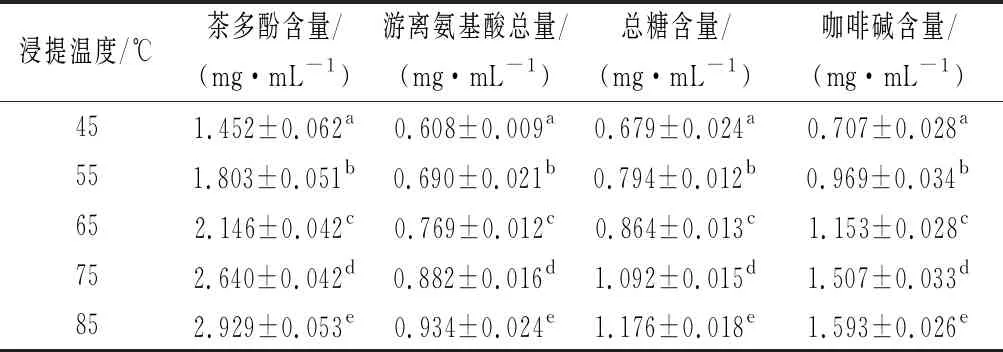
表1 不同溫度浸提的茶湯中主要物質含量
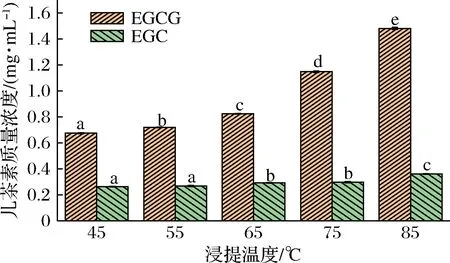
圖1 不同溫度浸提的茶湯中EGCG、EGC含量
2.2 紫外-可見吸收光譜分析
組成蛋白質的部分氨基酸殘基具有紫外吸收的性質,因此紫外-可見吸收光譜可通過吸收峰的位置及強度的變化來判斷多酚對蛋白質結構的影響。色氨酸、酪氨酸、苯丙氨酸殘基對紫外光的吸收導致蛋白質的紫外吸收。蛋白質構象影響氨基酸殘基的微環境,構象改變微環境也隨之改變,生色基團的紫外吸收光譜就發生變化[14]。本實驗測定了茶湯、EGC、EGCG添加前后乳清蛋白的紫外-可見吸收光譜,結果如圖2所示。
由圖2可知,加入茶湯、EGC、EGCG之前,乳清蛋白在280 nm附近有最大吸收峰。加入茶湯、EGC、EGCG之后,乳清蛋白的吸收峰增強,吸收峰值隨著濃度的增大而增大,且吸收峰發生了藍移。結果顯示,茶湯、EGCG、EGC都與乳清蛋白發生相互作用,從而使乳清蛋白結構改變。與EGC相比,EGCG的吸收峰峰值更大,吸收峰形態變化更明顯,說明EGCG對乳清蛋白結構的影響大于EGC,兩者的相互作用更強。發生相互作用后,乳清蛋白的肽鏈伸展,氨基酸殘基的微環境發生變化。與茶湯、EGC、EGCG反應后乳清蛋白吸光度增強,說明這種構象變化有利于乳清蛋白的色氨酸和酪氨酸殘基芳香環的π-π*躍遷[15]。通過紫外-可見吸收光譜的變化可以看出,茶湯、EGC、EGCG對乳清蛋白的猝滅類型是靜態猝滅[16]。
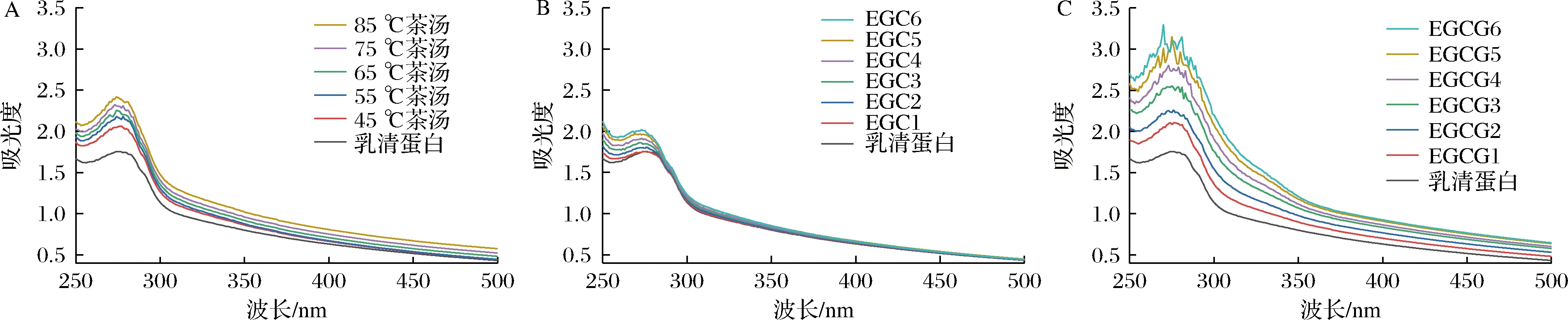
A-茶湯;B-EGC;C-EGCG
2.3 蛋白質二級結構分析
蛋白質的二級結構主要包括α-螺旋、β-折疊、β-轉角、無規則卷曲。傅里葉變換紅外光譜是對氫鍵變化非常敏感的一種檢測方法,它可以提供有關多酚-蛋白質復合物中蛋白質鏈構象和疏水性結合的信息,可以分析蛋白質結構變化。由表2可知,茶湯、EGC、EGCG加入后,乳清蛋白的α-螺旋、β-折疊含量減少,β-轉角、無規則卷曲含量增加。隨著浸提溫度升高,茶湯對乳清蛋白二級結構含量的影響增大,這是因為高溫浸提的茶湯中含有更多的茶多酚等物質,更容易與乳清蛋白發生反應。與EGC相比,EGCG對乳清蛋白二級結構含量的影響更大。當EGCG與EGC儲備液添加量均為3.0 mL時,乳清蛋白的α-螺旋分別減少了2.70%、1.95%,β-折疊分別減少了3.10%、2.40%,β-轉角分別增加了2.58%、2.25%,無規則卷曲分別增加了3.92%、3.14%。結果表明,茶湯、EGC、EGCG均能使乳清蛋白結構發生輕微變化,沒有完全破壞乳清蛋白的二級結構。不同兒茶素對乳清蛋白二級結構的影響程度不同,這可能與不同兒茶素與乳清蛋白結合能力不同有關。
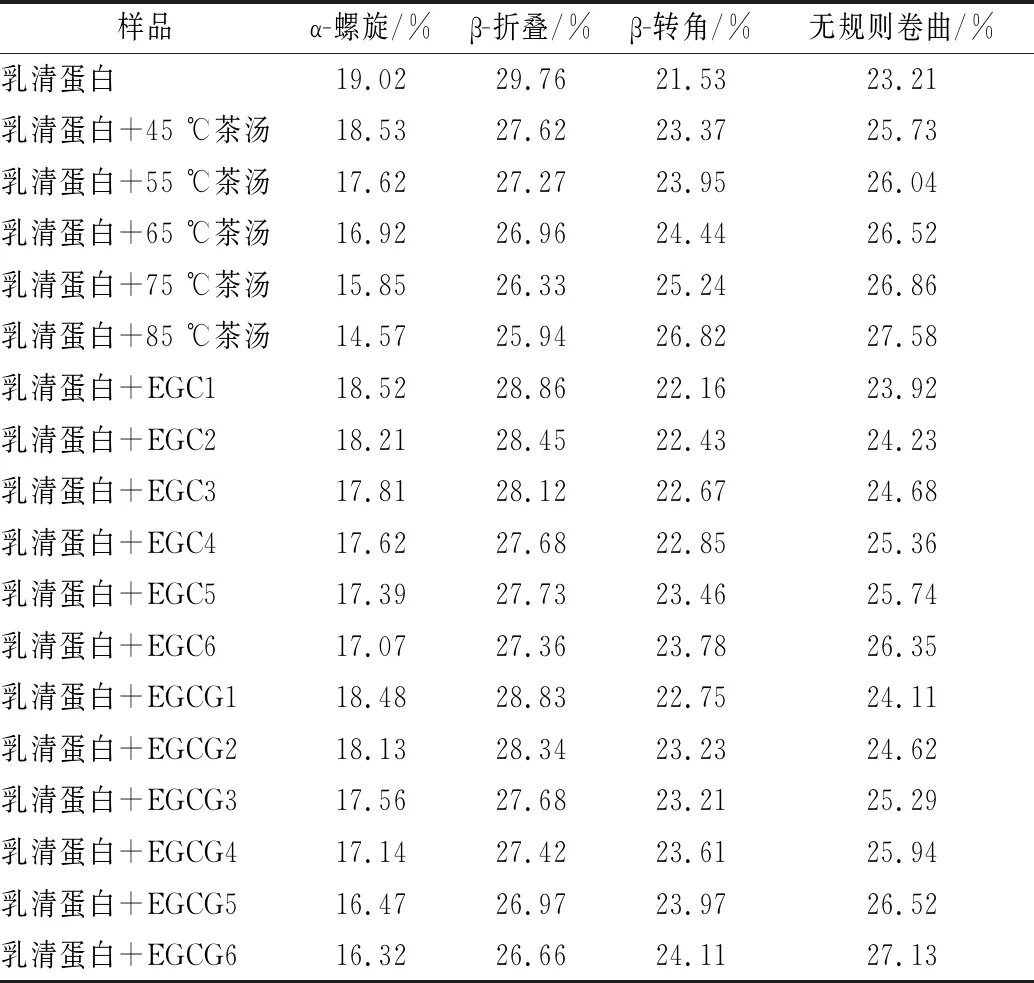
表2 加入茶湯、EGC、EGCG前后乳清蛋白二級結構含量
2.4 熒光光譜分析
乳清蛋白中有色氨酸、酪氨酸和苯丙氨酸殘基,它們是使蛋白質具有內源性熒光特性的主要基團[17]。當激發波長設置為280 nm時,蛋白質的熒光光譜主要是由色氨酸、酪氨酸產生[18]。由圖3可知,隨著兒茶素濃度的增大,熒光光譜的峰形基本未發生變化,但是熒光強度減小,最大熒光發射波長有輕微紅移。保持乳清蛋白濃度不變,EGC和EGCG都對乳清蛋白有猝滅作用,猝滅效果隨濃度的增大而增強,而且可以看出EGCG的猝滅效果強于EGC。蛋白質中熒光發色基團本身及其周圍環境發生變化可通過熒光光譜的變化表現出來。EGC、EGCG與乳清蛋白反應后,乳清蛋白的熒光光譜發生變化,說明EGC、EGCG與乳清蛋白發生相互作用,乳清蛋白結構發生變化,色氨酸和酪氨酸的微環境發生變化,疏水性下降,生成不發射熒光的基態配合物[15]。
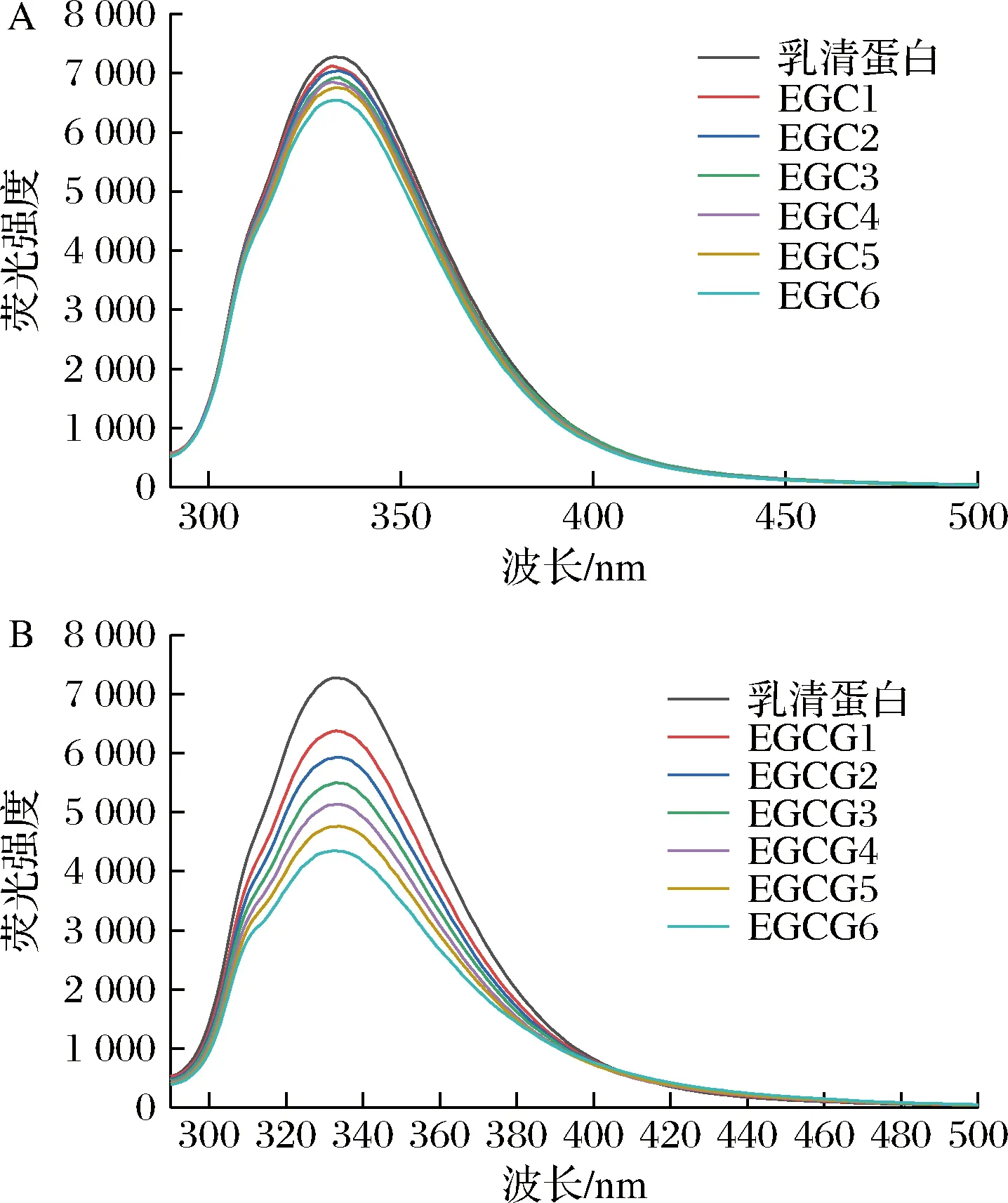
A-EGC;B-EGCG
2.5 熒光猝滅機制
乳清蛋白的熒光猝滅機制主要有2種:靜態猝滅和動態猝滅。靜態猝滅表現為反應溫度升高,猝滅常數降低。動態猝滅表現為反應溫度升高,猝滅常數也隨之升高。在290、300、310 K條件下,EGC、EGCG與乳清蛋白的猝滅機制可通過Stern-Volmer方程(1)來判斷:
(1)
式中:F0和F分別為熒光猝滅劑加入前后熒光分子的熒光強度;Kq為動態猝滅速率常數,L/(mol·s);τ0為熒光分子的平均壽命(生物大分子的熒光平均壽命為 10-8s);[Q]為猝滅劑EGC、EGCG的濃度,mol/L;KSV為動態淬滅常數,L/mol。
根據Stern-Volmer方程,以猝滅劑(EGC、EGCG)濃度[Q]作自變量,以相應的F0/F作因變量進行線性擬合,結果見圖4,再進一步計算出猝滅常數KSV和猝滅速率常數Kq,結果見表3。
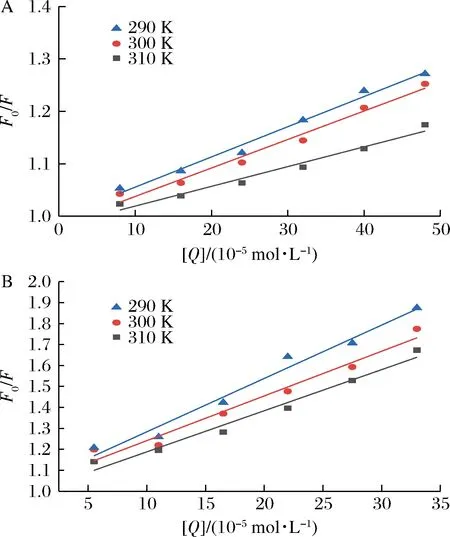
A-EGC;B-EGCG
由圖4可知,EGC、EGCG與乳清蛋白相互作用的Stern-Volmer曲線并不是完全呈直線關系(R2<0.98),說明EGC、EGCG對乳清蛋白的猝滅都不是主要由動態猝滅導致的,可能是由猝滅劑與熒光體分子間形成超分子復合物的靜態猝滅或靜態和動態猝滅相結合的猝滅導致[19]。由表3可知,隨溫度升高EGC、EGCG和乳清蛋白相互作用的猝滅常數KSV變小,并且它們的猝滅速率常數Kq大于各類猝滅劑對生物大分子的最大擴散猝滅常數2.0×1010L/(mol·s),說明EGC、EGCG與乳清蛋白的反應是靜態猝滅。
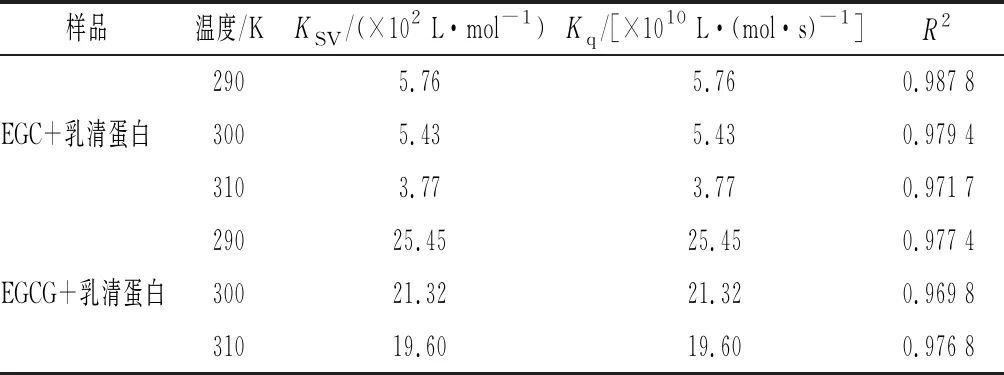
表3 不同溫度下EGC、EGCG與乳清蛋白相互作用的猝滅常數
2.6 結合常數和結合位點數
靜態猝滅時,熒光強度與結合常數KA、結合位點數n與猝滅劑濃度之間可按照方程(2)來計算:
(2)
式中:KA為猝滅劑(EGC、EGCG)與乳清蛋白間的結合常數,L/mol;n為每個蛋白質分子的結合位點數。
根據方程(2),以lg[Q]為自變量,以lg[(F0-F)/F]為因變量作圖,線性擬合后得到圖5。根據擬合直線的斜率和截距算出EGC、EGCG與乳清蛋白相互作用的結合位點數n和結合常數KA,計算結果列于表4。結合常數KA越大,說明分子與蛋白質之間的結合力越大。由表4可知,EGCG與乳清蛋白的結合常數大于EGC與乳清蛋白的結合常數,說明EGCG與乳清蛋白之間的結合力大于EGC與乳清蛋白。隨溫度升高,EGC、EGCG結合常數均增大,說明EGC、EGCG與乳清蛋白之間有共價作用,但還是非離子形式的相互作用占主導[20]。EGCG與乳清蛋白的相互作用力更大,可能和EGCG的分子結構有關。EGCG的分子結構中,酯基相連的苯環上有3個羥基,可能更容易與乳清蛋白形成氫鍵[21]。
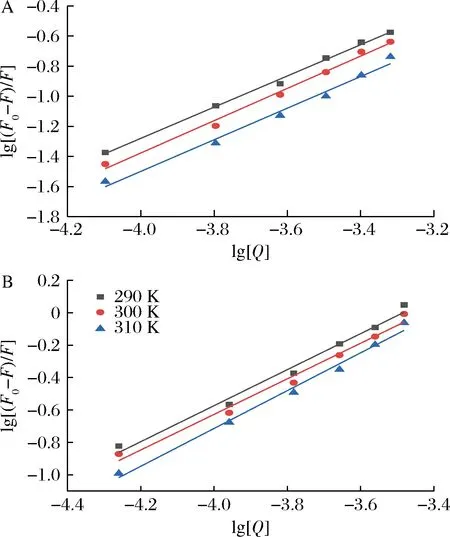
A-EGC;B-EGCG
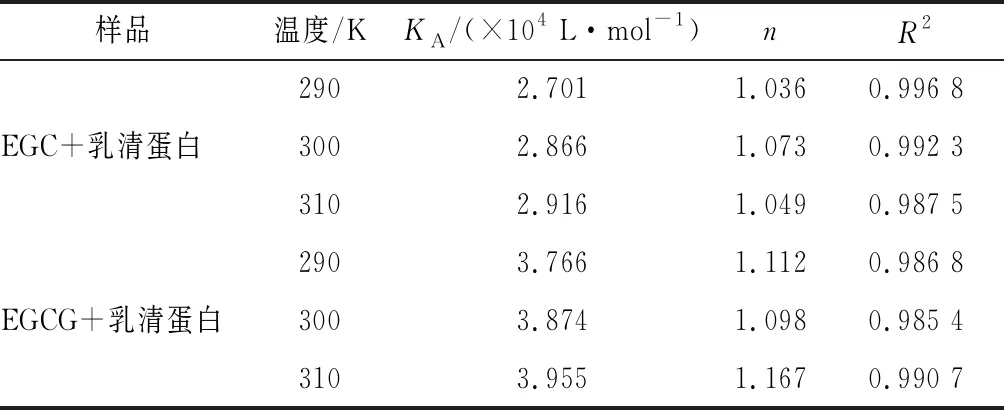
表4 EGC、EGCG與乳清蛋白相互作用的結合常數和結合位點數
2.7 熱力學參數
小分子與蛋白質分子間主要是靜電相互作用、疏水相互作用、氫鍵和范德華力等。配體與蛋白質間的相互作用力可以通過熱力學參數焓變ΔH、熵變ΔS和吉布斯自由能變ΔG來判斷。ΔH>0、ΔS>0,主要是疏水相互作用;ΔH<0、ΔS<0,主要是氫鍵或者范德華力;ΔH>0、ΔS<0,主要是靜電相互作用和疏水作用;ΔH<0、ΔS>0,主要是靜電作用。焓變ΔH、熵變ΔS和吉布斯自由能變ΔG可通過公式(3)~公式(5)來計算:
ΔG=ΔH-TΔS
(3)
ΔG=-RTlnKA
(4)
(5)
式中:R為氣體常數8.314 J/(mol·K);KA代表對應溫度T時的結合常數,L/mol;當溫度變化不大時,ΔH可認為恒定不變。先根據公式(4)計算ΔG,然后根據公式(5)作lnKA關于1/T的直線,由直線的斜率算出ΔH,最后根據公式(3)計算出ΔS。計算結果見表5所示。由表5可知,EGC、EGCG與乳清蛋白反應的ΔG均小于0,說明兩者的反應均是自發進行。EGC、EGCG與乳清蛋白反應的ΔH、ΔS均大于0,說明乳清蛋白與EGC、EGCG之間主要是疏水相互作用。
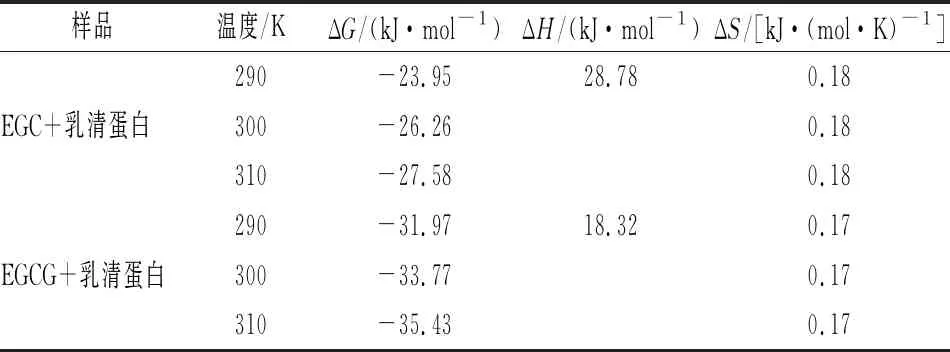
表5 EGC、EGCG與乳清蛋白相互作用的熱力學參數
3 結論
本研究通過紫外-可見吸收光譜、傅里葉變換紅外光譜、熒光光譜分析了不同浸提溫度制得的茶湯、EGC、EGCG對乳清蛋白結構的影響。結果表明,EGC、EGCG均可以與乳清蛋白發生相互作用形成復合物,且EGCG與乳清蛋白之間的相互作用力強于EGC。疏水相互作用是EGC、EGCG與乳清蛋白之間主要作用力,它們之間的反應均為自發進行。茶湯中富含茶多酚,從紫外-可見吸收光譜、傅里葉變換紅外光譜可知茶湯會導致乳清蛋白結構的改變,且浸提溫度越高,茶湯中茶多酚濃度越高,對乳清蛋白結構的影響越大。

