氣單胞菌群體感應(yīng)及其抑制劑研究進(jìn)展
涂明霞,劉 蕾,高 亮,張 穎,桂 萌,*,饒 瑜,*
(1.西華大學(xué)食品與生物工程學(xué)院,四川 成都 610039;2.北京市農(nóng)林科學(xué)院,北京市水產(chǎn)科學(xué)研究所,北京 100097)
氣單胞菌(Aeromonas)是一類革蘭氏陰性、兼性厭氧、一般具有運(yùn)動(dòng)性的細(xì)菌,其廣泛分布于淡水、河口、海灣、淤泥等水環(huán)境中。此外,氣單胞菌還廣泛存在于新鮮水產(chǎn)品中,是魚蝦等水產(chǎn)品的常見(jiàn)腐敗菌[1-3],且大多數(shù)氣單胞菌是嗜冷菌,在水產(chǎn)品冷藏期間可以繼續(xù)生長(zhǎng)。氣單胞菌是人類和動(dòng)物的環(huán)境條件致病菌,氣單胞菌感染會(huì)引發(fā)胃腸炎、菌血癥和傷口感染等疾病[4]。
群體感應(yīng)(quorum sensing,QS)是細(xì)菌通過(guò)分泌信號(hào)分子(也稱自誘導(dǎo)物(autoinducers,AI))調(diào)控相關(guān)基因表達(dá)從而適應(yīng)環(huán)境的一種信號(hào)交流機(jī)制,其參與調(diào)控細(xì)菌生物發(fā)光、毒力因子合成、生物被膜、質(zhì)粒的結(jié)合轉(zhuǎn)移、抗生素的合成等行為[5-6]。Nealson等[7]研究發(fā)現(xiàn)費(fèi)氏弧菌(Vibrio fischeri)能介導(dǎo)生物發(fā)光QS,它也被認(rèn)為是大多數(shù)革蘭氏陰性細(xì)菌QS的范式。QS在食品微生物生態(tài)學(xué)的建立和發(fā)展中發(fā)揮著重要作用[8]。Swift等[9]在嗜水氣單胞菌(A.hydrophila)和殺鮭氣單胞菌(A.salmonicida)中分別鑒定到LuxRI的同源物AhyRI和AsaRI,證實(shí)了氣單胞菌中存在QS系統(tǒng)。許多研究報(bào)道QS存在于氣單胞菌并參與其表型和功能的調(diào)控,一些研究表明QS參與調(diào)控氣單胞菌的腐敗能力和毒力因子的產(chǎn)生[3,10-11],提示可以通過(guò)抑制氣單胞菌QS系統(tǒng)解決其引起的腐敗和致病問(wèn)題。
傳統(tǒng)抗菌化合物(如抗生素)是通過(guò)干擾細(xì)菌的必需功能,如DNA、膜、肽聚糖和蛋白質(zhì)的合成殺死或抑制細(xì)菌。在水產(chǎn)養(yǎng)殖中經(jīng)常使用抗生素控制細(xì)菌疾病,這會(huì)導(dǎo)致抗生素耐藥細(xì)菌的發(fā)展和傳播,因此需要不斷開發(fā)新的抗菌藥物抑制新興的抗性菌株[12]。QS抑制劑(quorum sensing inhibitors,QSI)是一類只抑制微生物QS而不影響其生長(zhǎng)的化合物的總稱。QSI的優(yōu)點(diǎn)主要體現(xiàn)在其具有高度特異性,不會(huì)引發(fā)細(xì)菌耐藥性的增強(qiáng);QSI還具有化學(xué)穩(wěn)定性,并能抵抗各種宿主代謝系統(tǒng)的降解[13]。基于此,本文介紹氣單胞菌QS的種類及組成,并重點(diǎn)綜述植物來(lái)源、微生物和動(dòng)物來(lái)源、化學(xué)合成3 類QSI對(duì)氣單胞菌QS系統(tǒng)抑制作用的研究進(jìn)展,為氣單胞菌QSI的篩選和氣單胞菌防治提供參考。
1 氣單胞菌QS系統(tǒng)
氣單胞菌QS系統(tǒng)根據(jù)信號(hào)分子種類不同分為3 類:1)以N-酰基高絲氨酸內(nèi)酯類化合物(N-acyl homoserine lactone,AHLs)為信號(hào)分子的AI-1系統(tǒng);2)以4,5-二羥基-2,3-戊二酮(4,5-dihydroxy 2,3-pentanedione,DPD)衍生物自發(fā)重排為信號(hào)分子的AI-2系統(tǒng)[8];3)由QseBC雙組分轉(zhuǎn)導(dǎo)信號(hào)及響應(yīng)的AI-3系統(tǒng)[14]。其中氣單胞菌QS系統(tǒng)類型報(bào)道最多的是AI-1系統(tǒng),研究表明氣單胞菌的3 種QS系統(tǒng)之間存在相互作用,共同調(diào)節(jié)氣單胞菌的表型行為[15]。
1.1 氣單胞菌的AI-1系統(tǒng)
圖1 展示了嗜水氣單胞菌的A I-1 系統(tǒng)。根據(jù)細(xì)菌信號(hào)分子積累量不同,可將這一系統(tǒng)分為兩個(gè)階段,第一階段為自誘導(dǎo)階段(圖1A),此時(shí)嗜水氣單胞菌處于指數(shù)生長(zhǎng)期,AhyI酶催化S-腺苷甲硫氨酸(S-adenosylmethionine,SAM)和酰基載體蛋白的酰基和酰基側(cè)鏈合成AHLs[14]。AHLs與其特異性受體蛋白AhyR結(jié)合,并作為ahyRI編碼基因的轉(zhuǎn)錄調(diào)節(jié)因子參與自誘導(dǎo)循環(huán),進(jìn)一步促進(jìn)AHLs信號(hào)分子的合成[14]。AHLs可以在細(xì)胞膜上自由擴(kuò)散,并在細(xì)胞外環(huán)境中積累。在嗜水氣單胞菌進(jìn)入生長(zhǎng)穩(wěn)定期且當(dāng)AHLs信號(hào)分子積累量達(dá)到一定閾值后,氣單胞菌會(huì)進(jìn)入第二階段(圖1B),即細(xì)胞間激活階段。值得注意的是,與自誘導(dǎo)階段不同,AhyR/AHLs此時(shí)會(huì)負(fù)調(diào)控基因組ahyRI。胞外AHLs進(jìn)入細(xì)胞后同感應(yīng)蛋白AhyR形成AhyR/AHLs復(fù)合物以激活生物被膜和毒力相關(guān)基因轉(zhuǎn)錄表達(dá)[16]。胞外的外源長(zhǎng)鏈AHLs和QSI也能與受體蛋白AhyR結(jié)合,對(duì)氣單胞菌AHLs形成競(jìng)爭(zhēng)性抑制[14]。AI-1系統(tǒng)存在于絕大多數(shù)氣單胞菌中,如豚鼠氣單胞菌(A.caviae)[17]、殺鮭氣單胞菌[18]和維氏氣單胞菌(A.veronii)[19]等。近年來(lái)從水產(chǎn)品、植物和環(huán)境等不同樣本中獲取的氣單胞菌及其AI-1信號(hào)分子即AHLs種類和檢測(cè)方法如表1所示。氣單胞菌的AHLs的酰基鏈長(zhǎng)度介于C4~C18,并且可以通過(guò)不飽和、甲基分支、氧代或羥基取代基修飾[14],其中C4、C6及C8短鏈AHLs信號(hào)分子在氣單胞菌中最為常見(jiàn)。
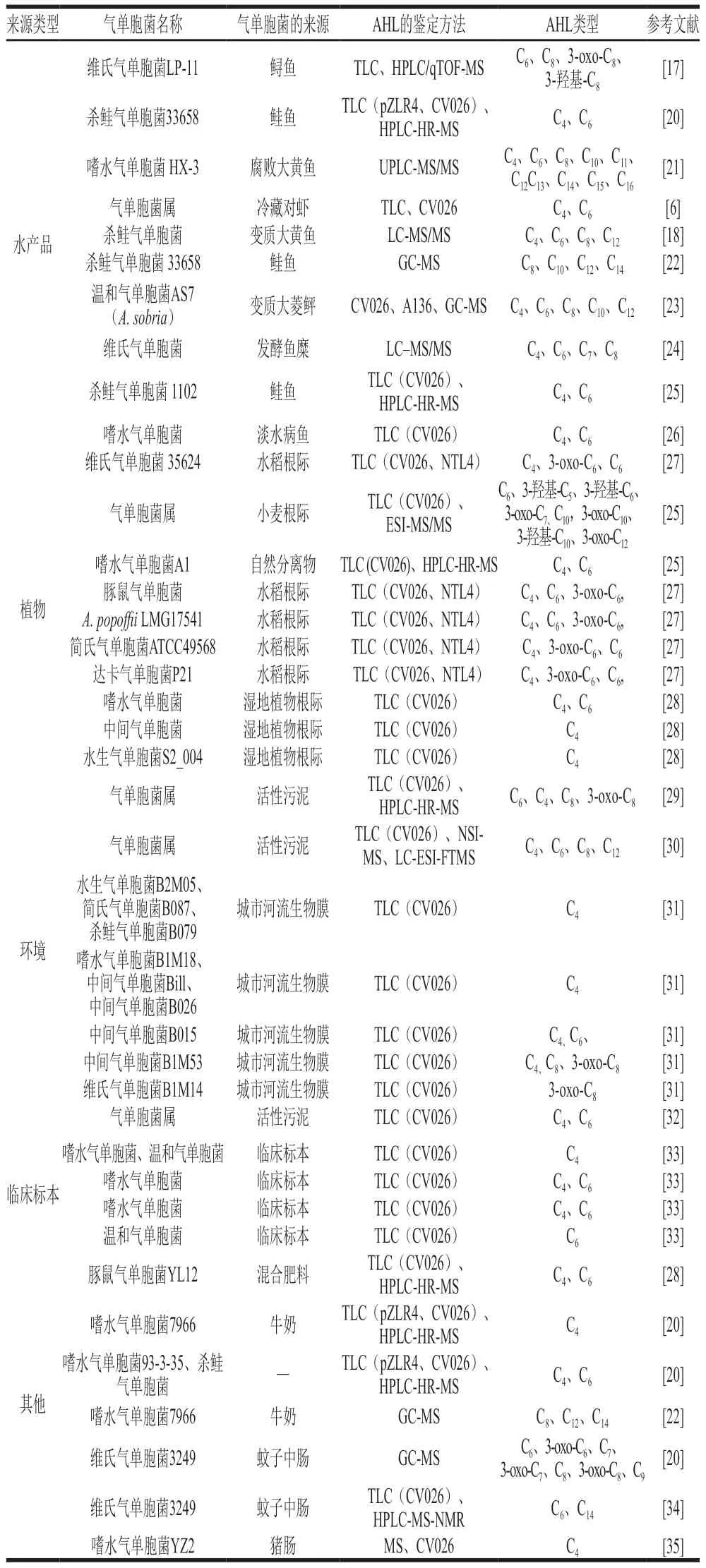
表1 不同來(lái)源的氣單胞菌產(chǎn)生的AHLs類型Table 1 AHLs produced by Aeromonas species from different sources
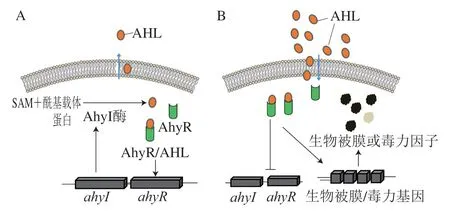
圖1 氣單胞菌的AI-1 QS系統(tǒng)示意圖Fig.1 Schematic diagram of AI-1 QS system in Aeromonas
1.2 氣單胞菌的AI-2和AI-3系統(tǒng)
目前有關(guān)氣單胞菌QS系統(tǒng)的報(bào)道多集中于AI-1系統(tǒng),對(duì)于AI-2和AI-3系統(tǒng)的報(bào)道較少。僅嗜水氣單胞菌[36]和殺鮭氣單胞菌[37]中發(fā)現(xiàn)了AI-2系統(tǒng)。AI-2信號(hào)分子合成途徑通常如圖2所示:1)S-腺苷甲硫氨酸(S-adenosylmethionine,SAM)在甲基轉(zhuǎn)移酶的催化下生成中間產(chǎn)物S-腺苷高半胱氨酸(S-adenosyl-homocysteine,SAH),S-腺苷高半胱氨酸核苷酶Pfs降解SAH生成S-核糖高同型半胱氨酸(S-ribosyl-homocysteine,SRH)[14];2)LuxS酶催化SRH裂解成4,5-二羥基-2,3-戊二酮(4,5-dihydroxy-2,3-pentanedione,DPD)[38],DPD自發(fā)環(huán)化形成呋喃酮類衍生物;3)DPD與硼酸鹽反應(yīng)形成AI-2分子[21]。
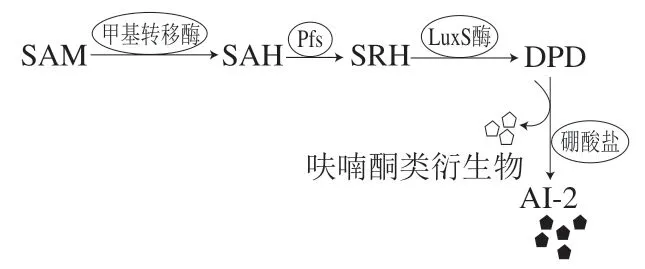
圖2 氣單胞菌的AI-2 QS系統(tǒng)示意圖Fig.2 Schematic diagram of AI-2 QS system of Aeromonas
達(dá)卡氣單胞菌SSU和嗜水氣單胞菌均具有AI-3系統(tǒng),即QseBC系統(tǒng),該系統(tǒng)編碼大腸桿菌QseBC的功能同源物[15,22],但氣單胞菌自誘導(dǎo)合成AI-3信號(hào)分子的機(jī)制還有待進(jìn)一步研究。基于大腸桿菌AI-3系統(tǒng)推測(cè)了氣單胞菌的AI-3系統(tǒng)包含兩個(gè)核心成分(圖3),即反應(yīng)調(diào)節(jié)因子QseB和傳感器蛋白QseC。AI-3信號(hào)分子與作為傳感器的跨膜蛋白QseC結(jié)合,QseC被AI-3信號(hào)激活后自動(dòng)磷酸化,將信號(hào)傳遞給QseB[14]。磷酸化的QseB激活相關(guān)毒力基因的轉(zhuǎn)錄,并自動(dòng)調(diào)節(jié)qseBC基因。

圖3 氣單胞菌的AI-3 QS系統(tǒng)示意圖Fig.3 Schematic diagram of AI-3 QS system of Aeromonas
2 氣單胞菌QSI研究進(jìn)展
QS介導(dǎo)的細(xì)菌通訊可以通過(guò)多種方式被阻斷:1)阻斷信號(hào)分子的合成;2)信號(hào)分子的酶促降解;3)競(jìng)爭(zhēng)或非競(jìng)爭(zhēng)性與受體蛋白結(jié)合,最終抑制靶基因表達(dá)[39]。QSI是一類能阻斷細(xì)菌QS系統(tǒng)的化合物[40],根據(jù)其來(lái)源的不同,可劃分為植物來(lái)源、微生物和動(dòng)物來(lái)源以及化學(xué)合成QSI。
2.1 植物來(lái)源氣單胞菌QSI
植物是天然QSI的主要來(lái)源之一,包括藥用植物、蔬菜和食用水果。植物來(lái)源QSI最大的優(yōu)點(diǎn)是安全性較高,特別是一些藥食同源性植物提取物[41]。近年來(lái)有關(guān)氣單胞菌植物源QSI及其QS抑制作用和機(jī)制如表2所示。其中部分植物源QSI的化學(xué)結(jié)構(gòu)如圖4所示。植物源QSI對(duì)氣單胞菌QS的抑制作用表型包括游動(dòng)、群集運(yùn)動(dòng)、蛋白酶產(chǎn)量、黏附能力、毒力基因的表達(dá)等[41]。在這些植物源QSI中,2(5H)-呋喃酮的作用機(jī)制研究最為清楚,它與嗜水氣單胞菌AHLs信號(hào)分子競(jìng)爭(zhēng)性配對(duì)受體蛋白結(jié)合位點(diǎn),弱化AHLs介導(dǎo)的調(diào)控[42]。生物被膜是包裹在由多糖、蛋白質(zhì)、脂質(zhì)和DNA組成的水合細(xì)胞外聚合物基質(zhì)中的細(xì)菌細(xì)胞的聚集體,它的形成受到QS調(diào)節(jié)[43]。如表2所示,除迷迭香酸和丁香油外,多數(shù)植物源QSI能夠抑制氣單胞菌生物被膜的形成。大量資料證明,QS在許多病原微生物的生物被膜發(fā)育中起著重要作用,并觸發(fā)它們的耐藥性和毒力[44]。通過(guò)抑制生物被膜的形成,可以降低致病菌的致病性和毒性,如香芹酚與N-丁酰基-L-高絲氨酸內(nèi)酯競(jìng)爭(zhēng)結(jié)合受體LuxR和AsaR來(lái)抑制殺鮭氣單胞菌生物被膜的形成,減少由殺鮭氣單胞菌引起的微生物污染和腐敗[45]。研究表明姜黃素脂質(zhì)、歐洲栗提取物、鄰氨基苯甲酸甲酯可通過(guò)與LuxI蛋白相互作用阻斷大豆氣單胞菌AHLs信號(hào)分子的合成[46-48]。香蘭素、香芹酚和鄰氨基苯甲酸甲酯可通過(guò)干擾AHLs信號(hào)分子與受體蛋白的結(jié)合來(lái)抑制殺鮭氣單胞菌QS[49]。
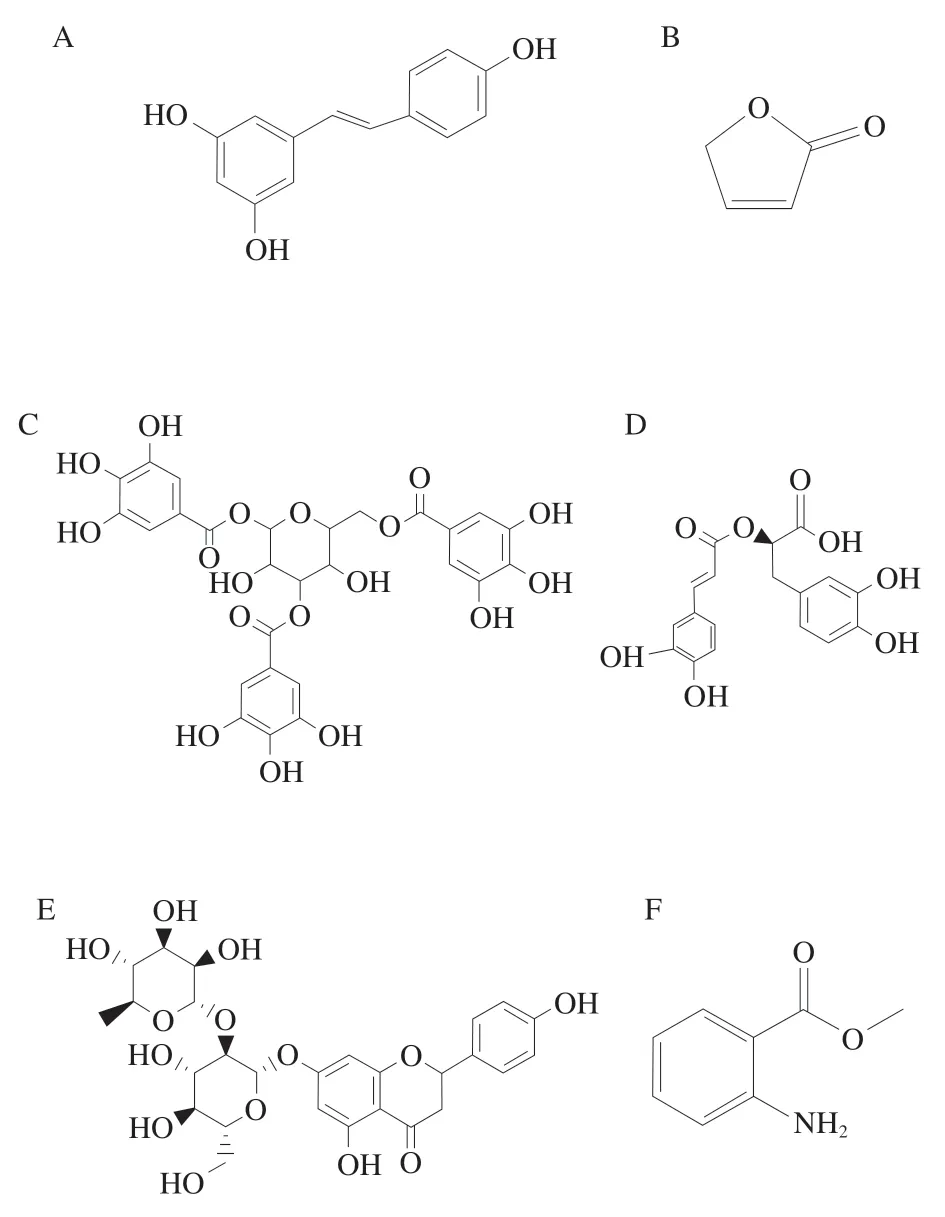

圖4 氣單胞菌的植物來(lái)源QSI結(jié)構(gòu)Fig.4 Chemical structures of plant-derived QSIs of Aeromonas
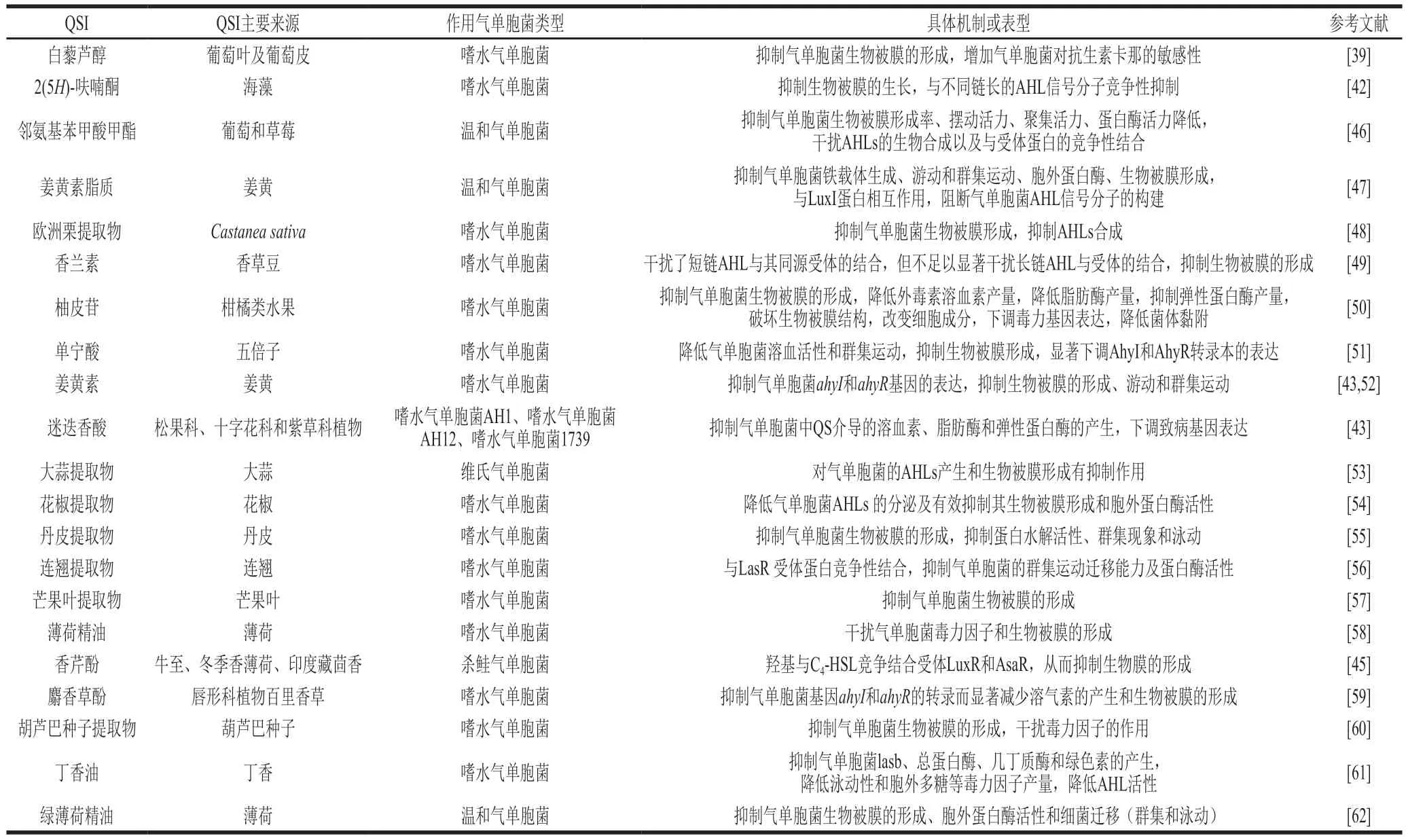
表2 植物源氣單胞菌QSI及其QS抑制作用Table 2 Inhibitory effect of plant-derived QSIs on QS of Aeromonas
2.2 微生物和動(dòng)物來(lái)源氣單胞菌QSI
氣單胞菌的微生物和動(dòng)物來(lái)源QSI如表3所示,它們多通過(guò)降解信號(hào)分子AHLs對(duì)QS進(jìn)行阻斷,根據(jù)降解AHLs位點(diǎn)的不同,又可將這些QSI分為兩種類型:1)AHL內(nèi)酯酶,催化AHL內(nèi)酯環(huán)水解產(chǎn)生N-酰基高絲氨酸從而破壞AHL結(jié)構(gòu),如芽孢桿菌產(chǎn)生的AiiAAI96可以催化水解維氏氣單胞菌LP-11產(chǎn)生的AHLs[63];2)AHL酰胺酶,催化AHL的酰胺鍵水解并生成脂肪酸和高絲氨酸內(nèi)酯,如豬腎中的Acylase I催化水解嗜水氣單胞菌的AHLs[64]。另外,還有一些微生物源QSI抑制機(jī)制尚不清楚,如植物乳桿菌(Lactobacillus plantarum)CY 1-1在與溫和氣單胞菌共培養(yǎng)時(shí)降低了溫和氣單胞菌短鏈AHLs的產(chǎn)量,抑制甚至破壞其生物膜結(jié)構(gòu),抑制其胞外蛋白酶活性、溶血活性、鐵載體合成和運(yùn)動(dòng)性[65];枯草芽孢桿菌(Bacillus subtilis)能干擾嗜水氣單胞菌luxS基因和毒力基因的表達(dá),減弱嗜水氣單胞菌對(duì)細(xì)胞因子誘導(dǎo)的殺傷細(xì)胞的細(xì)胞毒性[66]。

表3 氣單胞菌微生物和動(dòng)物來(lái)源QSI及其QS抑制作用Table 3 Inhibitory effect of microbe-and animal-derived QSIs on QS of Aeromonas
2.3 化學(xué)合成氣單胞菌QSI
目前臨床上使用的抗生素多是以殺死微生物或抑制微生物的生長(zhǎng)來(lái)控制病原微生物,由此導(dǎo)致了耐藥細(xì)菌比例增加,部分致病菌形成耐藥性[75]。致病性氣單胞菌通常采用抗生素進(jìn)行治療和控制,這就會(huì)引起其抗生素耐藥性增加[76]。QSI多抑制病原體QS而不影響病原體的生長(zhǎng),因此利用QSI處理病原微生物不會(huì)增強(qiáng)其耐藥性,目前QSI已成為控制細(xì)菌感染藥物研發(fā)的新方向,但這類藥物的開發(fā)仍處在起步階段[76]。抑制氣單胞菌QS的合成類藥物如表4所示,這些化學(xué)合成QSI都能抑制氣單胞菌生物被膜的形成,其中烷基喹惡啉-2-(1H)-酮可以改變豚鼠氣單胞菌信號(hào)分子AHL的內(nèi)酯部分[77];頭孢他啶、1,10-癸二醇、脫氫乙酸鈉和乙基麥芽酚都能夠抑制氣單胞菌蛋白酶活性[78-81],另外(-)-二甲基-2,3-鄰異丙亞基-L-酒石酸酯通過(guò)模擬AI-2信號(hào)分子競(jìng)爭(zhēng)其結(jié)合位點(diǎn)抑制氣單胞菌QS,從而抑制氣單胞菌生物被膜的形成[36]。

表4 化學(xué)來(lái)源QSI及其QS抑制作用Table 4 Inhibitory effect of chemically synthesized QSIs on QS of Aeromonas
3 氣單胞菌QSI在水產(chǎn)品防腐和水產(chǎn)病害控制方面的應(yīng)用與展望
3.1 水產(chǎn)品防腐
水產(chǎn)品腐敗主要由微生物相互作用引起,抑制微生物生長(zhǎng)和調(diào)節(jié)微生物群組成可能是防止魚類和甲殼類水產(chǎn)品品質(zhì)劣變的重要方法[82]。高濃度的鹽或糖以及多種化學(xué)添加劑可以有效延長(zhǎng)水產(chǎn)品保質(zhì)期,但這些傳統(tǒng)的抑菌防腐方法可能帶來(lái)健康問(wèn)題。近年來(lái)研究顯示水產(chǎn)品腐敗可能與腐敗菌QS有關(guān)[17,24,83-85],如大黃魚腐敗過(guò)程中,優(yōu)勢(shì)腐敗菌波羅的海希瓦氏菌(Shewanella baltica)能產(chǎn)生并積累4 種二酮哌嗪類(diketopiperazines,DKPs)QS信號(hào)分子,將波羅的海希瓦氏菌接種到滅菌魚露中并添加DKPs后培養(yǎng),魚露的總揮發(fā)性鹽基氮(total volatile basic nitrogen,TVB-N)含量顯著增加,表明信號(hào)分子DKPs能增強(qiáng)波羅的海希瓦氏菌對(duì)魚露的腐敗能力[86];此外,Christensen等[87]發(fā)現(xiàn)冷熏三文魚優(yōu)勢(shì)腐敗菌變形斑沙雷氏菌(Serratia proteamaculans)B5a能產(chǎn)生AHLs信號(hào)分子3-氧代-己酰基高絲氨酸內(nèi)酯(3-oxo-C6),缺失sprI基因(3-oxo-C6合成基因)的突變體中胞外蛋白酶、脂肪酶、幾丁質(zhì)酶活性均受QS調(diào)控,以上研究結(jié)果表明通過(guò)阻斷腐敗菌QS可以抑制水產(chǎn)品腐敗。
一些QSI已被證實(shí)能夠延緩水產(chǎn)品腐敗,如外源添加5’-胞苷酸和5’-腺苷酸可以抑制熒光假單胞菌和希瓦氏菌細(xì)胞外蛋白酶、鐵載體和TVB-N的產(chǎn)生,延緩鮭魚片在低溫貯藏期間的腐敗過(guò)程[88]。Li Tingting等[89]發(fā)現(xiàn)肉桂醛可以抑制熒光假單胞菌TVB-N的產(chǎn)生,延長(zhǎng)大菱鲆的貯藏期。
氣單胞菌廣泛分布于水環(huán)境中,因此魚蝦等水產(chǎn)品容易受到氣單胞菌污染,且較多研究表明低溫貯藏條件下大西洋鮭、鯛魚、鯉魚、草魚、白鰱、熱帶蝦、凡納濱對(duì)蝦等水產(chǎn)品的優(yōu)勢(shì)腐敗菌為氣單胞菌[90-95]。在一些研究中氣單胞菌被證實(shí)具有分泌脂肪酶和蛋白酶能力[96],且會(huì)引起水產(chǎn)品腐敗異味和氧化三甲胺含量減少[91]、TVB-N和腐胺等胺代謝物積累[24]。因此抑制水產(chǎn)品中氣單胞菌活性對(duì)預(yù)防水產(chǎn)品腐敗變質(zhì)具有重要作用。鱘魚腐敗菌維氏氣單胞菌LP-11能夠產(chǎn)生4 種AHLs,維氏氣單胞菌LP-11與腐敗相關(guān)的生物學(xué)功能(如蛋白酶活性、運(yùn)動(dòng)性以及對(duì)糖類、氨基酸等營(yíng)養(yǎng)物質(zhì)的轉(zhuǎn)運(yùn)能力)受QS調(diào)控[17,63];Zhao Dandan等[24]研究發(fā)現(xiàn)通過(guò)外源添加C8信號(hào)分子可促進(jìn)維氏氣單胞菌在魚糜中產(chǎn)生TVB-N和腐胺,說(shuō)明氣單胞菌QS參與調(diào)控魚糜腐敗。利用氣單胞菌QSI延緩水產(chǎn)品腐敗的研究較少,有研究表明以AiiAAI96作為氣單胞菌QSI處理鱘魚肉,可抑制鱘魚肉腐敗菌維氏氣單胞菌LP-11的產(chǎn)蛋白酶活性和運(yùn)動(dòng)活性,延緩鱘魚肉的腐敗速率[63]。綜上,氣單胞菌QS在水產(chǎn)品腐敗中的作用和調(diào)控機(jī)制還有待進(jìn)一步研究,氣單胞菌QSI在水產(chǎn)品防腐保鮮領(lǐng)域的應(yīng)用潛力值得深入挖掘。
3.2 水產(chǎn)病害控制
氣單胞菌是水產(chǎn)養(yǎng)殖環(huán)境中頻繁暴發(fā)的主要病原體[50],且嗜水氣單胞菌和殺鮭氣單胞菌導(dǎo)致魚類患出血性敗血癥和癤病[97]。dos Reis Ponce-Rossi等[98]發(fā)現(xiàn)QS調(diào)控嗜水氣單胞菌水解酪蛋白、脂質(zhì)、淀粉的活性以及β型溶血活性;Schwenteit等[99]發(fā)現(xiàn)等位基因交換構(gòu)建的殺鮭氣單胞菌AsaI敲除突變體的毒性蛋白酶AsaP1和1 種細(xì)胞毒性因子表達(dá)受損;Rasch等[40]發(fā)現(xiàn)含硫AHL類似物會(huì)降低殺鮭氣單胞菌產(chǎn)生蛋白酶的能力。
微生物聚集形成生物膜也是水生生物致病的重要因素[67,100]。抑制生物膜的形成是對(duì)抗細(xì)菌感染的新策略之一,阻斷細(xì)菌QS有助于抑制生物膜形成,從而降低食源性疾病的發(fā)病率[44]。QSI能抑制病原菌毒力相關(guān)基因的表達(dá),減弱水產(chǎn)養(yǎng)殖病原菌的毒力[101]。目前已有不少研究應(yīng)用QSI抑制氣單胞菌生物膜和毒力因子的形成從而減少氣單胞菌引起的水產(chǎn)病害。Chu Weihua等[71]發(fā)現(xiàn)AHLs降解菌顯著降低了嗜水氣單胞菌YJ-1菌株對(duì)斑馬魚的致病性;Srinivasan等發(fā)現(xiàn)柚皮苷是嗜水氣單胞菌QSI,且能夠抑制嗜水氣單胞菌的毒力因子的表達(dá)和感染能力[50];Natrah等[102]發(fā)現(xiàn)QSI肉桂醛保護(hù)沙丁魚幼魚免受嗜水氣單胞菌的侵襲。因此,氣單胞菌QSI在水產(chǎn)病害防治方面具有廣闊的開發(fā)和應(yīng)用前景。
氣單胞菌是水產(chǎn)品常見(jiàn)腐敗菌和致病菌,通常具有AI-1類QS系統(tǒng)。氣單胞菌QS系統(tǒng)為預(yù)防和控制氣單胞菌危害提供了一種新策略。安全、綠色、高效的氣單胞菌QSIs具有廣闊的市場(chǎng)前景,且對(duì)水產(chǎn)品防腐保鮮和養(yǎng)殖病害防控具有深遠(yuǎn)意義。

