機械損傷對人氣道上皮細胞生長的影響
賴燕婷 曾惠清 張孝斌
良性氣道狹窄指因各類良性病變引起的氣道狹窄,臨床表現為咳嗽、反復呼吸道感染、不同程度的呼吸困難甚至窒息。成人良性氣道狹窄常見病因為結核、氣管插管和氣管切開術后氣道狹窄[1-2]。隨著重癥醫學和呼吸支持技術的發展,接受氣管插管、氣管切開的病人數量上升,其導致氣道狹窄的發生率升高[3]。據報道氣管插管2周左右、拔管后1個月左右即可發生氣管狹窄[4]。相較于惡性氣道狹窄,良性氣道狹窄患者生存期長、遠期并發癥多,反復住院,生活質量差,越來越受到人們的關注,已成為研究熱點。本研究旨在通過機械劃痕模擬氣管插管對氣道損傷作用,通過測量造模后細胞生長情況,在細胞水平層面探討機械損傷對氣道上皮細胞的作用,探討氣管插管所致氣管狹窄可能的發生發展機制。
資料與方法
一、實驗材料
人支氣管上皮細胞(16HBE)、16HBE專用完全培養液外購于賽百慷公司。DMEM培養基購于hyclone公司;DAB顯色試劑盒、(Mouse/Rabbit)IHC Kit購于福州邁新;CCK8試劑盒購于Biosharp;TGF-β抗體購于bioss公司;β-catenin抗體購于abcam公司;HIF-1α抗體購于proteintch公司;蘇木精染色劑購于SIGMA公司。本研究倫理審批號:xmzsyyky論審第(2021-065)號。
二、細胞培養
三、細胞造模
本課題組參照文獻報道的方法[5-6],建立上皮細胞機械損傷模型。具體步驟如下:16HBE細胞100%融合后進行換液,然后用20μL的槍頭在單層細胞上以間隔縱橫劃8條寬約0.5mm缺口,無血清培養基培養3 h后棄去,加新鮮的無血清培養基繼續培養24h,將培養后上清液加入16HBE專用完全培養液建立條件培養液。
四、HBE細胞處理
將16HBE分為2組,每組各設置3個亞組進行重復試驗,其中A1組用16HBE專用完全培養液培養,A2組用條件培養基培養,培養5天,倒置熒光顯微鏡觀察各組細胞的形態。
五、細胞增殖活性及細胞分子檢測
1 CCK8法檢測細胞增殖情況
細胞按照3000個/孔,鋪板96孔板,待細胞貼壁后分組進行處理。處理48 h后,丟棄舊的培養基,加入CCK8試劑進行細胞活力檢測,2h內讀取OD450值。具體步驟參照各種試劑說明書進行。
2 免疫細胞化學
利用免疫細胞化學檢測處理后16HBE中TGF-β、β-catenin、HIF-1表達水平。具體步驟如下:1)阻斷、滅活內源性過氧化物酶;2)正常羊血清工作液封閉非特異位點;3)相應細胞因子一抗、二抗孵育;4)DAB反應染色、蘇木素復染、脫水透明,中性樹膠封片;5)拍照存檔。具體步驟參照各種試劑說明書進行;各抗體工作濃度按說明書進行稀釋。
3 HE染色
蘇木精-伊紅染色方法對細胞處理后16HBE進行染色;具體步驟均參照各種試劑說明書進行。
材料中“黨的十八屆會議審議通過《建議》”體現中共的相應知識點,比如:執政黨、領導核心、執政方式;“國家發改委啟動建言獻策活動”體現公民參與民主決策;“政府編制‘十三五’綱要”體現政府科學民主決策等等。通過分析,既把握材料的中心思想和層次性,又建立了與知識點的聯系。
六、統計學分析
采用 SPSS 22.0軟件進行統計學分析,兩組間比較用t檢驗,P<0.05為差異有統計學意義。
結 果
一、細胞基礎培養
人支氣管上皮細胞16HBE基礎培養生長情況(圖1)所示,細胞生長狀態良好。
圖1 細胞基礎培養生長情況(×100)
二、16HBE細胞造模
16HBE造模前后生長情況,細胞生長狀態良好(圖2)所示。
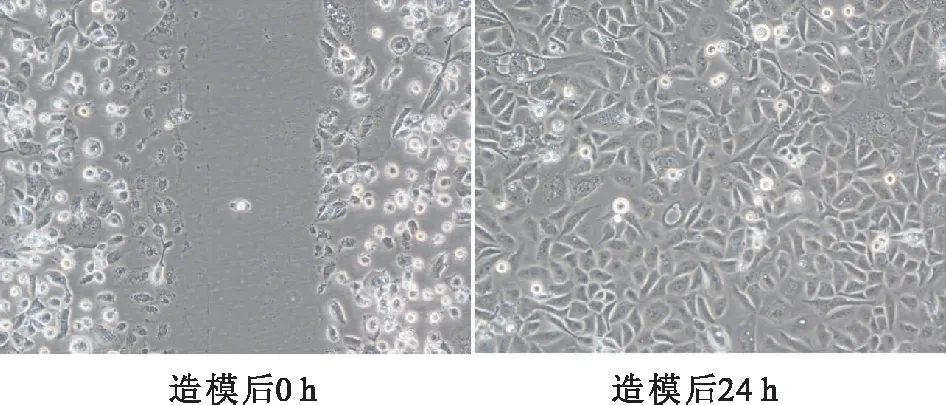
圖2 細胞造模前后生長情況(×100)
三、16HBE細胞處理后生長情況
將16HBE分組培養5天后,倒置熒光顯微鏡觀察各組細胞的形態,兩組細胞均表現為扁平、核大而圓、形態不規則,細胞間彼此連接緊密,細胞連接處清晰可見,(圖3)所示。
四、細胞計數
將16HBE分組培養后進行細胞計數,各組數量比較(圖4)所示,造模后,細胞數量顯著降低(P<0.05)。
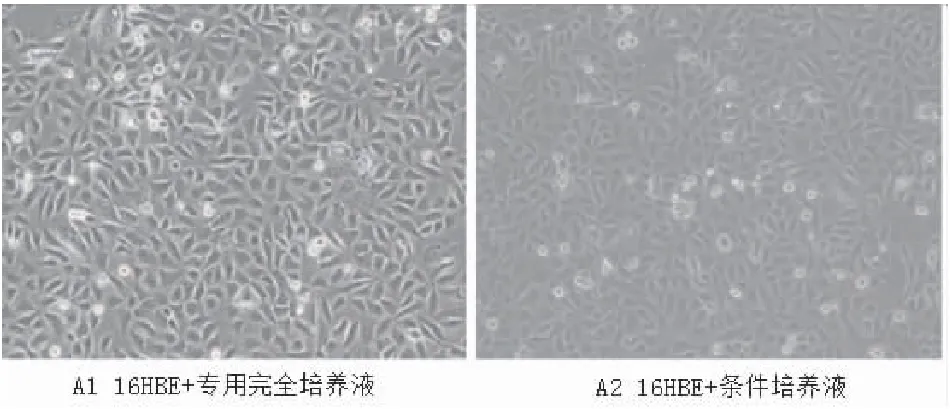
圖3 人支氣管上皮細胞(16HBE)分組培養后細胞生長情況(×100)

圖4 人支氣管上皮細胞(16HBE)分組培養后細胞數量對比
五、CCK8檢測
將16HBE分組培養后用CCK8檢測法分析兩組細胞增殖情況,結果(圖5)所示,造模后,細胞活性顯著降低(P<0.05)。
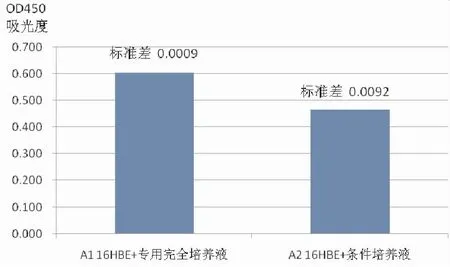
圖5 人支氣管上皮細胞(16HBE)分組培養后CCK8法檢測細胞增殖活性(OD450吸光度對比情況)
六、免疫細胞化學
將16HBE分組培養后免疫細胞化學分析TGF-β、β-catenin、HIF-1表達情況,使用Image J軟件分析組化圖像,結果(圖6)所示,原圖(圖7)所示。結果顯示,造模后TGF-β、β-catenin、HIF-1α表達升高(P<0.05)。
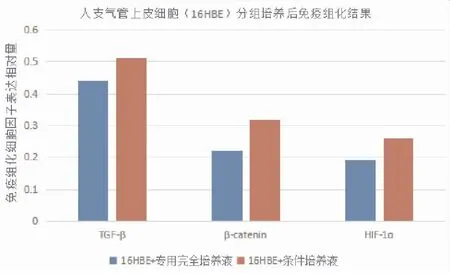
圖6 人支氣管上皮細胞(16HBE)分組培養后免疫細胞化學測定細胞因子結果
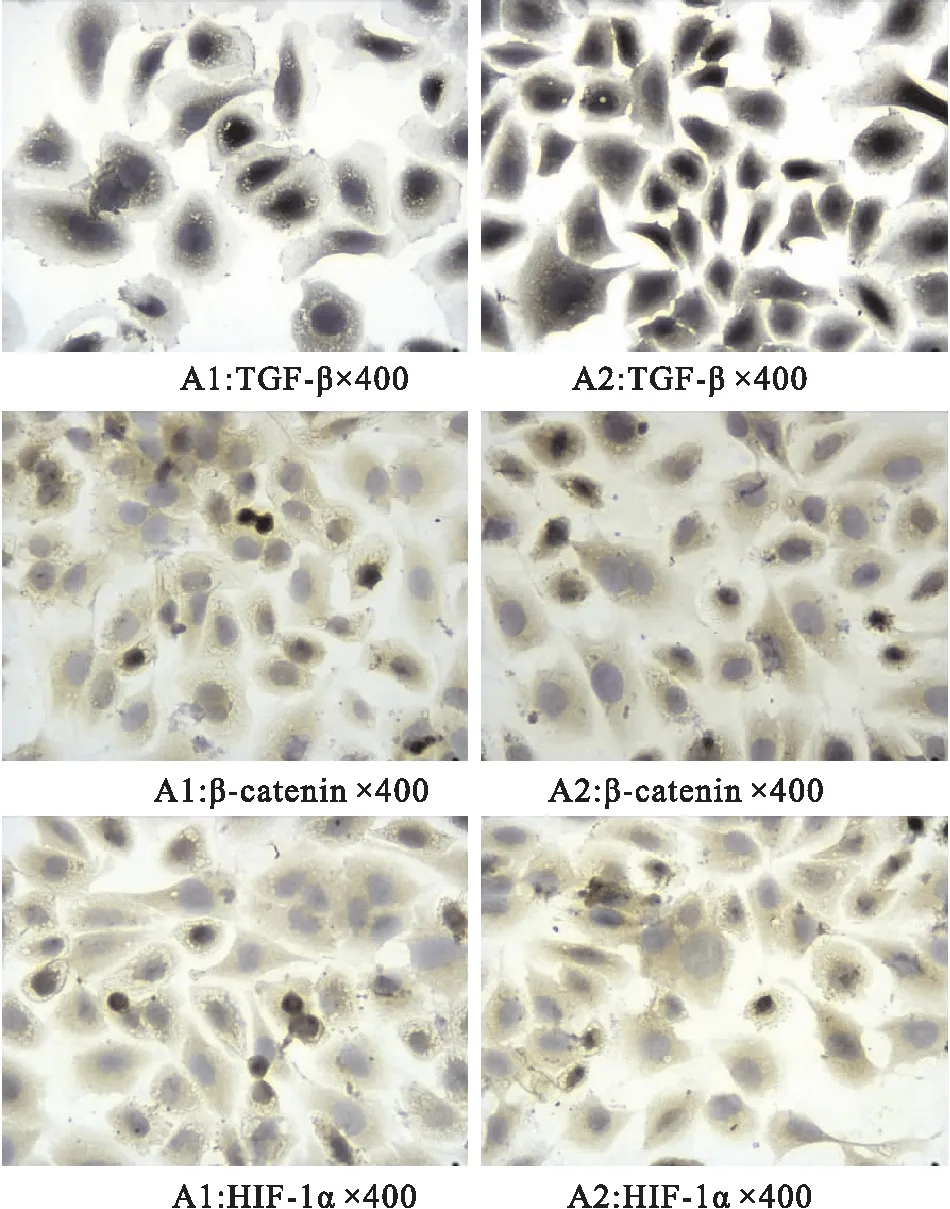
圖7 16HBE細胞分組培養后免疫細胞化學DAB染色(×400)
七、HE染色
將16HBE分組培養后,HE染色顯微鏡下觀察細胞變化情況,造模后細胞形態未變,胞核染色未變,胞質淡染,結果(如圖8)所示。
討 論
氣管插管和氣管切開是導致氣道良性狹窄的主要病因,此類患者生存期長,生活質量差,醫療資源及經濟資源消耗大,越來越受到人們關注,其參與介導氣道狹窄的分子機制復雜,且關于這方面的基礎研究不足。
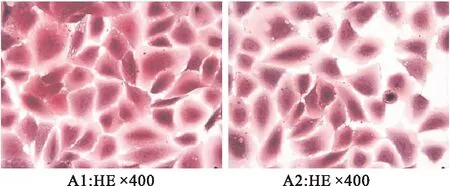
圖8 HE(蘇木精-伊紅染色)染色(×400)
良性氣道狹窄的發生是氣道粘膜損傷和異常修復的過程[7],最終導致氣道重塑。當氣道粘膜破壞時,炎癥細胞浸潤、增生、分化,新生血管形成,其中成纖維細胞分泌大量膠原纖維,造成膠原沉積,肉芽組織老化脫水,成纖維細胞變成具有收縮表現的肌成纖維細胞,發生組織攣縮及瘢痕狹窄,在氣道狹窄中起重要作用。
氣道重塑過程中,TGF-β過度表達,促進成纖維細胞的募集及向肌成纖維細胞分化,細胞外基質過表達、沉淀和細胞外基質降解減少,參與氣道狹窄的形成。Simpson等[8]對聲門下氣道狹窄模型犬注射抗TGF-β,發現其可明顯減輕氣道狹窄,從動物層面驗證了TGF-β在氣道狹窄中的作用。隨訪119例氣管支氣管結核患者,氣管鏡評估氣管狹窄發生情況,分析血液TGF-β濃度,發現氣道狹窄組TGF -β水平較非狹窄組明顯升高[9]。國內學者一項關于大鼠氣管移植后移植體狹窄的研究發現,對比對照組,氣管移植體內TGF-β1表達量明顯增加,且其變化趨勢與上皮細胞間質轉化動態變化趨勢一致,其研究證明TGF-β/Smad信號通路參與氣管移植后移植體狹窄[10]。
TGF-β和Wnt都是調節上皮間質轉化(EMT)的重要通路,Wnt/β-catenin通路中當Wnt信號激活后可激活胞內蛋白DVL,抑制GSK3β等蛋白形成的β-catenin降解復合物的降解活性,穩定細胞質中游離狀態的β-catenin蛋白。β-catenin進入細胞核后結合LEF/TCF轉錄因子家族,啟動下游靶基因(如c-myc、Cyclin D1等)的轉錄,誘導EMT轉換,介導氣道重塑發生。在哮喘小鼠中, 通過抑制Wnt/β-catenin通路, 小鼠上皮下纖維化及膠原累積明顯減少, 氣道重塑程度明顯降低[11]。
HIF-1是一種低氧誘導結合蛋白,在低氧環境下,HIF-1α亞基的降解被抑制,1α和β亞基形成有活性的HIF-1,轉移到細胞核內調節多種基因的轉錄,包括VEGF的表達增強,參與炎癥反應。Cai[12]等人分析了24例氣管插管后氣道狹窄患者氣道增生組織中HIF-1α表達情況,發現HIF-1α在氣道肉芽組織中持續存在,參與氣管插管后氣道狹窄的發病過程,認為其可能是啟動和促進這一過程的潛在關鍵調節因子。
本研究通過機械劃痕模擬插管機械損傷,對氣道上皮細胞進行損傷造模,利用造模后培養基對氣道上皮細胞進行培養,對比細胞數及凋亡率,探討機械損傷對氣道上皮細胞增生的影響,結果顯示造模后氣道上皮細胞的生長速度減慢,且活性降低,差異具有統計學意義,說明機械損傷可抑制氣道上皮細胞的正常生長。免疫細胞化學進一步分析兩組細胞因子變化,發現造模后細胞TGF-β、β-catenin升高,差異具有統計學意義,提示機械損傷破壞上皮細胞后可產生無菌性炎癥,促發損傷修復機制,同感染性炎癥介導氣道重塑相似,導致炎癥性細胞因子TGF-β、β-catenin過表達,說明TGF-β及Wnt/β-catenin通路可能是機械損傷后氣道修復的作用機制。氣管插管對氣道粘膜造成機械損傷的同時,由于氣管插管套囊長時間壓迫,粘膜局部缺血缺氧,導致缺氧因子HIF-1過表達,本研究在細胞層面證實了機械損傷下HIF-1的升高,證實缺氧參與了機械損傷介導的炎癥反應。綜上,本研究認為機械損傷可抑制氣道上皮細胞的正常生長;缺氧及TGF-β、Wnt/β-catenin通路可能參與了氣道機械損傷后的修復過程。在此,我們提出假設,機械損傷可通過TGF-β、Wnt/β-catenin通路及HIF-1參與其氣道修復過程,抑制氣道上皮細胞的正常增殖,誘導氣道上皮細胞間質轉化,促進上皮重塑,導致氣道發生狹窄,這需要進一步行細胞及動物實驗進行驗證。

